中考化学-酸碱盐知识点归纳Word文档格式.doc
《中考化学-酸碱盐知识点归纳Word文档格式.doc》由会员分享,可在线阅读,更多相关《中考化学-酸碱盐知识点归纳Word文档格式.doc(11页珍藏版)》请在冰豆网上搜索。
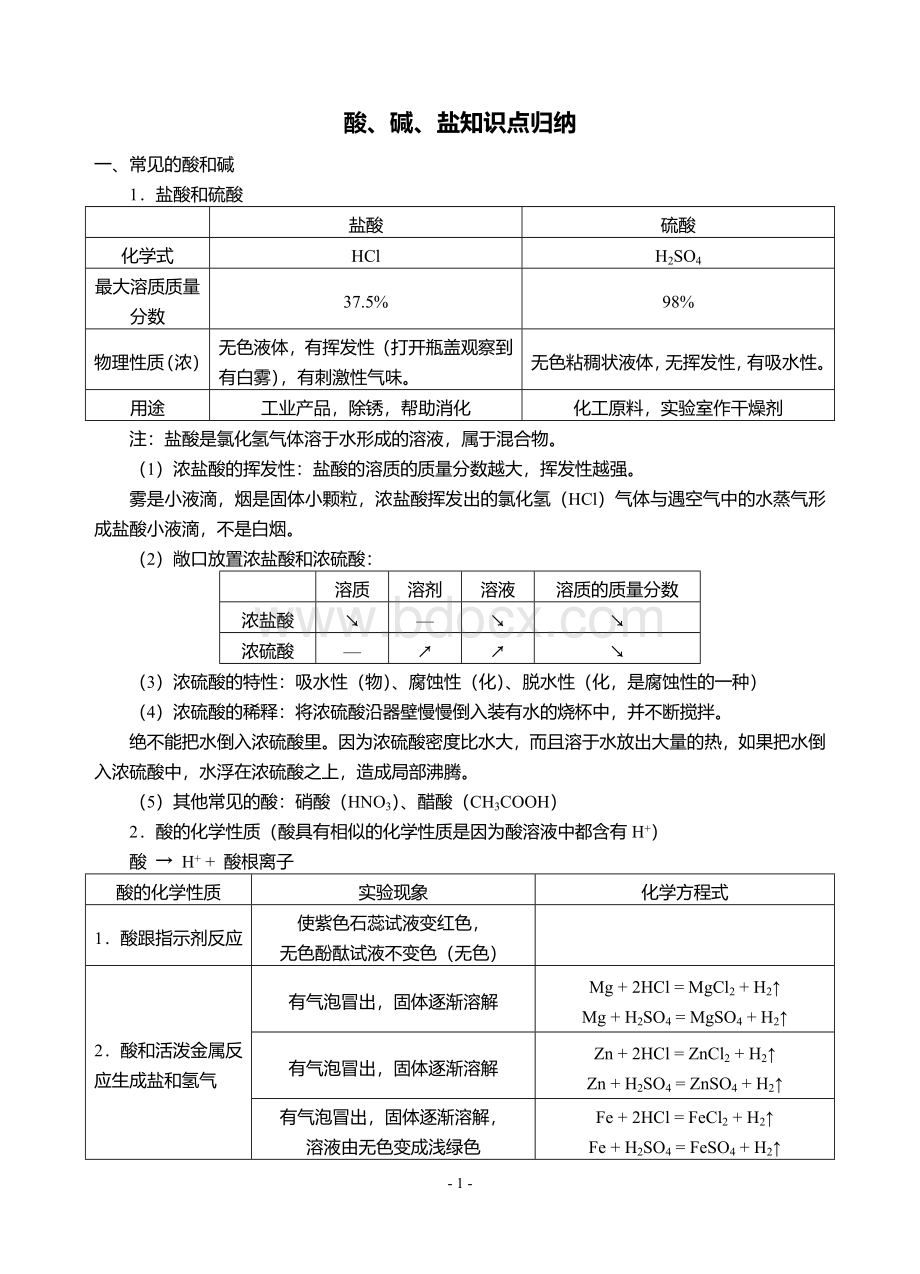
浓盐酸
↘
—
浓硫酸
↗
(3)浓硫酸的特性:
吸水性(物)、腐蚀性(化)、脱水性(化,是腐蚀性的一种)
(4)浓硫酸的稀释:
将浓硫酸沿器壁慢慢倒入装有水的烧杯中,并不断搅拌。
绝不能把水倒入浓硫酸里。
因为浓硫酸密度比水大,而且溶于水放出大量的热,如果把水倒入浓硫酸中,水浮在浓硫酸之上,造成局部沸腾。
(5)其他常见的酸:
硝酸(HNO3)、醋酸(CH3COOH)
2.酸的化学性质(酸具有相似的化学性质是因为酸溶液中都含有H+)
酸→H++酸根离子
酸的化学性质
实验现象
化学方程式
1.酸跟指示剂反应
使紫色石蕊试液变红色,
无色酚酞试液不变色(无色)
2.酸和活泼金属反应生成盐和氢气
有气泡冒出,固体逐渐溶解
Mg+2HCl=MgCl2+H2↑
Mg+H2SO4=MgSO4+H2↑
Zn+2HCl=ZnCl2+H2↑
Zn+H2SO4=ZnSO4+H2↑
有气泡冒出,固体逐渐溶解,
溶液由无色变成浅绿色
Fe+2HCl=FeCl2+H2↑
Fe+H2SO4=FeSO4+H2↑
3.酸和金属氧化物反应生成盐和水
固体逐渐溶解,
溶液由无色变成黄色
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
溶液由无色变成蓝色
CuO+2HCl=CuCl2+H2O
CuO+H2SO4=CuSO4+H2O
4.酸和碱反应生成盐和水(中和反应)
NaOH+HCl=NaCl+H2O
Ca(OH)2+H2SO4=CaSO4+2H2O
5.酸和盐反应生成新酸和新盐
有白色沉淀生成,
加入稀硝酸,沉淀不溶解
AgNO3+HCl=AgCl↓+HNO3
BaCl2+H2SO4=BaSO4↓+2HCl
固体逐渐溶解,产生大量的气泡,
生成能使澄清石灰水变浑浊的气体
CaCO3+2HCl=CaCl2+H2O+CO2↑
3.氢氧化钠和氢氧化钙
氢氧化钠
氢氧化钙
NaOH
Ca(OH)2
俗名
烧碱、火碱、苛性钠
熟石灰、消石灰
物理性质
白色固体,有吸水性(易潮解),
易溶于水(溶于水溶液温度升高)。
白色粉末状固体,微溶于水。
(1)用石灰石、水、纯碱为原料制熟石灰、烧碱:
①石灰石→生石灰:
②生石灰→熟石灰:
CaO+H2O=Ca(OH)2,放出大量的热
③纯碱→烧碱:
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
(2)其他常见的碱:
氢氧化钾(KOH)、氨水(NH3·
H2O)
4.碱的化学性质(碱具有相似的化学性质是因为碱溶液中都含有OH-)
碱→金属离子+OH-
碱的化学性质
1.碱跟指示剂反应
使紫色石蕊试液变蓝色,无色酚酞试液变红色
2.碱和非金属氧化物反应生成盐和水
2NaOH+CO2=Na2CO3+H2O
吸收CO2
Ca(OH)2+CO2=CaCO3↓+H2O
澄清石灰水变浑浊,用于检验CO2
2NaOH+SO2=Na2SO3+H2O
吸收SO2
Ca(OH)2+SO2=CaSO3+H2O
3.碱和酸反应生成盐和水(中和反应)
2NaOH+H2SO4=Na2SO4+2H2O
Ca(OH)2+2HCl=CaCl2+2H2O
4.碱与铵盐反应
(NH4)2SO4+Ca(OH)2=CaSO4+2H2O+2NH3↑
NH4Cl+NaOH=NaCl+H2O+NH3↑
并不是所有非金属氧化物都能与碱反应,如H2O、CO。
5.浓硫酸、氢氧化钠事故的处理:
(1)浓硫酸:
立即用大量的水冲洗,并涂上3%~5%的碳酸氢钠溶液;
(2)氢氧化钠:
用较多的水冲洗,并涂上硼酸溶液。
6.常见的干燥剂:
因能与NH3反应,所以不能用于干燥NH3
(2)氢氧化钠固体:
因能与CO2、SO2等反应,所以不能用于干燥CO2、SO2
(3)生石灰:
吸收水分,食品的干燥剂,CaO+H2O=Ca(OH)2
(4)铁粉:
吸收氧气、水蒸气,抗氧化剂,食品的保鲜剂
7.氢氧化钠固体为什么要密封保存?
(1)氢氧化钠易吸收空气中的水而潮解;
(2)氢氧化钠易吸收空气中的二氧化碳而变质,2NaOH+CO2=Na2CO3+H2O
8.中和反应:
酸和碱作用生成盐和水的反应。
(1)NaOH+HCl=NaCl+H2O该反应无明显现象,为了便于观察,在NaOH溶液中滴几滴无色酚酞,溶液呈红色,再逐滴滴加稀盐酸,红色逐渐消失,证明NaOH与盐酸发生了反应。
(2)中和反应关键是“酸和碱之间的反应”。
Fe2O3+6HCl=2FeCl3+3H2O,CuO+H2SO4=CuSO4+H2O,2NaOH+CO2=Na2CO3+H2O
以上反应虽然有盐和水生成,但都不是中和反应。
所以说:
有盐和水生成的反应不一定是中和反应。
9.酸性氧化物、碱性氧化物:
金属
碱性
氧化物
碱
盐
非金属
酸性
酸
酸性氧化物+
水→酸
碱→盐+水(可溶性碱)
(1)酸性氧化物:
碱性氧化物+
水→碱(可溶性碱)
酸→盐+水
(2)碱性氧化物:
酸性氧化物→酸
水+碱性氧化物→碱(可溶性碱)
CuSO4→CuSO4·
5H2O
(3)水:
二、酸碱性和酸碱度
1.酸碱性:
酸性、碱性、中性。
注意:
呈酸性不等于一定是酸、呈碱性不等于一定是碱。
如纯碱不是碱,但其水溶液呈碱性,pH>
7。
2.酸碱度:
溶液酸碱性的强弱程度。
用pH表示,范围:
0~14。
(1)pH=7时,溶液呈中性;
滴入紫色石蕊试液不变色,滴入无色酚酞溶液不变色;
(2)pH<
7时,溶液呈酸性;
pH越小,酸性越强,越接近7,酸性越弱;
滴入紫色石蕊试液变红色,滴入无色酚酞溶液不变色;
(3)pH>
7时,溶液呈碱性,pH越大,碱性越强,越接近7,碱性越弱;
滴入紫色石蕊试液变蓝色,滴入无色酚酞溶液变红色。
3.一些pH变化的图像
4.pH试纸的使用注意事项:
(1)广泛pH试纸只能精确到整数;
(2)不能把pH试纸直接浸入待测液中,以免污染待测液;
(3)能不能事先湿润pH试纸?
不能,这样做相当于把待测液稀释了。
若将pH试纸先润湿,对实验结果有什么影响?
如果为酸性溶液,则pH偏大;
若为碱性溶液,则pH偏小;
若为中性溶液,则不影响。
5.雨水的pH:
因溶有CO2,生成碳酸:
H2O+CO2=H2CO3,所以正常的雨水呈酸性,pH约为5.6,若pH<
5.6,则为酸雨。
三、常见的盐(盐→金属离子+酸根离子)
1.氯化钠(化学式:
NaCl)
(1)俗名:
食盐
(2)用途:
生理盐水(0.9%)、调味品、消融公路积雪(降低水的熔点)
2.常见的碳酸盐
碳酸钙
碳酸钠
碳酸氢钠
CaCO3
Na2CO3
NaHCO3
大理石、石灰石的主要成分
纯碱(纯碱不是碱)、苏打
小苏打
常见用途
建筑业、补钙剂、
治疗胃酸过多
玻璃、造纸、纺织等、
焙制糕点
焙制糕点、治疗胃酸过多
3.碳酸盐的化学性质
(1)与酸反应
与盐酸反应
有大量气泡产生,生成能使澄清石灰水变浑浊的气体,固体逐渐溶解
常用于实验室制CO2
迅速产生大量气泡,生成能使澄清石灰水变浑浊的气体,固体溶解
Na2CO3+2HCl=2NaCl+H2O+CO2↑
迅速产生大量气泡,剧烈反应,生成能使澄清石灰水变浑浊的气体,固体溶解
NaHCO3+HCl=NaCl+H2O+CO2↑
①因为Na2CO3、NaHCO3与盐酸反应过快,不便于收集,因此不能用于实验室制取CO2。
②能够治疗胃酸过多的物质:
MgO、Mg(OH)2、CaCO3、NaHCO3、Al(OH)3。
(2)与碱反应
碳酸钠与澄清石灰水
有白色沉淀生成
碳酸钠与Ba(OH)2溶液
Na2CO3+Ba(OH)2=BaCO3↓+2NaOH
(3)与盐反应
碳酸钠与Ba(NO3)2溶液
Na2CO3+Ba(NO3)2=BaCO3↓+2NaNO3
碳酸钠与CaCl2溶液
Na2CO3+CaCl2=CaCO3↓+2NaCl
4.盐的化学性质
盐的化学性质
1.盐(可溶)与金属反应生成新盐和新金属
2AgNO3+Cu=Cu(NO3)2+2Ag
Fe+CuSO4=FeSO4+Cu
2.盐和酸反应生成新盐和新酸
H2SO4+BaCl2=BaSO4↓+2HCl
3.盐(可溶)与碱(可溶)反应生成新盐和新碱
(NH4)2SO4+2NaOH=Na2SO4+2H2O+2NH3↑
4.盐(可溶)与盐(可溶)反应生成新盐和新盐
NaCl+AgNO3=AgCl↓+NaNO3
Na2CO3+BaCl2=BaCO3↓+2NaCl
四、复分解反应
1.复分解反应的特点:
(1)反应物和生成物都是化合物;
(2)反应物之间一定要互相交换成分。
①酸、碱、盐之间的反应都是复分解反应,金属氧化物与酸的反应是复分解反应;
②非金属氧化物与碱的反应不是复分解反应,如:
2NaOH+CO2=Na2CO3+H2O。
2.复分解反应的条件:
(1)两种反应物必须都是可溶的!
但难溶于水的金属氧化物、难溶性碱、难溶性的碳酸盐却能与盐酸、硫酸、硝酸等强酸反应(能溶于酸)。
能否进行反应
理由
Fe2O3+6HCl=FeCl3+3H2O
能
Fe2O3能溶于酸
CaCO3+2HCl=