高中化学盐类的水解第2课时影响盐类水解的主要因素和盐类水解反应的利用学案文档格式.docx
《高中化学盐类的水解第2课时影响盐类水解的主要因素和盐类水解反应的利用学案文档格式.docx》由会员分享,可在线阅读,更多相关《高中化学盐类的水解第2课时影响盐类水解的主要因素和盐类水解反应的利用学案文档格式.docx(17页珍藏版)》请在冰豆网上搜索。
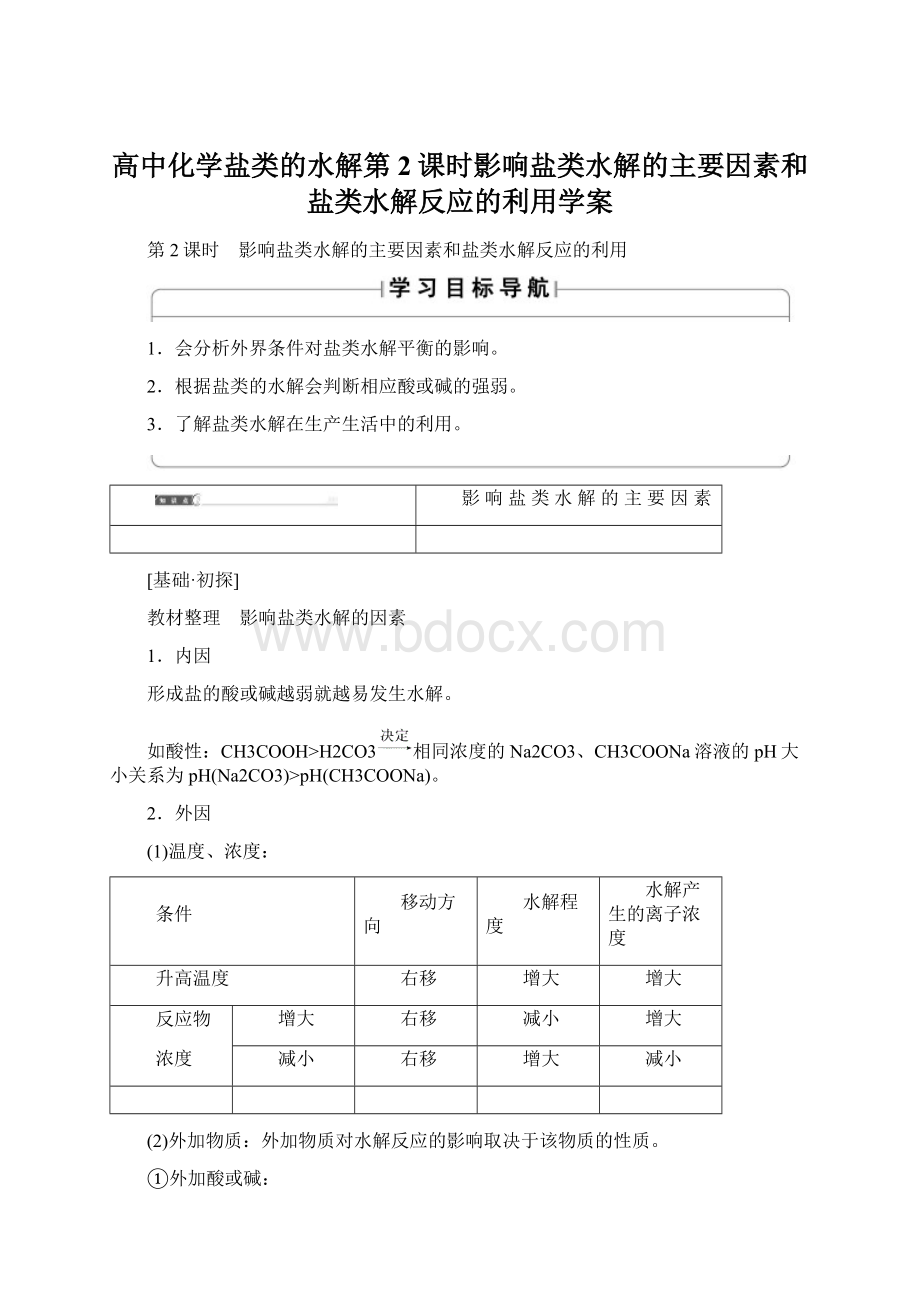
反应物
浓度
减小
(2)外加物质:
外加物质对水解反应的影响取决于该物质的性质。
①外加酸或碱:
外加物质
对水解程度的影响
弱酸阴离子
弱碱阳离子
酸
碱
②加能水解的盐:
[探究·
升华]
[思考探究]
25℃时,部分物质的电离平衡常数如表所示:
化学式
CH3COOH
H2CO3
HClO
电离平
衡常数
1.7×
10-5mol·
L-1
K1=4.3×
10-7mol·
K2=5.6×
10-11mol·
3.0×
10-8mol·
问题思考:
(1)CH3COOH、H2CO3、HClO的酸性大小如何?
【提示】 酸性:
H2CO3>
HClO。
(2)同浓度的CH3COO-、HCO、CO、ClO-结合质子(H+)的能力大小顺序如何?
【提示】 结合H+能力:
CO>
ClO->
HCO>
CH3COO-。
(3)同浓度的CH3COONa、NaHCO3、Na2CO3、NaClO溶液的pH大小顺序如何?
【提示】 pH:
Na2CO3>
NaClO>
NaHCO3>
CH3COONa。
(4)分析上述问题得出决定盐类水解的主要因素是什么?
【提示】 盐本身的性质。
[认知升华]
盐类水解的影响因素
内因
反应物本身的性质,即组成盐的弱酸阴离子或弱碱阳离子对应的酸或碱越弱,盐的水解程度越大
温度
盐的水解反应是吸热反应,因此升高温度促进盐的水解,降低温度抑制盐的水解
盐浓度越小,水解程度越大
盐浓度越大,水解程度越小
酸碱性
加酸抑制阳离子水解,促进阴离子水解;
加碱抑制阴离子水解,促进阳离子水解
“同离子”
效应
向能水解的盐溶液中加入与水解产物相同的离子,水解被抑制;
若将水解产物消耗掉,则促进水解
[题组·
冲关]
1.0.1mol·
L-1的K2CO3溶液中,由于CO的水解,使得c(CO)<
0.1mol·
L-1。
如果要使c(CO)更接近于0.1mol·
L-1,可以采取的措施是( )
A.加入少量盐酸 B.加入适量的水
C.加入适量的KOHD.加热
【解析】 A项发生反应:
2H++CO===CO2↑+H2O,CO浓度更小;
B项和D项均促进CO水解,CO浓度更小;
C项KOH抑制CO的水解,正确。
【答案】 C
2.使0.1mol·
L-1的NH4Cl溶液pH减小的措施是( )
A.加入金属镁B.加入Na2O2
C.加入NH4NO3晶体D.加入小苏打
【解析】 加入Mg、Na2O2、NaHCO3均消耗H+,使c(H+)减小,pH增大;
加入NH4NO3晶体,c(NH)增大,使水解平衡NH+H2ONH3·
H2O+H+正向移动,c(H+)增大,pH减小。
3.向CH3COONa稀溶液中加入(或通入)少许X物质,其溶液中部分微粒的浓度变化如表所示(溶液温度不变)。
X物质是下列物质中的( )
微粒
H+
OH-
CH3COO-
物质的量浓度
A.氢氧化钠B.氯化氢
C.蒸馏水D.磷酸钠
【解析】 减小了溶液中OH-浓度,平衡CH3COO-+H2OCH3COOH+OH-右移,c(H+)增大,c(OH-)减小,c(CH3COO-)减小,c(CH3COOH)增大,加入的物质应为酸。
【答案】 B
4.室温下,将0.05molNa2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是( )
加入的物质
结论
A.50mL1mol·
L-1H2SO4
反应结束后,
c(Na+)=c(SO)
B.0.05molCaO
溶液中增大
C.50mLH2O
由水电离出的c(H+)·
c(OH-)不变
D.0.1molNaHSO4固体
反应完全后,溶液pH减小,c(Na+)不变
【解析】 A项,Na+的物质的量为0.1mol,而SO的物质的量为0.05mol,混合溶液中Na+与SO的浓度不可能相等。
B项,加入0.05molCaO后,会生成Ca(OH)2,Ca(OH)2与Na2CO3反应生成CaCO3沉淀和NaOH,溶液中c(OH-)增大,CO水解产生的HCO减少,故溶液中增大。
C项,加入水后,c(Na2CO3)减小,CO水解产生的c(OH-)减小,溶液中的OH-来源于水的电离,因水电离产生的c(OH-)=c(H+),故由水电离出的c(H+)·
c(OH-)减小。
D项,加入0.1molNaHSO4固体,溶液体积变化不大,但n(Na+)变为原来的2倍,故
c(Na+)增大。
5.(填空)对于NH+H2ONH3·
H2O+H+(用箭头表示:
向右“→”、向左“←”、增大“↑”、减小“↓”)
平衡移动
c(H+)
c(NH)
加水稀释
通入少量HCl
加入少量NaOH固体
加入固体NH4Cl
【答案】 →↑↓;
→↓↓;
←↑↑;
→↑↑
6.下图所示三个烧瓶中分别装入含酚酞的0.01mol·
L-1CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。
①加入生石灰 ②室温 ③加入NH4NO3晶体
(1)含酚酞的0.01mol·
L-1CH3COONa溶液显浅红色的原因为_____________
_______________________________________(用离子方程式和必要文字解释)。
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是________(填字母序号)。
A.水解反应为放热反应
B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量
D.NH4NO3溶于水时吸收热量
(3)向0.01mol·
L-1CH3COONa溶液中分别加入NaOH固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为________、________、________。
(填“左”、“右”或“不移动”)
【答案】
(1)CH3COO-存在水解平衡CH3COO-+H2OCH3COOH+
OH-,使溶液显碱性
(2)BD (3)左 左 右
盐类水解反应的应用
教材整理 盐类水解反应的应用
1.作净水剂
铝盐、铁盐等部分盐类水解生成胶体,有较强的吸附性,常用作净水剂。
如明矾水解的离子方程式为Al3++3H2OAl(OH)3(胶体)+3H+。
2.热碱水去油污
加热促进CO的水解,溶液碱性增强,去污能力增强。
纯碱水解的离子方程式为CO+H2OHCO+OH-。
3.盐溶液的配制和保存
配制,保存SnCl2或FeCl3等易水解的盐溶液时,加入少量盐酸的目的是抑制Sn2+或Fe3+水解。
4.制备胶体
向沸水中滴加FeCl3饱和溶液,并加热至沸腾以增大Fe3+的水解程度,从而制备Fe(OH)3胶体。
5.泡沫灭火器原理
Al2(SO4)3溶液与小苏打溶液发生水解相互促进反应,产生CO2气体和Al(OH)3沉淀,将燃烧物质与空气隔离开来。
离子方程式为Al3++3HCO===Al(OH)3↓+3CO2↑。
[探究·
(1)配制FeSO4溶液时为什么要加入少量的稀硫酸和铁屑?
【提示】 抑制Fe2+的水解和氧化。
(2)蒸干FeCl3水溶液并灼烧,得到的固体物质主要是什么?
蒸干并灼烧Al2(SO4)3溶液呢?
【提示】 蒸干FeCl3溶液灼烧得到的固体主要是Fe2O3。
蒸干并灼烧Al2(SO4)3溶液得到Al2(SO4)3固体。
(3)如何除去MgCl2溶液中的少量Fe3+?
【提示】 加入Mg(OH)2等固体,可以促进Fe3+水解,不断转化为Fe(OH)3,从而达到除去Fe3+的目的。
1.判断盐溶液的酸碱性或pH
如:
相同物质的量浓度的下列溶液:
NaCl、NaHSO4、Na2CO3、NaHCO3,pH由大到小的顺序为Na2CO3>
NaCl>
NaHSO4。
2.比较盐溶液中离子浓度的大小
Na2CO3溶液中,各离子浓度的大小顺序为c(Na+)>
c(CO)>
c(OH-)>
c(HCO)>
c(H+)。
3.判断离子共存
Al3+与AlO、CO、HCO、S2-、HS-等因相互促进水解而不共存。
4.化肥的使用
铵态氮肥与草木灰不得混用。
5.判断加热蒸发盐溶液析出固体
(1)
盐[NaCl、Al2(SO4)3]
(2)水解生成挥发性酸的盐(AlCl3)氢氧化物[Al(OH)3]氧化物(Al2O3)
(3)较低温度下受热分解的盐[Ca(HCO3)2]盐的分解产物(CaCO3)
(4)还原性盐(Na2SO3)高价盐(Na2SO4)。
6.判断盐所对应酸的相对强弱
已知物质的量浓度相同的两种盐溶液,NaA和NaB,其溶液的pH前者大于后者,则酸HA和HB的酸性强弱为HB>
HA。
7.盐溶液的配制
配制FeCl3、AlCl3溶液时应加入少量盐酸,配制AgNO3溶液时应加入少量硝酸。
8.用盐作净水剂
利用FeCl3、明矾在水溶液中发生水解产生胶体,能吸附水中悬浮的杂质,起到净水的作用。
9.判断溶液中离子能否大量共存
Al3+、Fe3+与CO、HCO因为能发生水解相互促进的反应,在溶液中不能大量共存。
10.判断盐溶液中的离子种类
如Na3PO4溶液中存在的微粒为Na+、PO、HPO、H2PO、H3PO4、H+、OH-、H2O。
1.在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该固体物质的是( )
A.氯化铝B.碳酸氢钠
C.硫酸铁D.高锰酸钾
【解析】 AlCl3发生水解反应:
AlCl3+3H2OAl(OH)3+3HCl,生成的HCl易挥发而使水解平衡向右移动,致使生成Al(OH)3沉淀,它被灼烧得Al2O3。
NaHCO3、KMnO4受热后分别分解得到Na2CO3、K2MnO4和MnO2,只有Fe2(SO4)3蒸干后得到原物质。
2.将下列固体物质溶于水,再将其溶液加热,蒸发结晶、再灼烧,得到化学组成与原固体物质相同的是( )
①胆矾 ②氯化镁 ③硫酸铝 ④次氯酸钠
A.③B.①④
C.①②③④D.全部
【解析】 ①中CuSO4·
5H2OCuSO4+5H2O↑;
②中MgCl2+2H2OMg(OH)2↓+2HCl↑,Mg(OH)2MgO+H2O;
④中ClO-+H2OHClO+OH-