化学流程2Word格式文档下载.docx
《化学流程2Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《化学流程2Word格式文档下载.docx(9页珍藏版)》请在冰豆网上搜索。
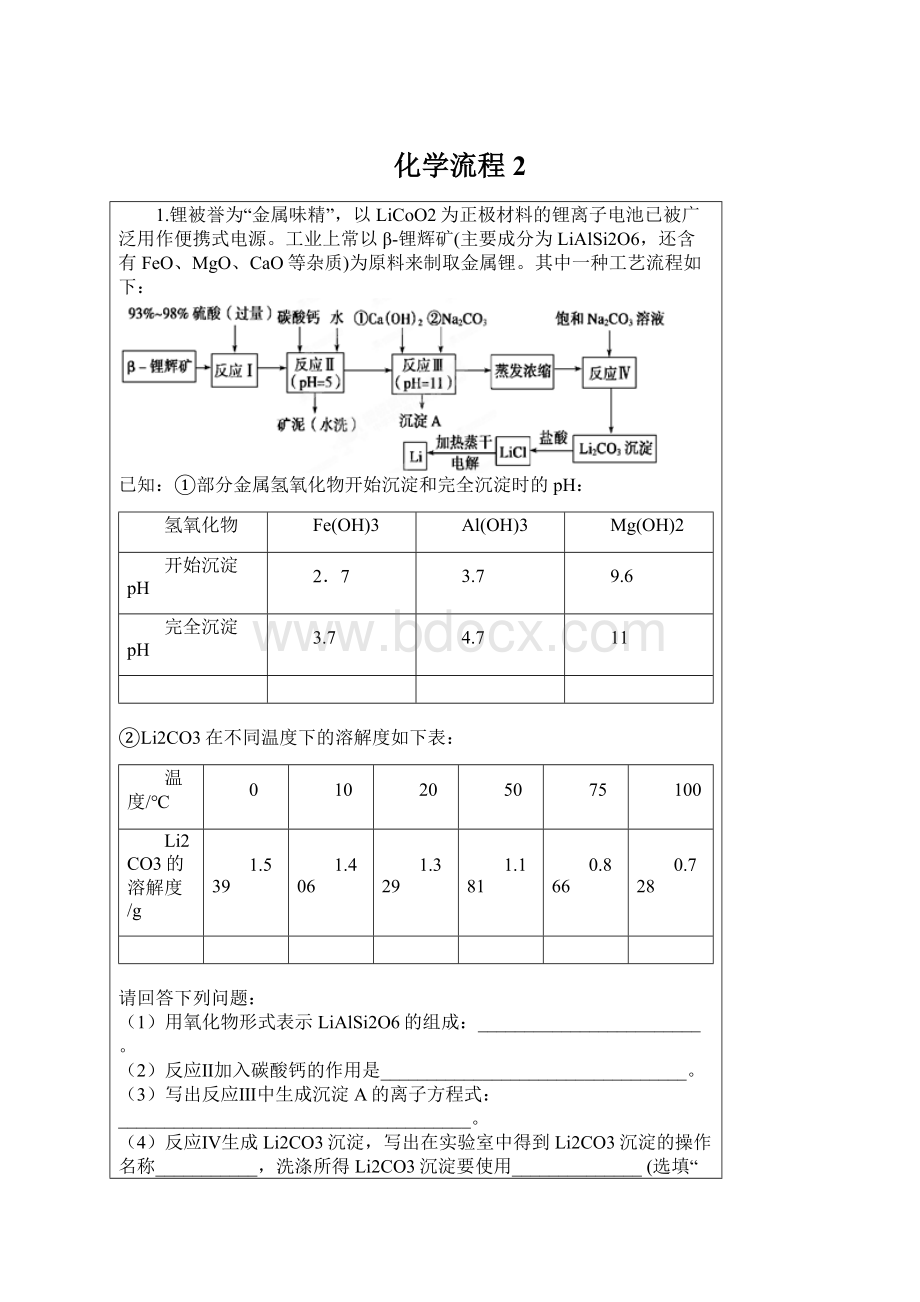
20
50
75
100
Li2CO3的溶解度/g
1.539
1.406
1.329
1.181
0.866
0.728
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:
________________________。
(2)反应Ⅱ加入碳酸钙的作用是_________________________________。
(3)写出反应Ⅲ中生成沉淀A的离子方程式:
______________________________________。
(4)反应Ⅳ生成Li2CO3沉淀,写出在实验室中得到Li2CO3沉淀的操作名称___________,洗涤所得Li2CO3沉淀要使用______________(选填“热水”或“冷水”),你选择的理由是________________。
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是:
__________________________。
题型:
填空
(1)Li2O•Al2O3•4SiO2
(2)除去反应Ⅰ中过量的H2SO4;
控制pH,使Fe3+、Al3+完全沉淀
(3)Mg2++2OH-=Mg(OH)2↓、Ca2++CO32-=CaCO3↓
(4)过滤 热水 Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗
(5)加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2
试题分析:
(1)硅酸盐既可以用盐的形式表示母液可以用氧化物的形式表示。
在用氧化物形式表示时要符合质量守恒定律。
且一般情况下,金属氧化物写在前面,非金属氧化物写在后面。
LiAlSi2O6的氧化物的形式表示为Li2O•Al2O3•4SiO2
。
(2)反应Ⅱ加入碳酸钙是为了除去反应Ⅰ中过量的H2SO4;
控制pH,使Fe3+、Al3+完全沉淀。
(3)根据框图中物质之间的转化关系可知反应Ⅲ中生成沉淀A的离子方程式为Mg2++2OH-=Mg(OH)2↓、Ca2++CO32-=CaCO3↓。
(4)反应Ⅳ中由于Li2CO3溶解度小,所以生成Li2CO3沉淀,在实验室中从溶液中分离得到Li2CO3沉淀的操作是过滤。
因为Li2CO3的溶解度随温度的升高而降低,所以洗涤所得Li2CO3沉淀要使用热水。
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气是因为在加热蒸干LiCl溶液时,LiCl有少量发生水解反应生成LiOH,它受热分解生成Li2O,电解时产生O2。
因此制取的氯气中常含有少量的O2。
在高中阶段化学学科中所涉及的平衡理论主要包括:
化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四种
化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四种,均符合勒夏特列原理,它们在工农业生产中都有广泛的应用.请回答下列问题:
Ⅰ:
(1)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:
2NH3(g)+CO2(g)?
CO(NH2)2(l)+H2O(l)
①已知该反应的平衡常数K195℃<K165℃,则该反应的△H______0(填“>”“=”或“<”).
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
n(NH3)
n(CO2)
=x,如图是氨碳比(x)与CO2平衡转化率(a)的关系.a随着x增大的原因是______.
③取一定量的NH3和CO2放在一个带活塞的密闭真空容器中在一定温度下反应达平衡,若在恒温、恒容下充入气体He,CO(NH2)2(l)的质量______(填“增加”、“减小”或“不变”).
Ⅱ:
(1)某温度下,纯水中c(H+)=2.0×
10-7mol/L,该温度下,0.9mol/L
NaOH溶液与0.1mol/L
HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=______.
(2)向100mL
0.10mol/L
CH3COOH的溶液中加入0.010mol
CH3COONa固体,溶液pH增大,主要原因是(请用学过的平衡理论解释)______.
提问者采纳
(1)①平衡常数K175℃<K165℃,温度越高平衡常数越小,说明平衡逆向进行,逆向是吸热反应,正反应是放热反应,△H<0;
故答案为:
<;
②c(NH3)增大,平衡正向移动,所以CO2的转化率增大;
c(NH3)增大,平衡正向移动,所以CO2的转化率增大;
③达到平衡时,在恒温恒容条件下充入稀有气体,由于各组分的浓度没有变化,则化学平衡不会移动,CO(NH2)2(l)的质量不变;
不变;
Ⅱ
(1)纯水电离生成的c(H+)=c(OH-),Kw=c(H+)×
c(OH-)=4×
10-14,过量的c(OH-)=
0.9V?
0.1V
2V
=0.4mol/L,
由该温度下的Kw可知,c(H+)=
4×
10?
14
0.4
mol/L=10-13mol?
L-1,所以pH=13,
13;
(2)存在CH3COOH?
H++CH3COO-电离平衡,加入CH3COONa固体,c(CH3COO-)增大,则平衡逆向移动,抑制醋酸电离,溶液氢离子浓度减小则pH增大;
醋酸溶液中存在电离平衡:
CH3COOH?
H++CH3COO-电离平衡,当加入CH3COONa固体时,CH3COO-浓度增大,使CH3COOH电离平衡逆向移动,H+浓度降低,故pH增大;
节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染。
某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量。
(1)他们设计如下实验装置,请你参与探究,并回答问题:
①装置A1中发生反应的化学方程式为
;
②装置B用于检验SO2的漂白性,其中所盛试剂为
,装置D用于检验SO2的
性质;
③装置C中反应的离子方程式为
④为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,你认为装置A2的优点是(写二点)
、
(2)他们拟用以下方法测定空气中SO2含量(假设空气中无其他还原性气体)。
①你认为哪个装置可行(填序号)
,使用你所选用的装置测定SO2含量时,还需要测定的物理量是
②你认为哪个装置不可行(填序号)
,说明理由
答案:
(1)①Cu+2H2SO4(浓)CuSO4+2H2O+SO2↑;
②品红溶液;
氧化;
③SO2+I2+2H2O=SO42-+2I-+4H+
④不用加热(或:
节约能源,节约药品);
相对安全;
易于控制反应进行;
反应更充分;
(2)①a;
当KMnO4溶液刚褪色时,测定通入空气的体积V;
②b;
空气中含有的CO2也能与碱石灰反应,造成测量不准确。
解析:
(1)①在装置A1中Cu与浓硫酸共热发生反应:
Cu+2H2SO4(浓)CuSO4+2H2O+SO2↑;
②装置B用于检验SO2的漂白性,SO2能与某些有色物质如品红结合形成无色的物质,因此SO2有漂白性。
在装置B用品红溶液检验。
在装置D中发生反应:
SO2+2H2S=3S↓+H2O。
SO2是氧化剂,表现氧化性,H2S是还原剂,表现还原性。
③在装置C中SO2与碘水发生I2+SO2+2H2O=H2SO4+2HI。
反应的离子方程式为:
I2+SO2+2H2O=SO42-+4H++2I-。
④为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,使用装置A2的优点是不用加热,可以节约能源,相对安全;
反应更充分等;
(2)①将含有SO2的空气通入到KMnO4溶液中,只有SO2能发生反应,所以可以测定空气中SO2含量。
若使用这种方法只需测定当KMnO4溶液刚褪色时,测定通入空气的体积V即可。
对于b,由于空气中含有的CO2也能与碱石灰反应,水蒸气也能被吸收,因此会造成测量不准确。
不能用于测定空气中SO2含量。
考点:
考查SO2的制取、检验、性质、测定及化学方程式、离子方程式的书写的知识。
海水中含有丰富的镁资源.某同学设计了从模拟海水中制备MgO的实验方案:
模拟海水中的
离子浓度(mol/L)
Na+
Mg2+
Ca2+
Cl-
HCO3-
0.439
0.050
0.011
0.560
0.001
注:
溶液中某种离子的浓度小于1.0×
10-5
mol/L,可认为该离子不存在;
实验过程中,假设溶液体积不变.已知:
Ksp(CaCO3)=4.96×
10-9;
Ksp(MgCO3)=6.82×
10-6;
Ksp[Ca(OH)2]=4.68×
Ksp[Mg(OH)2]=5.61×
10-12.下列说法正确的是( )
A.沉淀物X为CaCO3B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2gNaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
A.步骤①,从题给的条件,可知n(NaOH
)=0.001mol,[即n(OH-)=0.001mol].依据离子反应“先中和、后沉淀、再其他”的反应规律,当1L模拟海水中,加入0.001mol
NaOH时,OH-
恰好与HCO3-完全反应:
OH-+HCO3-=CO32-+H2O,生成0.001molCO32-.由于Ksp(CaCO3)<<Ksp(MgCO3),生成的CO32-与水中的Ca2+反应生成CaCO3
沉淀Ca2++CO32-=CaCO3↓.所以沉淀物X为CaCO3,故A正确;
B.由于CO32-只有0.001mol,反应生成CaCO3
所消耗的Ca2+也只有0.001mol,滤液中还剩余c(Ca2+)=0.010
mol•L-1.滤液M中同时存在着Ca2+和Mg2+,故B错误;
C.步骤②,当滤液M中加入NaOH
固体,调至pH=11(即pOH=3)时,此时滤液中c(OH-)=1×
10-3
mol•L-1.则
Q[Ca(OH)2]=c(Ca2+)×
(10-3)2=0.010×
(10-3)2=10-8<Ksp[Ca(OH)2],无Ca(OH)2生成.
Q[Mg(OH)2]=c(Mg2+)×
(10-3)2=0.050×
(10-3)2=5×
10-8>Ksp[Mg(OH)2],有Mg(OH)2沉淀生成.
又由于Ksp[Mg(OH)2]=c(Mg2+)×
(10-3)2=5.6×
10-12,c(Mg2+)=5.6×
10-6<10-5,无剩余,滤液N中不存在Mg2+,
故C错误;
D.步骤②中若改为加入4.2
g
NaOH固体,则n(NaO