元素周期律元素周期表基础知识Word格式.docx
《元素周期律元素周期表基础知识Word格式.docx》由会员分享,可在线阅读,更多相关《元素周期律元素周期表基础知识Word格式.docx(10页珍藏版)》请在冰豆网上搜索。
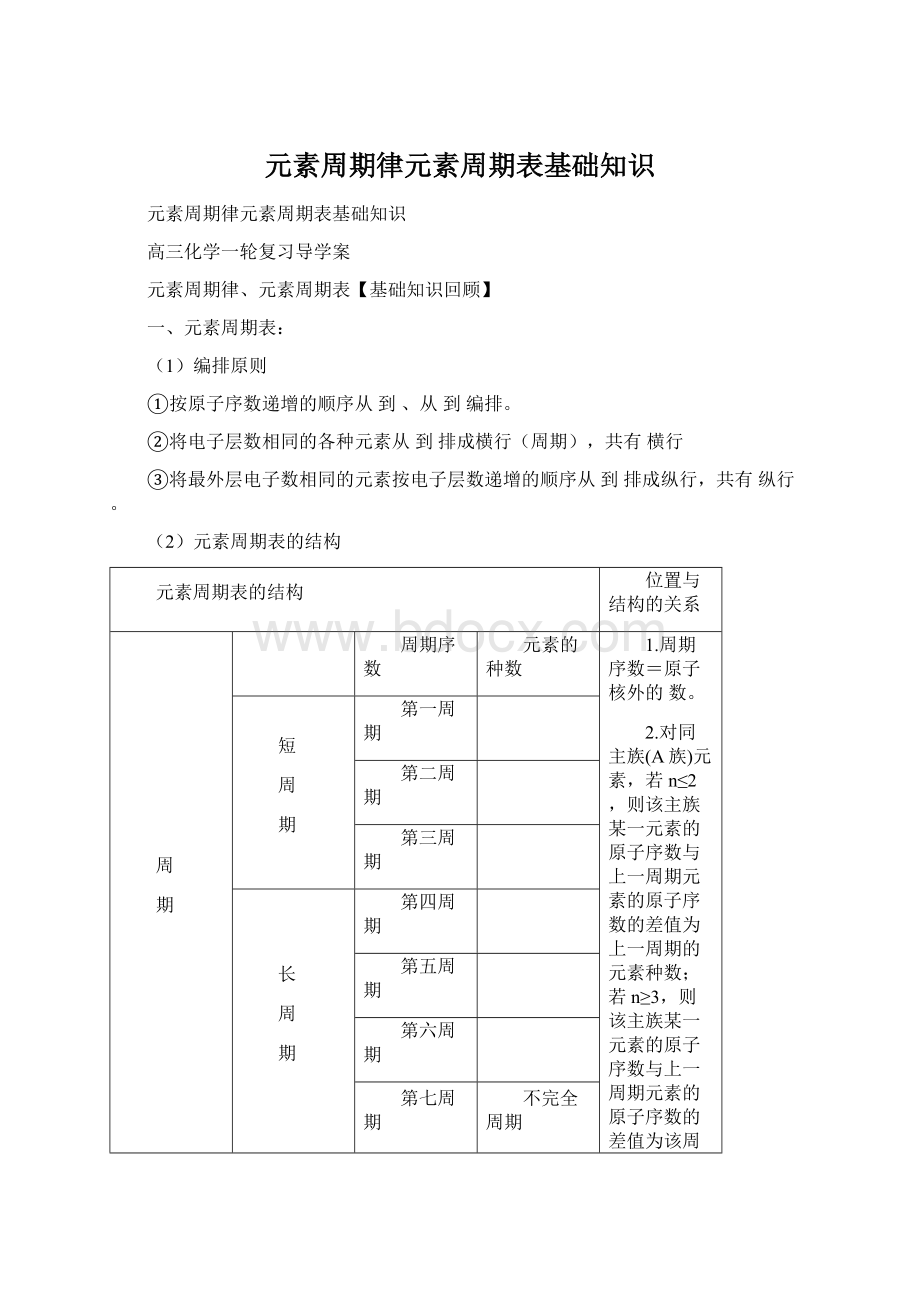
第四周期
第五周期
第六周期
第七周期
不完全周期
族
主
ⅠA族
ⅡA族
ⅢA族
ⅣA族
ⅤA族
ⅥA族
ⅦA族
由元素和元素共同构成的族。
最外层电子数==主族序数==价电子数
零族
最外层电子数均为个(He为2个除外)
副
ⅠB族
ⅡB族
ⅢB族
ⅣB族
ⅤB族
ⅥB族
ⅦB族
只由元素构成的族
最外层电子数一般不等于族序数(第ⅠB族、ⅡB族除外),最外层电子数只有1~2。
第Ⅷ族
有三列元素
归纳:
七主、七副;
一零、一八;
三长、三短、一不全。
(3).相互关系
原子序数=________数=________数=核外________数。
问题思考
1.
(1)最外层电子数是2的元素都是第ⅡA族吗?
(2)同周期第ⅡA和第ⅢA族元素的原子序数一定相差1吗?
2.观察元素周期表,确认每一纵行各代表哪一族,如:
按从左右的顺序排列,第3纵列是______族,第15纵行是____族,第9纵列是____族,ⅤB族在第____纵列,ⅢA族处于____纵列等。
→右的顺序排列,第3纵列是______族,第15纵行是____族,第9纵列是____族,ⅤB族在第____纵列,ⅢA族处于____纵列等。
3.若某离子最外层电子数与次外层电子数相同,则它位于元素周期表的什么位置?
4.电子层结构相同的离子,它们一定位于同一周期吗?
二、元素的性质与原子结构
1、碱金属元素
名称和符号
锂(Li)
钠(Na)
钾(K)
铷(Rb)
铯Cs
结
构
原子序数
3
11
19
37
55
原子结构简图
主要化合价
+1
相同点
不同点
原子半径
离子半径
金属活动性
单质还原性
阳离子氧化性
物性
颜色和状态
___________固体(_________略有金色光泽)
化学性
质
跟氧气反应
2Li+O2=2LiO
4Na+O2=2Na2O
2Na+O2
Na2O2
生成更复杂的氧化物
跟卤素反应
2M+X2=2MX(M、X2表示碱金属、卤素,以下同)
与水反应
2M+2H2O=2MOH+H2
反应剧烈程度:
____________
与酸反应
2M+2H+=2M++H2
与盐溶液反应(如CuSO4溶液)
2M+2H2O+CuSO4=M2SO4+Cu(OH)2
+H2
制法
2MCl
2M+Cl2
【小结归纳】通过上述图表分析可知:
碱金属元素随着原子核电荷数的递增,在_______和_______方面,均表现出一定的_____和______。
但一般之中有特殊。
由此可见同一主族元素性质具有一定的______和________。
2.卤族元素:
元素名称和符号
原子
结构
9
17
35
53
结构示意图
-1
-1,+1,+3,+5,+7
最外层电子数相同,都是个电子
原子核外________不同,依次增大
阴离子半径
非金属活动性
原子氧化能力
阴离子还原能力
物
理
性
气体
色
体易
色
体易
水中溶解性
分解水
依次递减
有机溶剂
分解溶剂
溶解性依次增大
化学反应`
与金属反应
nX2+2M=2MXn与大多数金属反应
反应快慢>>>
与H2反应
X2+H2=2HX反应剧烈程度>>>
与H2O反应
2H2O+2F2=4HF+O2
Cl2+H2O=
(反应较慢)
Br2+H2O=
(反应很慢)
I2+H2O=
HI+HIO
(反应不明显)
与NaOH反应
2F2+4NaOH=4NaF+O2+2H2O
X2+2NaOH=NaX+NaXO+H2O
(X=Cl,Br,I)
置换反应
先和溶液中的水反应
X2+2Y-=2X-+Y2(Y=Cl,Br,I)
置换能力(_____________)
【小结归纳】
a.氟、氯、溴、碘四种非金属元素的非金属性强弱:
b.四种卤素单质的氧化性强弱:
c.卤化氢的稳定性强弱:
三、元素周期律
内容
同周期元素(从左到右)
同主族元素(从上到下)
原子结构
核电荷数
电子层数
最外层电子数
元素性质
最高价氧化物对应水化物的酸碱性
非金属的气态氢化物
稳定性与形成难易
还原性
水溶液酸性
单质的氧化性或还原性
元素的金属性和非金属性
元素周期律、元素周期表基础知识回顾答案
(1)编排原则①左右上下②左右七③上下18
周期:
288181832电子层族:
长周期短周期长周期
(3).质子 核电荷 电子
1.
(1)不是,如0族的He,副族中很多元素最外层电子数也是2。
(2)不一定,第二、三周期中相差1;
第四、五周期中相差11(加副族和第Ⅷ族的10个纵行);
第六周期相差25(因为有镧系)。
2.ⅢB ⅤA Ⅷ 5 13
3.若为阴离子,则它位于第三周期,若为阳离子,则它位于第四周期。
4.不一定,若电性相同,则位于同一周期,若电性相反,则阳离子位于阴离子的下一周期。
二、元素的性质与原子结构
1相同点:
最外层电子数相同,都是1个电子
原子核外电子层数不同,依次增多
依次递增依次递增依次递增依次递增依次递减
银白色铯Li<
Na<
K<
Rb<
Cs
小结归纳:
物理性质化学性质相似性递变性相似性递变性
氟(F)氯(Cl)溴(Br)碘(I)7电子层数
依次递增依次递增依次递减依次递减依次递增
浅黄绿色黄绿色深红棕色液挥发紫黑色固升华
F2、Cl2、Br2、I2F2、Cl2、Br2、I2
HCl+HClOHBr+HBrO
Cl2>Br2>I2
F>Cl>Br>IF2>Cl2>Br2>I2HF>HCl>HBr>HI
三、
递增
增大
相同
增多
逐渐减小(1e-—8e-)
逐渐增大
最高正价由+1→+7
最低负价由-4→-1
最高正价=族序数(O、F除外)非金属负价=-(8-族序数)
碱性减弱酸性增强
碱性增强酸性减弱
增强;
难
易
减弱;
逐渐减弱
逐渐增强
酸性逐渐增强
还原性减弱氧化性增强
还原性增强氧化性减弱
金属性逐渐减弱,非金属性逐渐增强
金属性逐渐增强,非金属性逐渐减弱