人教版学年中考试化学试题I卷模拟Word下载.docx
《人教版学年中考试化学试题I卷模拟Word下载.docx》由会员分享,可在线阅读,更多相关《人教版学年中考试化学试题I卷模拟Word下载.docx(13页珍藏版)》请在冰豆网上搜索。
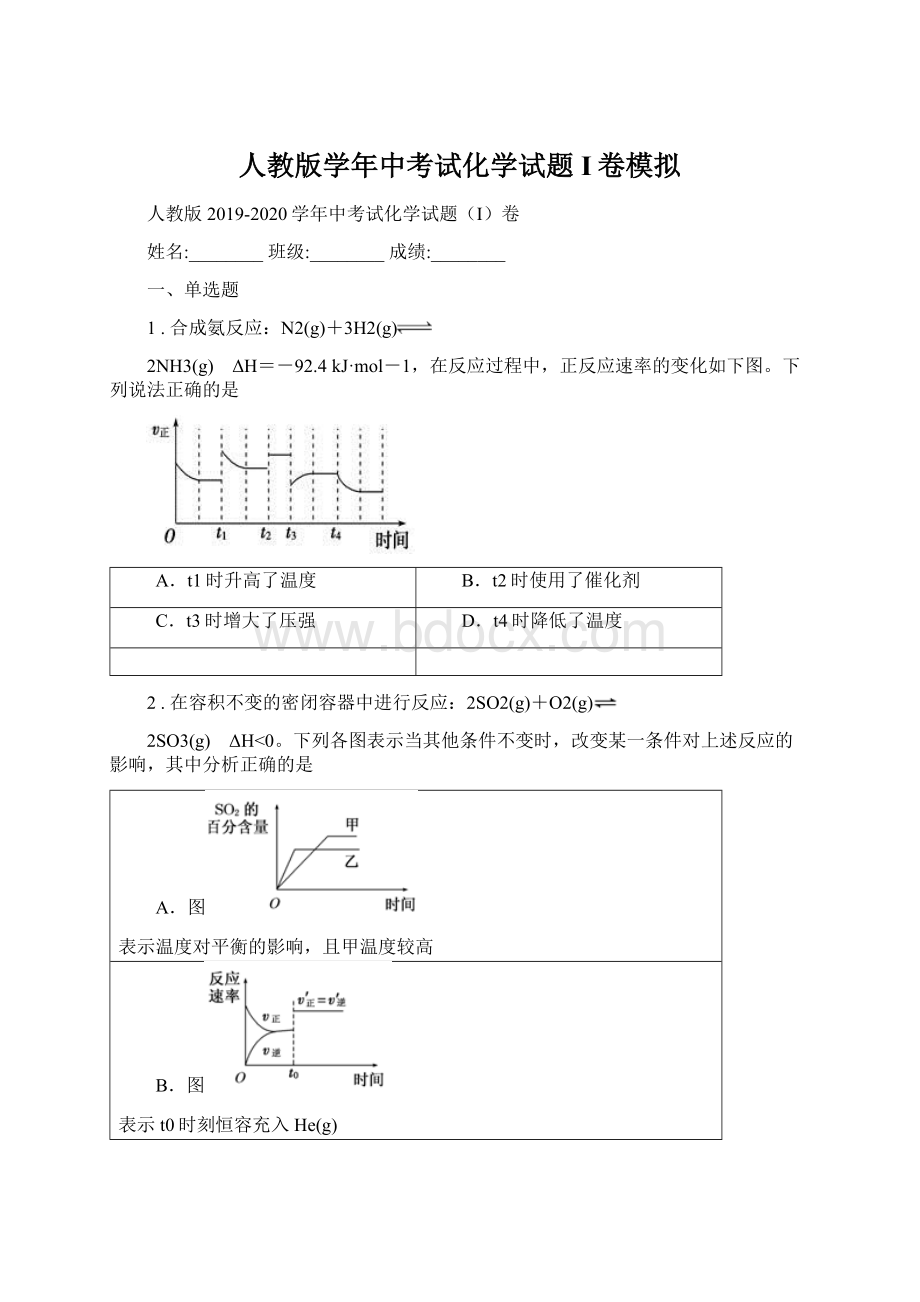
C.图
表示t0时刻增大O2的浓度对反应速率的影响
D.图
中a点v正>
v逆
3.过氧化氢分解反应过程中,能量变化如图所示:
A.催化剂可以改变过氧化氢分解反应的焓变
B.CuCl2或FeCl3可以催化H2O2分解反应
C.催化剂不能改变反应路径
D.H2O2分解是吸热反应
4.下列说法不正确的是()
A.对于有气体参加的可逆反应,加压化学平衡不一定发生移动
B.外界条件的改变引起v正≠v逆,则平衡一定发生移动
C.平衡移动,反应物的浓度一定减小
D.外界条件发生变化,化学平衡不一定移动
5.分类法是一种行之有效、简单易行的科学方法。
某同学用如表所示的形式对所学知识进行分类,其中甲与乙、丙、丁是包含关系。
其中正确的组合是
甲
乙、丙、丁
①
常见干燥剂
浓硫酸、石灰石、碱石灰
②
常见合金
不锈钢、青铜、生铁
③
腐蚀品
浓硫酸、烧碱、硝酸
④
碱性氧化物
一氧化碳、氧化镁、氧化铁
⑤
弱电解质
醋酸、一水合氨、水
A.①②
B.③④⑤
C.②③⑤
D.①④⑤
6.下列叙述,正确的是()
A.酸和盐的混合溶液一定显酸性
B.若S(s)+O2(g)=SO2(g)△H1=-akJ/mol,S(g)+O2(g)=SO2(g)△H2=-bkJ/mol;
则a>b
C.Na与H2O的反应是熵增的放热反应,该反应能自发进行
D.2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
7.往密闭容器中充入一定量的N2和H2,5min时测得NH3的物质的量浓度为0.08mol/L,反应开始的5min内,生成NH3的平均反应速率为
A.0.16mol/(L•min)
B.0.016mol/(L•min)
C.0.32mol/(L•min)
D.0.032mol/(L•min)
8.某学习小组在容积固定为2L的密闭容器内充入1molN2和3molH2合成NH3。
恒温下开始反应,并用压力传感器测定压强如下表所示:
反应时间/min
5
10
15
20
25
30
压强/MPa
16.80
14.78
13.86
13.27
12.85
12.60
下列说法不正确的是
A.不断地将NH3液化并移走,有利于反应正向进行
B.其它条件不变,在30min时,若压缩容器的体积,N2的平衡转化率增大
C.从反应开始到10min时,v(NH3)=0.035mol·
L−1·
min−1
D.在30min时,再加入0.5molN2、1.5molH2和2molNH3,平衡向逆反应方向移动
9.常温时,研究pH
对一定浓度FeSO4的稳定性的影响,根据下图分析不合理的是:
A.pH
小于1时,亚铁几乎无损耗,可能的原因是4Fe2++O2+10H2O
4Fe(OH)3+8H+平衡逆向移动
B.其它条件相同时,FeSO4溶液中加入少量(NH4)2SO4固体,FeSO4的稳定性减弱
C.pH
大于6.5时,亚铁损耗量突变,可能的原因是生成的Fe(OH)2更易被氧化
D.pH
在3.0~5.5
之间,pH
的变化对FeSO4稳定性影响不大
10.在2A+B
3C+4D反应中,表示该反应速率最快的是
A.v(A)=0.5mol/(L·
s)
B.v(B)=0.3mol/(L·
C.v(C)=l8mol/(L·
min)
D.v(D)=1mol/(L·
11.一定条件下,下列不能用勒夏特列原理解释的是
A.H2、I2、HI混合气体加压后颜色变深
B.合成氨时将氨液化分离,可提高原料的利用率
C.FeCl3溶液中加入KSCN溶液的血红色溶液中,加入铁粉后溶液颜色变浅或消失
D.新制氯水中,滴加硝酸银溶液,溶液颜色变浅
12.碳铵(NH4HCO3)在室温下就能自发地分解产生氨气,下列有关说法中正确的是:
A.碳铵分解是因为生成了易挥发的气体,使体系的熵增大
B.碳铵分解是因为外界给予了能量
C.碳铵分解是吸热反应,根据焓判据,不能自发分解
D.碳酸盐都不稳定,都能自发分解
13.下列关于热化学反应的描述中正确的是()
A.HCl和NaOH反应的中和热△H=-57.3kJ·
mol-1,则1mol硫酸与足量氢氧化钡溶液反应放热为114.6kJ
B.H2(g)的燃烧热是285.8kJ·
mol-1,则2H2O
(1)=2H2(g)+O2(g)反应的△H=+571.6kJ·
mol-1
C.反应物的热效应与是否使用催化剂有关
D.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:
N2(g)+3H2(g)⇌2NH3(g)
△H="
-38.6"
kJ·
14.在合成氨的反应中,在5s中N2由6mol/L减至2mol/L。
则NH3的平均反应速率是()
A.2.4mol/(L•s)
B.1.6mol/(L•s)
C.0.8mol/(L•s)
D.0.08mol/(L•s)
15.室温下,2H2(g)+O2(g)
2H2O(l)+566kJ。
下列说法错误的是
A.H2
H+H的过程需要吸热
B.若生成2mol水蒸气,则放出的热量大于566kJ
C.2g氢气完全燃烧生成液态水所释放的能量为283kJ
D.2mol氢气与1mol氧气的能量之和大于2mol液态水的能量
16.向体积为1L的恒温恒容密闭容器中充入2molA,发生反应:
A(g)
B(g)+C(g)。
若A的浓度由2mol/L降至0.8mol/L需20s,则B的浓度由1.2mol/L升至1.8mol/L所需的反应时间为
A.大于10s
B.10s
C.小于10s
D.无法判断
二、综合题
17.碳和氮的化合物在生产生活中广泛存在。
回答下列问题:
(1)①氯胺(NH2Cl)的电子式为_______。
②工业上可利用Cl2和NH3反应制备氯胺,该反应的化学方程式为_______。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0mol·
L-1NaOH溶液充分反应放出的热量如下表所示:
反应序号
CO2的物质的量/mol
NaOH溶液的体积/L
放出的热量/kJ
1
0.5
0.75
x
2
1.0
2.00
y
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为__________。
(3)用焦炭还原NO的反应为:
2NO(g)+C(s)
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min
40
80
120
160
n(NO)(甲容器)/mol
1.50
1.10
0.80
n(NO)(乙容器)/mol
1.45
1.00
n(NO)(丙容器)/mol
0.65
0.53
0.45
①甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=_________。
②该反应的ΔH___0(填“>”或“<”)。
③丙容器达到平衡时,NO的转化率为___________。
(4)常温下,在NH4HCO3溶液中,c(NH4+)________c(HCO3-)(填“>”、“<”或“=”);
反应NH4++HCO3-+H2O
NH3·
H2O+H2CO3的平衡常数K=__________。
(已知常温下,NH3·
H2O的电离平衡常数Kb=2×
10-5,H2CO3的电离平衡常数Ka1=4×
10-7,Ka2=4×
10-11)
三、填空题
18.在某温度下,冰醋酸(纯醋酸)加水稀释过程中,溶液的导电能力如图所示,则:
(1)用湿润的pH试纸测量a处溶液的pH,测量结果______(偏大、偏小或不变)
(2)比较a、b、c三点的下列数据大小或等量关系:
(如a>b>c、c=a>b、a=b=c等)
①醋酸的电离程度:
_________。
②a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:
______。
(3)在稀释过程中,随着c(CH3COOH)的降低,下列始终保持增大趋势的量是______。
A.c(H+)
B.H+个数
C.CH3COOH个数
D.
19.下表中的数据是破坏1mol气态物质中的共价键所吸收的能量(键能):
物质
Cl2
Br2
I2
HCl
HBr
HI
H2
键能(kJ·
mol−1)
243
193
152
432
366
298
436
根据表中数据回答:
(1)上述物质中最稳定的氢化物是___________。
(2)反应X2(g)+H2(g)=2HX(g)(X代表Cl、Br、I)是___________(填“吸热”或“放热”)反应。
(3)相同条件下,X2(g)与H2反应,当消耗等物质的量的H2时,放出或吸收的热量最多的是____________。
20.
(1)已知拆开1molH—H键、1molN—H键、1molN≡N键需要的能量分别是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为___。
(2)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,回答下列问题:
①该反应的ΔH___0(填“大于”“小于”或“等于”);
②反应物的总键能为__;
③写出该反应的热化学方程式____。
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
①2O2(g)+N2(g)=N2O4(l)
ΔH1②N2(g)+2H2(g)=N2H4(l)
ΔH2
③O2(g)+2H2(g)=2H2O(g)
ΔH3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)
ΔH4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4=___,联氨和N2O4可作为火箭推进剂的主要原因为____。
21.CO2与NH3反应可合成化肥尿素。
已知:
①2NH3(g)+CO2(g)