届四川省乐山市普通高中高三上学期第一次高考诊断性考试理综化学试题解析版.docx
《届四川省乐山市普通高中高三上学期第一次高考诊断性考试理综化学试题解析版.docx》由会员分享,可在线阅读,更多相关《届四川省乐山市普通高中高三上学期第一次高考诊断性考试理综化学试题解析版.docx(19页珍藏版)》请在冰豆网上搜索。
届四川省乐山市普通高中高三上学期第一次高考诊断性考试理综化学试题解析版
绝密★启用前
四川省乐山市普通高中
2020届高三年级上学期第一次高考诊断性考试
理综-化学试题
(解析版)
一、选择题(本题包括13小题,每小题6分,共78分.在每小题给出四个选项中,只有一项是符合题目要求的)
1.(6分)化学与社会、生活密切相关。
下列现象或事实的解释不正确的是( )
选项
现象或事实
化学解释
A
Fe3O4用于人民币票面文字等处的油墨
Fe3O4是一种红棕色物质
B
祖国七十华诞焰火五彩缤纷
金属元素的焰色反应
C
现代旧房拆除定向爆破用铝热剂
铝热反应放热使建筑物的钢筋熔化
D
金属焊接前用NH4Cl溶液处理焊接处
NH4Cl溶液呈弱酸性
A.AB.BC.CD.D
【分析】A、Fe3O4是一种黑色物质;
B、金属元素燃烧显示不同的火焰颜色;
C、金属Al能与某些金属氧化物反应,并且放出大量热;
D、NH4Cl是强酸弱碱盐,水解使溶液呈酸性,氢离子能与氧化铁反应。
【解答】解:
A、Fe3O4是磁性氧化物,具有磁性的物质,俗称磁性氧化铁,是黑色物质,不是俗称铁红的氧化铁,故A错误;
B、焰火的五彩缤纷是某些金属元素燃烧显示不同的火焰颜色的展现,故B正确;
C、金属Al能与某些金属氧化物发生铝热反应,并且放出大量热,可使钢铁熔化,所以旧房拆除定向爆破可用铝热剂实现,故C正确;
D、NH4Cl是强酸弱碱盐,水解使溶液呈酸性,铁锈的主要成分是氧化铁,氧化铁能与酸性溶液反应,所以金属焊接前可用NH4Cl溶液处理焊接处铁锈,故D正确;
故选:
A。
【点评】本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应、性质与用途为解答的关键,侧重分析与应用能力的考查,注意生活与化学的联系,题目难度不大。
2.(6分)下列离子方程式或化学方程式正确的是( )
A.向Na2S2O3溶液中加入稀HNO3:
S2O32﹣+2H+═SO2↑+S↓+H2O
B.向Al2(SO4)3溶液中滴加Na2CO3溶液:
2Al3++3CO32﹣═Al2(CO3)3↓
C.“侯德榜制碱法”首先需制备碳酸氢钠:
NaCl(饱和)+NH3+CO2+H2O═NaHCO3↓+NH4Cl
D.CuSO4溶液中加入过量NaHS溶液:
Cu2++HS﹣═CuS↓+H+
【分析】A.二氧化硫能被硝酸氧化成硫酸根离子;
B.发生相互促进水解反应生成氢氧化铝和二氧化碳;
C.向氨的饱和氯化钠溶液中铜二氧化碳生成碳酸氢钠和氯化铵;
D.反应生成CuS、硫化氢和硫酸钠。
【解答】解:
A.硝酸具有氧化性,二氧化硫能被硝酸氧化成硫酸根离子,不会有二氧化硫生成,故A错误;
B.向Al2(SO4)3溶液中滴加少量Na2CO3溶液的离子反应为2Al3++3CO32﹣+3H2O=2Al(OH)3↓+3CO2↑,故B错误;
C.向氨的饱和氯化钠溶液中铜二氧化碳生成碳酸氢钠和氯化铵,故化学方程式为NaCl(饱和)+NH3+CO2+H2O═NaHCO3↓+NH4Cl,故C正确;
D.往硫酸铜溶液中加入过量的NaHS溶液的离子反应为Cu2++2HS﹣=CuS↓+H2S↑,故D错误。
故选:
C。
【点评】本题考查了离子方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。
3.(6分)已知气态烃A的产量是一个国家石油化工水平的重要标志,有机物A~E能发生如图所示一系列变化,则下列说法正确的是( )
A.A→B的反应类型为加成反应
B.常温下有机物C是一种有刺激性气味的气体
C.分子式为C4H8O2的酯有3种
D.lmolD与足量碳酸氢钠反应生成气体的体积为22.4L
【分析】气态烃A的产量是一个国家石油化工水平的重要标志,则A为CH2=CH2,B能连续被催化氧化且BD能发生酯化反应生成E,根据E分子式知,B为CH3CH2OH、C为CH3CHO、D为CH3COOH、E为CH3COOCH2CH3,
A.A生成B的反应为乙烯和水生成乙醇的反应;
B.C为乙醛,常温下为液体;
C.分子式为C4H8O2的酯可能是甲酸正丙酯、甲酸异丙酯、乙酸乙酯、丙酸甲酯;
D.温度和压强未知导致气体摩尔体积未知。
【解答】解:
气态烃A的产量是一个国家石油化工水平的重要标志,则A为CH2=CH2,B能连续被催化氧化且BD能发生酯化反应生成E,根据E分子式知,B为CH3CH2OH、C为CH3CHO、D为CH3COOH、E为CH3COOCH2CH3,
A.A生成B的反应为乙烯和水生成乙醇的反应,该反应为加成反应,故A正确;
B.C为乙醛,常温下为液体,且乙醛具有刺激性气味,故B错误;
C.分子式为C4H8O2的酯可能是甲酸正丙酯、甲酸异丙酯、乙酸乙酯、丙酸甲酯,所以符合条件的酯有4种,故C错误;
D.温度和压强未知导致气体摩尔体积未知,则无法计算生成气体体积,故D错误;
故选:
A。
【点评】本题考查有机物推断,侧重考查分析推断及知识综合运用能力,明确烯烃、醇、醛、羧酸、酯的官能团及其性质关系、物质之间的转化关系是解本题关键,C为解答易错点,易漏掉甲酸异丙酯而导致错误判断。
4.(6分)短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体,下列有关说法不正确的是( )
A.原子半径:
M<Z<Y
B.可用XM2洗涤熔化过M的试管
C.Y的单质起火燃烧时可用泡沫灭火剂灭火
D.最高价氧化物水化物的酸性:
M>Z
【分析】短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种单质是高硬度的宝石,则X为C;Y2+的电子层结构与氖相同,则Y为Mg;室温下M的单质为淡黄色固体,则M为S;而Z的原子序数大于Mg而小于S,且质子数为偶数,则Z为Si,以此解答该题。
【解答】解:
由以上分析可知X为C,Y为Mg,Z为Si,M为S,
A.同一周期从左向右原子半径逐渐减小,则原子半径:
M<Z<Y,故A正确;
B.硫单质易溶于CS2,可用CS2洗涤熔化过S的试管,故B正确;
C.Mg能够在二氧化碳中燃烧,Mg单质起火时不能用泡沫灭火剂灭火,故C错误;
D.非金属性:
S>Si,则最高价氧化物对应水化物的酸性:
M>Z,故D正确;
故选:
C。
【点评】本题考查了原子结构与元素周期律的关系,题目难度中等,正确推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及逻辑推理能力。
5.(6分)下列实验对应的实验现象和结论或解释都正确的是( )
选项
实验操作
实验现象
结论或解释
A.
KI淀粉溶液中通入少Cl2
溶液变蓝
Cl2能与淀粉发生显色反应
B.
向稀溴水中加入苯,充分振荡、静置
水层几乎无色
苯与溴水发生了取代反应
C.
向蔗糖溶液中加入几滴稀硫酸,水浴加热,然后加入银氨溶液,加热
无银镜出现
不能判断蔗糖是否水解
D.
向FeCl3和AlCl3混合溶液中滴加过量NaOH溶液
出现红褐色沉淀
Ksp[Fe(OH)3]<Ksp[Al(OH)3]
A.AB.BC.CD.D
【分析】A.氯气可氧化KI生成碘,淀粉遇碘变蓝;
B.苯与溴水发生萃取;
C.蔗糖水解后,检验葡萄糖在碱性溶液中;
D.滴加过量NaOH溶液,氢氧化铝与NaOH反应。
【解答】解:
A.氯气可氧化KI生成碘,淀粉遇碘变蓝,结论不合理,故A错误;
B.苯与溴水发生萃取,为物理变化,故B错误;
C.蔗糖水解后,检验葡萄糖在碱性溶液中,没有子碱性条件下检验,无银镜生成,则不能判断蔗糖是否水解,故C正确;
D.滴加过量NaOH溶液,氢氧化铝与NaOH反应,与氢氧化铝的两性有关,且FeCl3和AlCl3混合溶液浓度未知、不发生沉淀转化,不能比较Ksp大小,故D错误;
故选:
C。
【点评】本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应与现象、沉淀生成、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大。
6.(6分)25℃时,向10mL0.lmol•L﹣1H2C2O4溶液中滴加等浓度的NaOH溶液,溶液的pH与NaOH溶液的体积关系如图所示,下列叙述正确的是( )
A.A点溶液中,c(H+)=c(OH﹣)+c(HC2O4﹣)+2c(C2O42﹣)
B.HC2O4﹣在溶液中水解程度大于电离程度
C.C点溶液中含有大量NaHC2O4和H2C2O4
D.D点溶液中,c(Na+)>c(C2O42﹣)>c(HC2O4﹣)>c(OH﹣)>c(H+)
【分析】A.A点为10mL0.lmol•L﹣1H2C2O4溶液,根据电荷守恒分析;
B.B点加入10mL等浓度的NaOH溶液,反应后溶质为NaHC2O4,此时溶液呈酸性;
C.B点溶质为NaHC2O4,D点溶质为Na2C2O4,C点介于二者之间,据此判断C点溶质;
D.D点,H2C2O4溶液与NaOH恰好反应生成Na2C2O4,溶液显碱性,据此结合电荷守恒分析。
【解答】解:
A.A点为0.lmol•L﹣1H2C2O4溶液,根据电荷守恒可知:
c(H+)=c(OH﹣)+c(HC2O4﹣)+2c(C2O42﹣),故A正确;
B.B点溶质为NaHC2O4,此时溶液的pH<7,说明HC2O4﹣在溶液中水解程度小于其电离程度,故B错误;
C.C点溶液呈中性,加入的NaOH溶液介于10mL~20mL之间,则溶质为NaHC2O4和Na2C2O4,故C错误;
D.D点,H2C2O4溶液与NaOH恰好反应生成Na2C2O4,Na2C2O4水解溶液显碱性,以第一步水解为主,且氢氧根离子还来自水的电离,则c(OH﹣)>c(HC2O4﹣),正确的离子浓度大小为;c(Na+)>c(C2O42﹣)>c(OH﹣)>c(HC2O4﹣)>c(H+),故D错误;
故选:
A。
【点评】本题考查酸碱混合的定性判断、离子浓度大小比较,题目难度中等,明确图示曲线变化的意义为解答关键,注意掌握溶液酸碱性与溶液pH的关系及电荷守恒,试题侧重考查学生的分析能力及灵活运用能力。
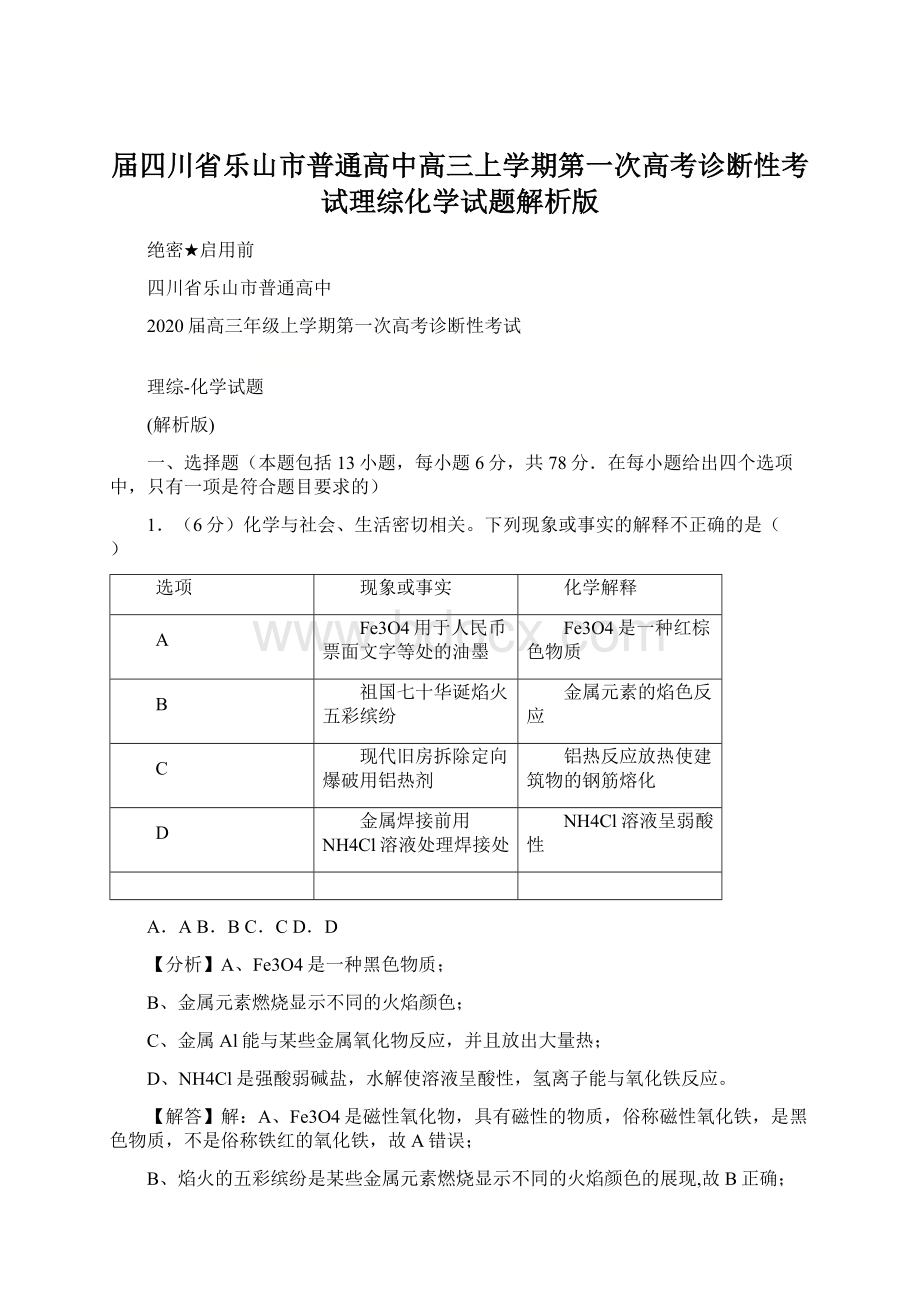
7.(6分)电渗析法淡化海水装置示意图如图所示,电解槽中阴离子交换膜和阳离子交换膜相间排列,将电解槽分隔成多个独立的间隔室,海水充满在各个间隔室中。
通电后,一个间隔室的海水被淡化,而其相邻间隔室的海水被浓缩,从而实现了淡水和浓缩海水分离。
下列说法正确的是( )
A.离子交换膜a为阴离子交换膜
B.通电时,电极2附近溶液的pH增大
C.淡化过程中,得到的浓缩海水没有任何使用价值
D.各间隔室的排出液中,②④⑥为淡水
【分析】图中分析可知,电极1为电解池阳极,氯离子放电生成氯气,电极反应为:
2Cl﹣﹣2e﹣=Cl2↑,电极2为阴极,溶液中氢离子得到电子生成氢气,电极反应2H++2e﹣=H2↑,实线对应的半透膜是阳离子半透膜,虚线是阴离子半透膜,据此分析判断选项。
【解答】解:
A.分析可知b为阴离子交换膜,故A错误;
B.通电时,阳极电极反应:
2Cl﹣﹣2e﹣=Cl2↑,阴极电极反应,2H++2e﹣=H2↑,氢离子浓度减少,氢氧根离子浓度增加,故电极2附近溶液的pH增大,故B正确;
C.淡化过程中,得到的浓缩海水可以提取氯化钠、镁、溴等,有使用价值,故C错误;
D.实线对应的半透膜是阳离子半透膜,虚线是阴离子半透膜,结合阴阳离子移向可知,各间隔室的排出液中,①③⑤⑦为淡水,故D错误;
故选:
B。
【点评】本题考查了海水淡化原理,明确图片内涵是解本题关键,阴阳离子在电极上放电,导致排出的水为淡水,从