化学竞赛晶体结构综合例题Word文件下载.doc
《化学竞赛晶体结构综合例题Word文件下载.doc》由会员分享,可在线阅读,更多相关《化学竞赛晶体结构综合例题Word文件下载.doc(47页珍藏版)》请在冰豆网上搜索。
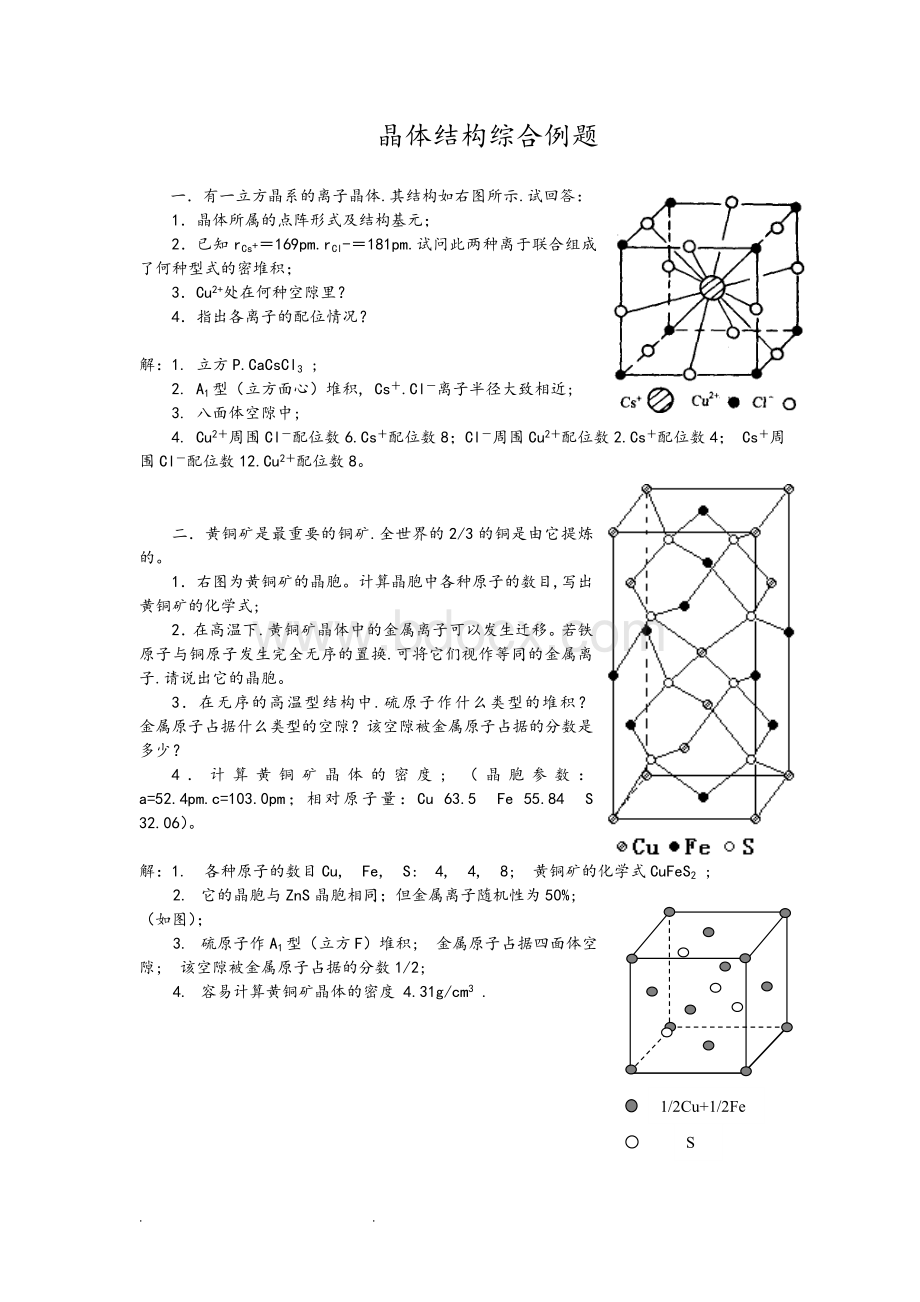
计算晶胞中各种原子的数目,写出黄铜矿的化学式;
2.在高温下.黄铜矿晶体中的金属离子可以发生迁移。
若铁原子与铜原子发生完全无序的置换.可将它们视作等同的金属离子.请说出它的晶胞。
3.在无序的高温型结构中.硫原子作什么类型的堆积?
金属原子占据什么类型的空隙?
该空隙被金属原子占据的分数是多少?
4.计算黄铜矿晶体的密度;
(晶胞参数:
a=52.4pm.c=103.0pm;
相对原子量:
Cu63.5Fe55.84S32.06)。
1.各种原子的数目Cu,Fe,S:
4,4,8;
黄铜矿的化学式CuFeS2;
2.它的晶胞与ZnS晶胞相同;
但金属离子随机性为50%;
1/2Cu+1/2Fe
S
(如图);
3.硫原子作A1型(立方F)堆积;
金属原子占据四面体空
隙;
该空隙被金属原子占据的分数1/2;
4.容易计算黄铜矿晶体的密度4.31g/cm3.
三.冰晶石(Na3AlF6)用作电解法炼铝的助熔剂。
冰晶石晶胞是以大阴离子(AlF63-)构成的面心立方晶格.Na+可看作是填充在晶格的空隙中.已知冰晶石的密度为2.95g/cm3.Al—F键长181pm.相对原子质量:
Na23.0;
Al27.0;
F19.0。
1.指出AlF63-配离子中心离子的杂化轨道类型、配离子空间构型和所属分子点群。
2.指出Na3AlF6的点阵形式;
阴离子作何种形式的堆积.阳离子占据何种空隙及占有率;
写出它们的分数坐标。
3.计算冰晶石晶体的晶胞参数。
4.计算Na+的半径。
1.AlF63-配离子中心离子的杂化轨道类型为sp3d2杂化;
配离子空间构型为正八面体;
所属分子点群为Oh。
2.Na3AlF6的点阵形式为立方F;
阴离子作A1型堆积.阳离子占据100%八面体空及
100%四面体空隙;
它们的分数坐标为
AlF63-:
(0.0.0)(1/2.1/2.0)(1/2.0.1/2)(0.1/2.1/2)(1分);
Na+:
(1/4.1/4.1/4)(1/4.1/4.3/4)(1/4.3/4.1/4)(1/4.3/4.3/4)
(3/4.1/4.1/4)(3/4.1/4.3/4)(3/4.3/4.1/4)(3/4.3/4.3/4)
(1/2.1/2.1/2)(0.0.1/2)(0.1/2.0)(1/2.0.0).
3.晶胞内含4个[Na3AlF6]单元.Na3AIF6摩尔质量为210g/mol。
设晶胞边长为a.则a=780pm
4.R-=181pm,R+按四面体空隙计算;
按八面体空隙计算为209pm(舍去);
真实值为157pm.
四.CaCux合金可看作由下图所示的a、b两种原子层交替堆积排列而成:
a是由Cu和Ca共同组成的层.层中Cu-Cu之间由实线相连;
b是完全由Cu原子组成的层.Cu-Cu之间也由实线相连。
图中由虚线勾出的六角形.表示由这两种层平行堆积时垂直于层的相对位置。
c是由a和b两种原子层交替堆积成CaCux的晶体结构图。
在这结构中:
同一层的Ca-Cu为294pm;
相邻两层的Ca-Cu为327pm。
1.确定该合金的化学式;
2.Ca有几个Cu原子配位(Ca周围的Cu原子数.不一定要等距最近);
Cu的配位情况如何.列式计算Cu的平均配位数;
3.该晶体属何种晶系;
写出各原子的分数坐标;
计算晶胞参数。
4.计算该合金的密度(Ca40.1Cu63.5)
5.计算Ca、Cu原子半径。
abc
○Ca·
Cu
1.在a图上划出一个六方格子.则容易看出.该合金的化学式为CaCu5;
2.在a图上容易看出.Ca周围有6个Cu原子.结合c图看出.Ca有18个Cu原子配位;
Cu的配位情况:
在a图上容易看出.3配位6个;
在c图侧面上看出.4配位9个;
Cu的平均配位数为18/5=3.6;
3.该晶体属六方晶系;
各原子的分数坐标为(0.0.0)(1/3.2/3.0)(2/3.1/3.0)
(1/2.0.1/2)(0.1/2.0)(1/2.1/2.1/2)
晶胞参数为,a=509pm;
(c/2)2+(a/2)2=3272;
c=410pm;
4.合金的密度;
5.Ca、Cu原子半径:
;
.
五(2004年全国高中学生化学竞赛决赛6分)氢是重要而洁净的能源。
要利用氢气作能源.必须解决好安全有效地储存氢气问题。
化学家研究出利用合金储存氢气.LaNi5是一种储氢材料。
LaNi5的晶体结构已经测定.属六方晶系.晶胞参数a=511pm,c=397pm,晶体结构如图2所示。
⒈从LaNi5晶体结构图中勾画出一个LaNi5晶胞。
⒉每个晶胞中含有多少个La原子和Ni原子?
⒊LaNi5晶胞中含有3个八面体空隙和6个四面体空隙.若每个空隙填人1个H原子.计算该储氢材料吸氢后氢的密度.该密度是标准状态下氢气密度(8.987×
10-5g·
m-3)的多少倍?
(氢的相对原子质量为1.008;
光速c为2.998×
108m·
s-1;
忽略吸氢前后晶胞的体积变化)。
⒈晶胞结构见图4。
⒉晶胞中含有 1 个La原子
和 5 个Ni原子
⒊计算过程:
六方晶胞体积:
V=a2csin120°
=(5.11×
10-8)2×
3.97×
10-8×
31/2/2
=89.7×
10-24cm3
氢气密度
是氢气密度的1.87×
103倍。
六.钼是我国丰产元素.探明储量居世界之首。
钼有广泛用途.例如白炽灯里支撑钨丝的就是钼丝;
钼钢在高温下仍有高强度.用以制作火箭发动机、核反应堆等。
钼是固氨酶活性中心元素.施钼肥可明显提高豆种植物产量.等等。
1.钼的元素符号是42.写出它的核外电子排布式.并指出它在元素周期表中的位置。
2.钼金属的晶格类型为体心立方晶格.原子半径为136pm.相对原子质量为95.94。
试计算该晶体钼的密度和空间利用率。
3.钼有一种含氧酸根[MoxOy]z-(如右图所示).式中x、y、z都是正整数;
Mo的氧化态为+6.O呈-2。
可按下面的步骤来理解该含氧酸根的结构:
A.所有Mo原子的配位数都是6.形成[MoO6]6-.呈正八面体.称为“小八面体”(图A);
B.6个“小八面体”共棱连接可构成一个“超八面体”(图B).化学式为[Mo6O19]2-;
C.2个”超八面体”共用2个“小八面体”可构成一个“孪超八面体”(图C);
.化学式为[Mo10O28]4+;
D.从一个“孪超八面体”里取走3个“小八面体”.得到的“缺角孪超八面体”(图D)便是本题的目标物[MoxOy]z-(图D中用虚线表示的小八面体是被取走的)。
ABCD
求出目标物[MoxOy]z-的化学式.说明以上中间物化学式的来由。
4.如图所示为八钼酸的离子结构图.请写出它的化学式;
5.钼能形成六核簇合物.如一种含卤离子[Mo6Cl8]4+.6个Mo原子形成八面体骨架结构.氯原子以三桥基与与Mo原子相连。
则该离子中8个Cl离子的空间构型是什么?
1.钼的元素符号是42.它的核外电子排布式为[Kr]4d55s1;
它在元素周期表中的位置为第五周期ⅥB族;
2.晶体钼的密度为10.3g/cm3;
空间利用率为68.0%;
3.(A).显然“小八面体”(图A)化学式为[MoO6]6-;
(B).“超八面体”(图B).化学式为[Mo6O(6+6*4/2+6/6=19)]2--;
(C).“孪超八面体”(图C).化学式为[Mo(6+4=10)O(19+2*3+3=28)]4+-;
(D).目标物(图D).化学式为[Mo(10-3=7)O(28-4=24)]6--;
(参考如下投影图A,B,C,D)
4.八钼酸的化学式为[Mo(10-2=8)O(28-2=26)]4-(参考投影图E);
5.钼的一种含卤离子[Mo6Cl8]4+的