基态原子的电子组态.docx
《基态原子的电子组态.docx》由会员分享,可在线阅读,更多相关《基态原子的电子组态.docx(13页珍藏版)》请在冰豆网上搜索。
基态原子的电子组态
CHAPTER1原子構造
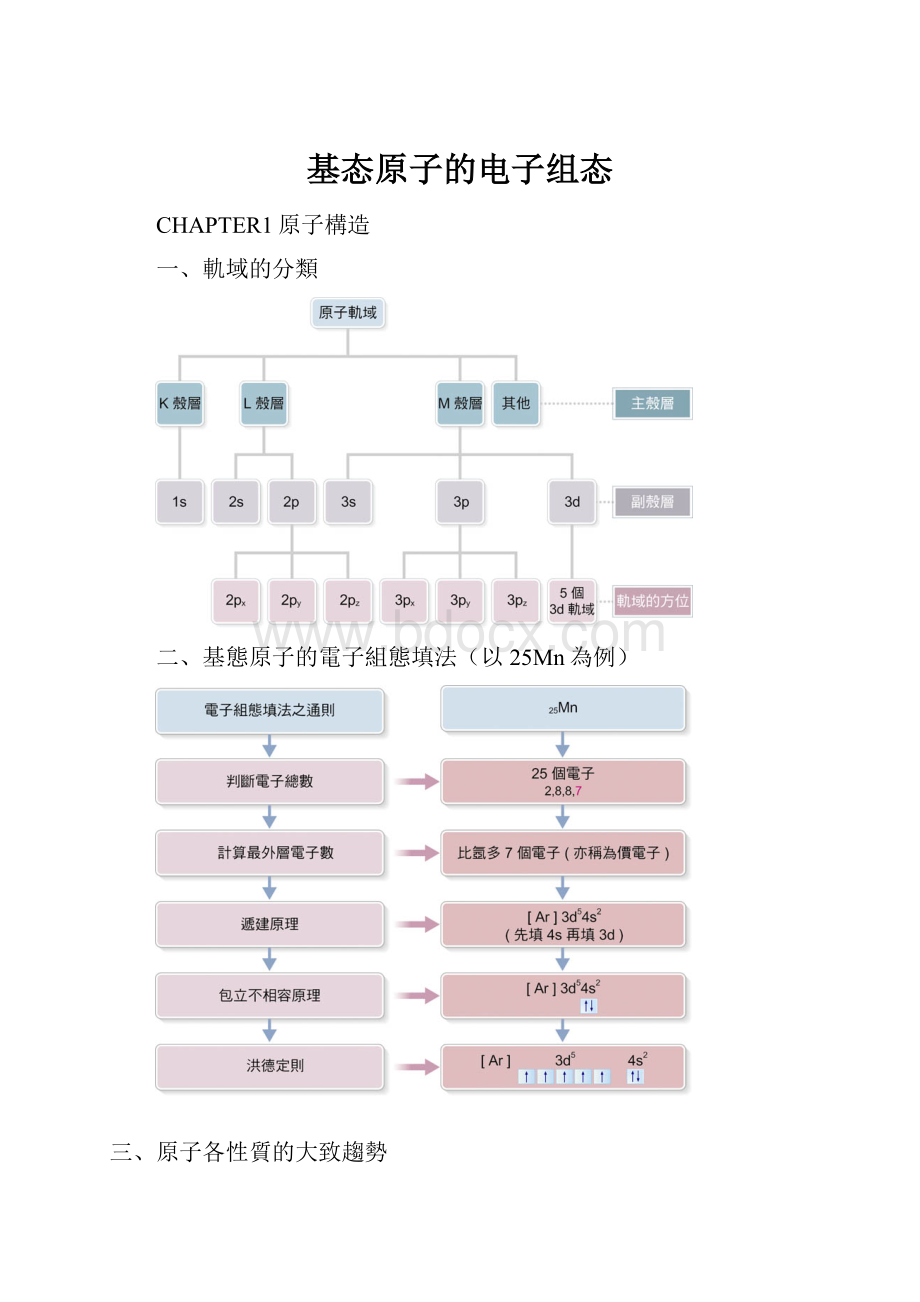
一、軌域的分類
二、基態原子的電子組態填法(以25Mn為例)
三、原子各性質的大致趨勢
1-1氫原子光譜
1.不同波長的電磁波所呈現出來的能量各不相同,波長愈短、頻率愈高的電磁波其能量愈大。
2.白色光透過三稜鏡所產生的光譜,其頻率由較低的紅光到較高的紫光全部都存在,由於頻率是連續的,故稱為連續光譜。
3.焰色試驗法所得到的光譜,只含有特定波長而且不連續,因此稱為線光譜,亦稱為不連續光譜。
4.物理學家芮得柏發展出芮得柏公式,可求出氫原子光譜中任何一條譜線的波長:
=R×(
-
)
其中R為芮得柏常數,相當於1.097×10-2nm-1,ni、nf為整數,而ni大於nf。
1-2波耳氫原子模型與氫原子能階
5.波耳的氫原子模型認為電子只能在某些固定的距離圍繞原子核運行,此時電子將不輻射能量而呈穩定態。
氫原子的電子在n=1時為最安定態,稱為基態。
1-3原子軌域
6.電子在核外的運動情形並無固定的軌道,但其在原子核四周出現的機率已能被推算出來。
若將出現機率總和90%以上的各點勾畫出來,稱為軌域。
1-4電子組態
7.依主量子數(n)的不同,軌域區分為許多主殼層,每一主殼層內有n2個不同的軌域。
8.依角動量量子數的不同,軌域依據形狀可區分出s、p、d、f等不同的副殼層,其中s軌域的形狀呈球形對稱,p軌域為啞鈴形,d和f軌域的形狀則較複雜。
9.除了s軌域以外,主殼層中相同形狀的軌域,即其角量子數亦相同者,會因為在空間方位的分布不同(即磁量子數不同),形成能量相同而空間排列不同的軌域,例如p軌域有px、py及pz三種空間分布不同的軌域。
10.除少數例外,多電子原子中的電子可依據下列規則排列,以得到基態的電子組態:
(1)遞建原理:
從最低能量的軌域開始填起。
(2)包立不相容原理:
任一軌域最多只能填入兩個電子,且自旋方向必須相反。
(3)洪德定則:
當兩個以上的軌域能量相等時,在同一軌域填入第二個電子之前,必須先將所有能量相等的軌域中各填入一個自旋方向相同的電子。
11.各元素的電子組態和其在週期表中的位置密切關聯。
同一族元素的價電子填法均相同,過渡元素的價電子會填在d軌域,內過渡元素則填入f軌域。
1-5元素性質的週期性
12.同一族元素的原子半徑由上而下遞增,即隨原子序的增加而增大,而同一週期中,主族元素的原子半徑由左至右遞減,即隨原子序的增加而減少。
13.由基態氣相原子或陽離子中移去一個電子所需的最小能量稱為游離能。
同族元素原子的游離能隨原子序增加而減小,同週期的第一游離能則有遞增的趨勢,唯部分元素因電子組態的緣故出現偏高的現象,使得原子序與第一游離能的關係圖呈現鋸齒狀。
14.將帶一個負電荷的氣態陰離子移除一個電子時,所改變的能量稱為電子親和力。
對大部分的陰離子(X-)而言,當一個電子被移出時,通常會吸收能量,但有少數的電子親和力為負值,例如氦、鈹、氖、鎂等。
15.電負度是代表原子在化學鍵中吸引共用電子對的能力。
氟的電負度最大,定為4.0,其他元素的電負度為與氟的比較值。
典型元素除鈍氣外,同一族元素的電負度由上而下遞減,同一週期的元素則隨原子序的增加由左至右遞增。
CHAPTER2化學鍵結
一、化學鍵的種類與分子間作用力
二、混成軌域與分子形狀的關係
三、分子極性
2-1化學鍵的種類
1.離子化合物通常由易失去電子的金屬與易得到電子的非金屬結合而成,金屬離子帶正電,而非金屬離子帶負電。
離子化合物的性質與原來元素迥異。
2.晶體內的粒子整齊排列,因此可找到一個最小的重複單位,此單位稱為單位晶格。
3.金屬價電子與金屬陽離子之間的吸引力稱為金屬鍵,此鍵結為造成金屬具有高導電及延展特性的主要原因。
4.分子是由相同或相異的二原子彼此擁有共用電子對而形成。
以此種方式鍵結的化學鍵稱為共價鍵。
八隅體法則是解釋分子鍵結的初期理論,適用於常見的主族元素化合物。
2-2價鍵理論
5.兩個氫原子互相接近時,氫原子核與另一氫原子的ls電子互相吸引而產生新的引力;但核與核間及電子與電子間也產生新的斥力。
當氫分子的能量狀態達到最低時,兩原子核的距離即為氫分子中氫-氫鍵的鍵長。
6.共用兩個電子的共價鍵稱為單鍵。
依據軌域重疊而產生的鍵結,單鍵具有核間軸周圍的電子密度對稱分布的特性,因此單鍵也是σ鍵。
7.雙鍵由一個σ鍵和一個π鍵組合而成。
π鍵電子密度分布在核間軸二側而在核間軸上的電子密度為零;參鍵則是由一個σ鍵和兩個π鍵組合而得。
8.原子軌域的s軌域和p軌域混成可得到sp3、sp2和sp三種混成軌域,其形狀分別為正四面體、平面三角形和直線形。
依據混成軌域學說,可用以解釋分子形狀及鍵角特徵。
2-3鍵極性、鍵偶極及極性分子
9.若構成共價鍵的原子不同,則因原子的電負度不同而產生極性共價鍵,如氯化氫分子中的氯-氫鍵為極性共價鍵。
10.具極性共價鍵的分子並非均為極性分子,若因分子幾何形狀的關係使鍵的極性互相抵消,則該分子亦為非極性分子,如CO2中的碳-氧鍵為極性共價鍵,但因兩個鍵的極性互相抵消,故CO2為非極性分子。
2-4分子間作用力
11.凡得瓦力包含了偶極-偶極力、偶極-誘導偶極力和分散力等三種。
12.氫鍵雖可視為偶極-偶極力的一種,但有時兼具離子鍵、共價鍵及凡得瓦力的部分特性,因此有些化學家將其另歸一類。
CHAPTER3液態與溶液
一、溶液的分類
二、膠體溶液的特性
三、溶液的性質
3-1溶液的種類與特性
1.降低溫度或增高壓力均可提高氣態溶質的溶解度。
3-2水的相變化
2.各類氣體的化學性質雖不相同,但均具有低密度、高壓縮性及熱膨脹性等共通性質。
3.物質具有固態、液態及氣態。
當溫度及壓力改變時,狀態之間會相互轉變。
一般情況下,隨著溫度的上升,物質會由固態熔化成液態,再汽化為氣態。
若不經液態直接由固態轉變氣態的現象稱為昇華。
4.科學家利用相圖記錄物質在不同溫度及壓力下的狀態。
其中三相點為該物質固、液、氣態三相平衡共存的特殊點。
5.利用粒子的運動模型可以說明物質三態的性質,通常氣態粒子間的距離及粒子的動能最大,液態次之,固態最小。
3-3汽化與蒸氣壓
6.定溫下,液體分子間的引力愈大,則蒸氣壓愈小,蒸發熱愈高。
另外,溫度升高時,由於液體內分子的平均動能變大,易於脫離液面而進入氣相,蒸氣壓因而增大。
7.水的飽和蒸氣壓隨溫度上升而變大。
實際的水蒸氣壓力和同溫下飽和水蒸氣壓的比值,稱為當時的相對溼度。
8.當液體的蒸氣壓和外界的大氣壓力相等時,液體開始沸騰,此時的溫度稱為沸點。
沸點的高低會因大氣壓力不同而改變,在一大氣壓時的沸點稱為正常沸點。
當物質的固相和液相共存時的溫度稱為凝固點,但受外界壓力的影響比沸點小。
9.含非揮發性溶質的溶液,其蒸氣壓比純溶劑低。
對於稀薄溶液,蒸氣壓下降的量可經由拉午耳定律計算出來。
10.形成理想溶液時,既不放熱也不吸熱,其蒸氣壓能遵循拉午耳定律。
但實際的溶液多屬於非理想溶液,由於溶質間及溶劑和溶質分子間的引力各不相同,混合時體積無加成性。
3-4溶液的性質
11.定溫下低溶解度的氣體在溶液中的溶解度與液面上該氣體的分壓呈線性關係,可以CA=KH‧PA表示,此現象稱為亨利定律。
12.溶液的某些性質若與溶質的本性無關,僅與溶質粒子數的多寡有關,稱為依數性質,常見的有溶液的蒸氣壓下降、沸點上升、凝固點下降及滲透壓等。
13.稀薄溶液的沸點上升及凝固點下降可分別經由下列公式求出:
ΔTb=iKbm及ΔTf=iKfm,
其中Kb及Kf分別稱為莫耳沸點上升常數及莫耳凝固點下降常數。
i為修正因子,用以修正溶質解離後所產生粒子的總莫耳數。
14.稀薄溶液的滲透壓(π)與溶液的濃度(M)和絕對溫度(T)成正比,亦即π=iMRT。
CHAPTER4水溶液中酸、鹼、鹽的平衡
4-1布-洛酸鹼理論
1.阿瑞尼斯酸鹼學說:
在水溶液中,酸性物質會解離出氫離子(H+),而鹼性物質會解離出氫氧離子(OH-)。
2.布-洛酸鹼學說:
酸鹼反應僅是物質間所發生的質子轉移反應,其中質子的提供者為酸,而質子的接受者為鹼。
4-2酸與鹼的平衡反應
3.各種酸與鹼在水中的解離度不盡相同,所以酸鹼可依其解離程度大小,概分為強酸、弱酸或強鹼、弱鹼。
酸的解離程度愈高,Ka值也愈大,Ka值的大小可作為酸強弱的判斷依據;鹼接受質子的傾向愈大,Kb也愈大;鹼接受質子的傾向愈小,Kb也愈小,Kb值可作為鹼強弱的判斷依據。
4.某些酸每一分子中含有多個能解離的質子,稱為多質子酸或多元酸。
含有多個可解離OH-之化合物,稱為多元鹼。
5.共軛酸鹼對的Ka×Kb=Kw。
4-3酸鹼滴定
6.藉由酸鹼中和反應,將已知濃度的酸(或鹼)液,逐滴加入待測溶液中,以得知待測溶液中鹼(或酸)的濃度,此種分析方法稱為酸鹼滴定。
4-4鹽
7.酸中可解離的氫離子完全被其他陽離子取代時,此類化合物稱為正鹽。
對多質子酸而言,若僅有部分氫離子被其他陽離子取代,仍保留部分可解離的氫離子時,這類化合物稱為酸式鹽。
若鹽的組成同時含有氫氧離子及其他陰離子,則屬鹼式鹽。
8.如果鹽類的組成中陽離子或陰離子不只一種,則稱為複鹽,複鹽溶於水後,解離成各種簡單離子。
錯鹽溶於水而解離時,會形成錯離子
9.鹽的水解反應可視為酸鹼中和的逆反應,強酸弱鹼產生的正鹽,可水解使溶液呈酸性;強鹼與弱酸形成的正鹽水解呈鹼性;弱酸與弱鹼形成的正鹽可水解,但溶液酸鹼性視正鹽水解後之陽離子和陰離子之相對酸鹼強度而定。
4-5緩衝溶液
10.弱酸與其共軛鹼或弱鹼與其共軛酸混合可配製緩衝溶液,此種溶液中若添加少量的強酸或強鹼,並不會大幅影響其pH值。
CHAPTER5氧化還原反應
5-1氧化數
1.反應前後,氧化數增加的物質,表示其失去電子,發生氧化,本身為還原劑;氧化數減少的物質,表示其得到電子,發生還原,本身為氧化劑。
5-2氧化還原滴定
2.將已知濃度的氧化劑(或還原劑)逐滴加入待測還原劑(或氧化劑)中,以得知待測物濃度,稱為氧化還原滴定。
5-3電池
3.發生氧化半反應的稱為陽極,發生還原半反應的稱為陰極。
4.一個電池所能產生的最大電壓,又稱為電動勢。
5.物質接受電子的趨勢稱為還原電位。
6.標準還原電位較高的半電池,得電子的傾向較大,是較強的氧化劑,在電池反應中擔任陰極;標準還原電位較低的半電池,得電子的傾向較小,反而容易失去電子,是較強的還原劑,在電池反應中擔任陽極。
7.凡是E電池>0的反應將可自然發生,E電池<0的反應無法自然發生。
8.鋅碳電池的陰極與陽極分別以石墨(碳)棒與鋅板製作而成。
碳棒雖作為電極,並未參與反應,只是惰性電極,真正的氧化劑是二氧化錳。
9.鉛蓄電池是目前汽機車不可或缺的電源,分別以鉛與二氧化鉛作為陽極與陰極,以30%的稀硫酸作為電解質,因而也稱為鉛酸電池。
5-4電解與電鍍
10.電池為自發反應,將化學能轉成電能;電解非自發反應,將外電源輸入的電能轉為化學能。
11.電解時某電極析出物質的質量
(ΔW)與電量(Q)、莫耳質量(M)及每莫耳物質得失電子數(n)等變因之關係可表示為:
n×
=
這就是著名的法拉第電解定律。
12.利用電解原理及裝置,輸入直流電,使溶液中的金屬離子還原為金屬,並沉積在陰極表面,即為電鍍。
如果以適當還原劑,使金屬離子還原並沉積在被鍍物的表面,即為無電電鍍。