中药保护申报程序.docx
《中药保护申报程序.docx》由会员分享,可在线阅读,更多相关《中药保护申报程序.docx(10页珍藏版)》请在冰豆网上搜索。
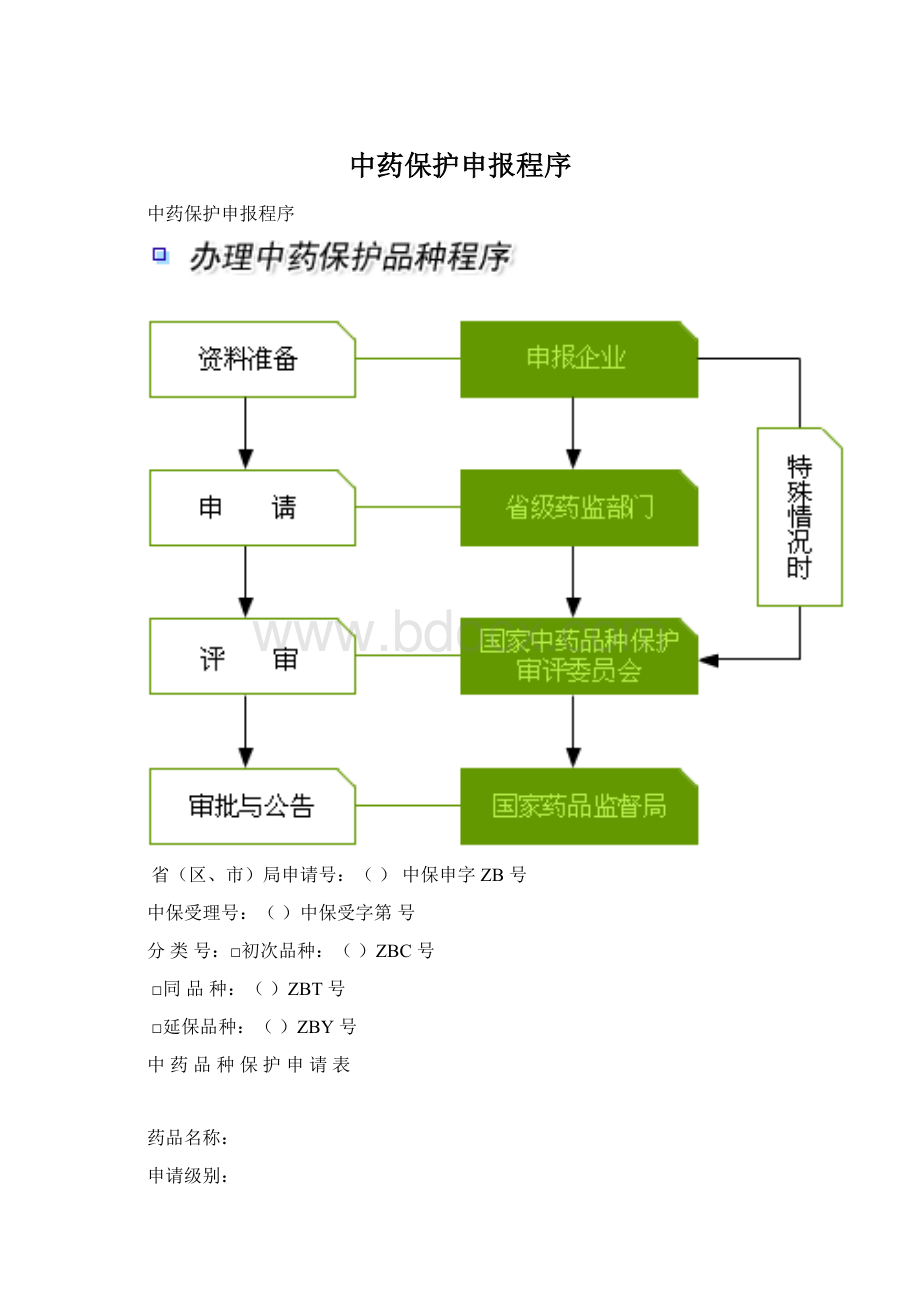
中药保护申报程序
中药保护申报程序
省(区、市)局申请号:
()中保申字ZB号
中保受理号:
()中保受字第号
分类号:
□初次品种:
()ZBC号
□同品种:
()ZBT号
□延保品种:
()ZBY号
中药品种保护申请表
药品名称:
申请级别:
申请企业:
(公章)
法人代表:
(签名)
联系人:
E-mail:
联系电话:
申报日期:
年月日
国家中药品种保护审评委员会制
申报资料项目
第一部分:
证明性文件
□1、药品批准证明文件复印件
□2、《药品生产许可证》及变更文件
□3、《药品GMP证书》
□4、对《改进意见与有关要求》实施情况综述
□5、其它
第二部分:
药学资料
□6、现行国家药品标准
□7、详细处方及制备工艺
□8、修订、提高质量标准的研究资料
□9、药品的原料、辅料标准
□10、内包材标准
□11、产品质量考核的有关资料及样品
第三部分:
安全性评价资料
□12、毒理学试验研究资料或文献资料
□13、注射剂安全性试验资料
□14、不良反应监测资料
第四部分:
临床试验资料
□15、临床试验单位资质证明
□16、临床试验方案
□17、临床试验
第五部分:
申报资料格式要求
□18、申报资料格式要求
填报说明:
1.申报资料统一使用A4纸张打印(左边距不小于28mm,页码标在页脚上面20mm的正中位置);
2.申报资料须按《中药保护品种申报资料项目要求及说明》中规定的序号编号,并在每项资料封面中间及其右上角分别写明资料名称及“申报资料1-18”的编号;
3、申报延长保护期的品种资料序号为4、8、12、13、17的项目应结合初次保护时提出的《改进意见与有关要求》提供资料;
4.申报资料一式两份,序号为4、8、12、13、17的项目应提供原件;
5.省(区、市)局申请号由初审单位编写,格式为(年度)+省份简称+中保申字ZB流水号;
6.中保受理号及分类号由国家中药品种保护审评委员会填写。
申请企业填报项目
生
产
企
业
基
本
情
况
企业名称
建立时间
通信地址
邮政编码
生产地址
邮政编码
E-mail
网址
企业登记
注册类型
固定资产
(万元)
职工总数
制药工人
技术人员
中级及其以上职称药学专业人员
法人代表
姓名
职称
从事制药年限
学历
总技术负责人
生产负责人
质量负责人
质检机构
名称
检验室面积(M2)
人员总数
高级技术职称
中级技术职称
执业药师
《药品生产许可证》核准生产范围
注册品种数
申请企业填报项目
申
请
保
护
品
种
基
本
情
况
药品名称
批准文号
注册商标
剂型
规格
专利情况
上年度销售额
(万元)
上年度利税
(万元)
GMP认证范围及证书号
品种来源及
工艺、质量
的稳定性
主要检验仪器设备
名称
数量
型号
所在省(区、市)药品检验所质量考核审查情况
药品名称
执行标准
□药典□局颁标准□注册标准□其它
标准出处及标准号
近三年抽、送检概况及对质量考核的结论性意见
(附三批检验报告)
检验单位对申请
保护品种的意见
盖章
年月日
省(区、市)药品监督管理部门初审意见
药学审查意见
(处方、质量标准及工艺)
医学审查意见
(临床研究及功能主治)
综合性意见
经办
(签名)
年月日
(盖章)
年月日
处审核
(签名)
年月日
局签发
(签名)
年月日
中药保护品种申报资料项目要求及说明
第一部分:
证明性文件
1、药品批准证明文件复印件
(1)现行生产批准文件或变更的有效文件(复印件);
(2)同一品种,多种规格,可按一个品种申请保护,并附相应的批准文件;
(3)国家药品监督管理局统一换发药品批准文号后变更生产企业名称的,应提供药品监督管理部门以新企业名称核发药品批准文号的批复文件;
(4)修订质量标准的,应提供国家药品监督管理部门的批复文件
及其所附药品质量标准。
2、《药品生产许可证》及变更文件
《药品生产许可证》的企业名称应与申报企业名称一致,有效期在规定的时限内,生产范围包含申报品种的剂型。
3、《药品GMP证书》
申请保护品种应提供与相关剂型的GMP证书(复印件),尚未取得《药品GMP证书》的申报企业,应提供GMP实施进展状况。
4、对《改进意见与有关要求》实施情况综述
申报延长保护期的品种,必需按照初次保护批件要求的《改进意见与有关要求》提供实施情况综述及相应补充的有关研究资料。
5、其它
申报中药保护的企业应当对所申请保护的品种,提供在中国的专利及其权属状态说明,并保证不侵犯他人的专利权。
第二部分:
药学资料
6、现行国家药品标准
申请保护品种应提供国家认可的药品标准,包括国家颁布的现行《中华人民共和国药典》或国家正式颁布的药品标准。
7、详细处方及制备工艺
处方应按国家药典药品标准格式列出全部药味和用量(以g或ml为单位),全处方量应以制成1000个制剂单位的成品量为准,炮制品应按药典要求注明。
国家药品标准中未公布完整处方、制成量的,应由国家药典委员会对申报处方工艺与原申报的完整处方及制成量予以核对;并提供现行详细生产工艺及工艺流程图,包括各生产工序的工艺条件和主要技术参数。
8、修订、提高质量标准的研究资料
(1)应参照《中药新药质量标准研究的技术要求》进行质量标准的修订、提高。
原则上要求增加鉴别项和含量测定项,并以君药、主药为主,总鉴别项目原则上应达到药味总数的1/2—1/3以上,至少有一个含量测定,首选君药(主药)、贵重药、毒性药制订含量测定项目。
并提供研究资料及标准起草详细说明及以下资料:
①省级药品检验所复核意见及修订后的质量标准草案(加盖骑缝章),附三批检验报告书;
②药检所修订的质量标准起草说明,必要时附相关的图谱及照片。
(2)中药注射剂质量标准的研究提高,应按照《中药注射剂质量标准的内容及项目要求》进行;
(3)修订的药品标准必须按标准修订程序申报,同时将有关资料抄送国家中药品种保护审评委员会。
9、药品的原料、辅料标准
(1)药材名称一律采用药品通用名称,多种基源的药材除按国家药品标准注明外,应明确其来源及产地;
(2)原料及辅料均应符合药用要求,并注明药用原料标准的出处(注明标准版本及页码);
(3)如所用原、辅料属省级药品标准的,应提供其合法的标准复印件;
(4)若所用原、辅料标准未得到国家或省级药品监督管理部门认可批准的,应制定其质量标准,经省级药品检验所复核,报省级药品监督管理部门批准。
10、内包材标准
直接接触药品的包装材料或容器,应按国家药品监督管理规定及要求提供《药品包装材料和容器注册证》或有关情况的说明。
11、产品质量考核的有关资料及样品
(1)本品种一年内,企业连续生产及出厂质量检验情况汇总表;
(2)近三年内省级药检所对该产品的质量考核情况报告及检验报告书;
(3)市场抽查情况:
应提供国家药品监督管理局及省药品监督管理部门对药品市场进行监督检查抽样发布的药品质量公告的有关资料;
(4)提供该产品至少三批在储存条件下进行的留样观察及稳定性考核记录;
(5)有效期内的2个最小销售单位的完整样品。
第三部分:
安全性评价资料
12、毒理学试验研究资料或文献资料
处方组成有下列情况,必须参照《中药新药药理毒理研究的技术要求》提供毒理学试验资料或文献资料:
①含十八反等配伍禁忌的;
②含有重金属和砷盐的;
③原药材中含毒性成分的;
④临床发现不良反应的;
⑤含有非法定原辅料药品标准的;
13、注射剂安全性试验资料
参照《中药注射剂研究的技术要求》中“有关安全性试验项目及要求”报送有关资料。
14、不良反应监测资料
注射剂及要求提供毒性试验研究资料的品种应提供不良反应考察情况及国家药品监督管理局药品评价中心出具的《不良反应检索报告》。
第四部分:
临床试验资料
15、临床试验单位资质证明
参加临床试验单位应为二级甲等以上医院3~5家,其中临床试验负责单位应为三级甲等医院,并须提供相应的医院等级资质证明。
16、临床试验方案
参照《中药新药临床研究指导原则》中Ⅲ期临床试验的有关要求提供临床试验的设计方案。
对照药物选择依据,并提供对照药物的质量标准或对照组设立的依据。
17、临床试验
(1)所申报的临床研究资料应提供参照《药品注册管理办法》、及《中药新药临床研究的技术要求》中Ⅲ期临床试验要求的临床试验资料(临床研究总结病例数不得少于300例,对照组另设);
(2)申请初次及同品种保护的临床试验资料可使用原新药研究资料或符合新药临床研究的资料;申请延长保护期的临床研究资料必须按照规定要求在批准保护期内重新进行研究的资料;
(3)各临床试验单位应提交试验报告,临床试验负责单位应整理出总结报告;临床报告应按新药临床研究要求的格式及内容进行书写。
第五部分:
申报资料格式要求
所有申报资料应参照《药品注册管理办法》要求整理书写,试验资料封面应写明验证项目,试验负责人并签字,试验单位名称并加盖公章,并注明各项试验研究工作的试验者、试验起止日期、原始资料的保存地点和联系人姓名、电话等,各试验研究负责人及单位应对所提供的研究资料真实性、可靠性负责。
国家中药品种保护审评委员会
2003年2月8日