废旧酸性锌锰干电池的回收和碳酸锰的制备.docx
《废旧酸性锌锰干电池的回收和碳酸锰的制备.docx》由会员分享,可在线阅读,更多相关《废旧酸性锌锰干电池的回收和碳酸锰的制备.docx(13页珍藏版)》请在冰豆网上搜索。
废旧酸性锌锰干电池的回收和碳酸锰的制备
废旧酸性锌锰干电池的回收和碳酸锰的制备
摘要本文研究了在实验室中以废旧锌锰干电池为原料,各种回收制备较纯产品
碳酸锰的方法。
本实验中采用了用硫酸和双氧水溶解二氧化锰,再向硝酸锰溶液
中边搅拌边缓慢滴加0.5mol/L的碳酸钠溶液制碳酸锰的方法。
关键词:
锌锰干电池回收碳酸锰
1.前言:
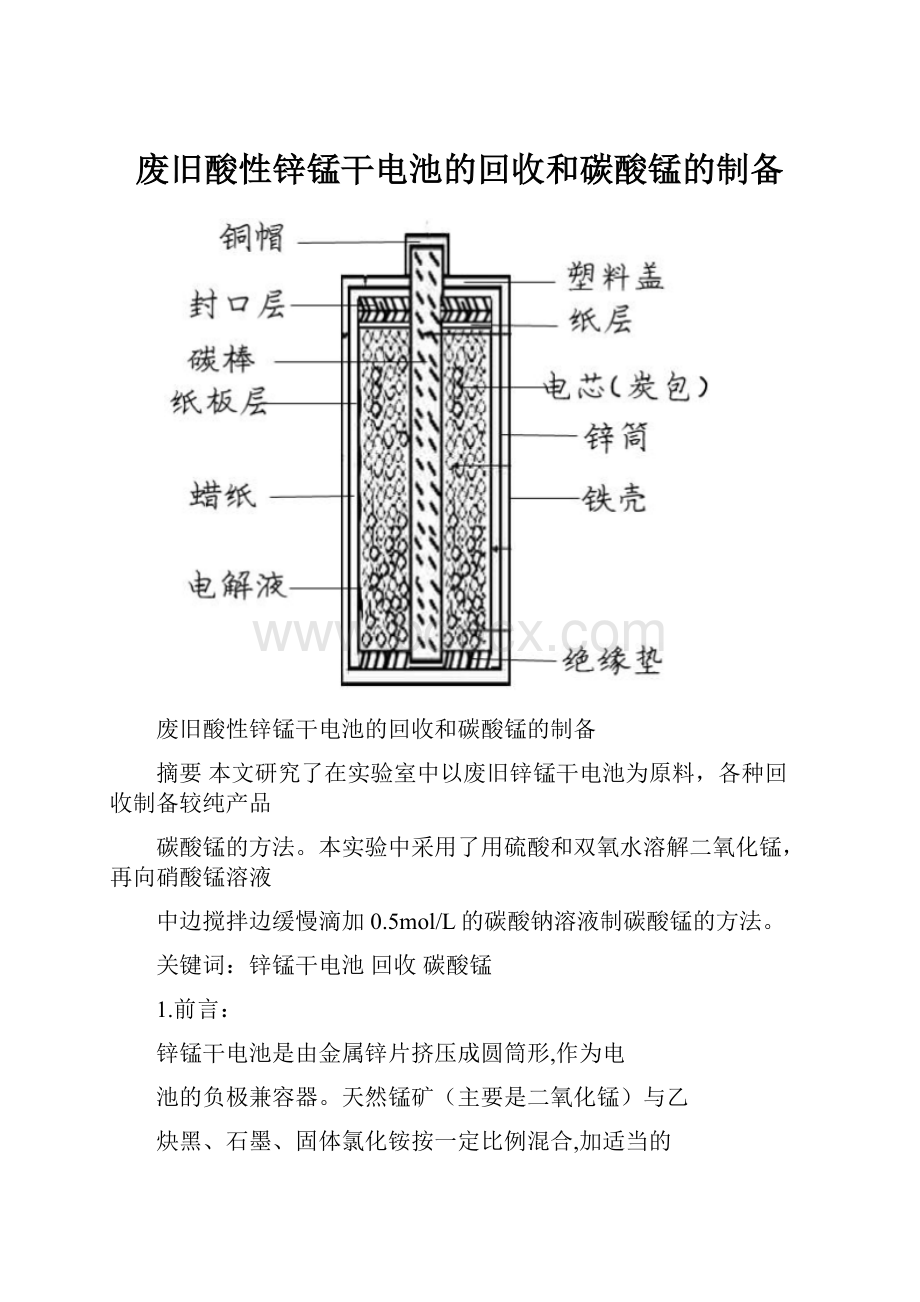
锌锰干电池是由金属锌片挤压成圆筒形,作为电
池的负极兼容器。
天然锰矿(主要是二氧化锰)与乙
炔黑、石墨、固体氯化铵按一定比例混合,加适当的
电解液压制成电芯(或称炭包)。
炭包周围包上棉纸并
在其中插入炭棒,同时炭棒头上戴上铜帽,构成电池
的正极。
用氯化铵、氯化锌的水溶液作为电解质,并
加入淀粉,通过加温糊化、凝固,达到不流动的目的。
电池底部内放有绝缘垫,上部有纸垫和塑料盖,锌筒
外部裹一张蜡纸或沥青纸,并在最外面包以纸壳或铁
壳商标【2】。
电池的组成含量取决于其品牌和种类,通
常锌锰电池的组成成分中炭包和锌壳约占总质量的四分之三。
其中锰存在于炭包
中。
炭包的配方不同,其主要成分的含量也有差异,有文献报道了三种配方炭包
的成分含量表如下:
表1炭包主要成分的百分含量(%)、成分天然锰矿石墨粉乙炔黑NH4Cl外
加电液
配一7030011.212
二8020011.212
方三85510153
很明显,锰的化合物(主要是MnO2)是炭包的主要成分。
随着锌锰电池生产和消费数量的逐年增加,废旧锌锰电池的回收和处理引起
人们的极大关注。
由于废锌锰电池中含有汞、镉、锌、铜、锰等重金属,对人类
3和大自然有极大危害。
一节一号电池如不经过处理随意丢弃在田地里能使1m的
土壤永久失去农用价值,一粒纽扣电池可使600t水受到污染。
可见,废旧电池
如用完随意丢弃,电池中所含的重金属元素就会渗露出来造成水、土壤、空气的
严重污染,危害生态环境以及人体健康,而且也会导致金属资源浪费。
若能将废
旧锌锰电池回收利用,既可以节约资源,又可以消除废旧电池对环境的污染。
有
关文献报道,我国每年报废50万吨废锌锰电池,若能全部回收利用,可再生锰
11万吨、锌7万吨、铜1.4万吨,是相当可观的资源。
因此,对废旧锌锰电池
进行回收利用,可以实现锌、锰等金属资源再生利用。
碳酸锰为玫瑰色三角晶系菱形晶体或无定形亮白棕色粉末。
它是制造电信器材软磁铁氧体、合成二氧化锰和制造其他锰盐的原料,用作脱硫的氧化剂、瓷釉、涂料和清漆的颜料,也用作肥料和饲料添加剂。
它同时用于医药、电焊条辅料等,且可用作生产点解金属锰的原料。
酸性锌锰干电池由锌皮,锌粉,氧化锌,碳棒,乙炔黑,氯化铵,铅,镉,汞,电糊,沥青,三氧化二锰,塑料,铜帽,铁壳,纸等组成,其中锌和锰所占比例较大。
各类电池成分的综合分析结果如表1。
本实验使用的是松下电池,汞镉零使用,其成分分析结果如表2所示。
[6]表1各类电池综合成分分析结果
电池的阳极是碳棒(二氧化锰),在碳棒周围填充的是石墨粉及二氧化锰的混合物;阴极是锌皮,电解液是糊状物,内有NH4Cl、ZnCl2和淀粉等,把化学能转变为电能。
反应时,
锌失去电子被氧化,二氧化锰得到电子被还原。
电池符号:
(—)Zn|NH4Cl•ZnCl2|MnO2(+)
总电池反应:
Zn+4NH4Cl+2MnO2====Zn(NH3)4Cl2+2MnO(OH)+2HCl
2.制备方法:
2.1工业上:
方法一:
将软锰矿煅烧成氧化锰,酸化后加入过量碳酸氢铵即可制得碳酸锰。
方法二:
以菱锰矿为原料,采用无机酸浸取,获取相应的锰盐溶液,锰盐与碳酸盐沉淀剂再进行复分解反应制得碳酸锰。
方法三:
向锰盐溶液中通入二氧化碳、氨气制备碳酸锰。
方法四:
用贫矿湿法可直接生产高纯度碳酸锰。
2.2本实验中,以干电池中的二氧化锰为原料制备碳酸锰。
制备方法:
方法一:
在酸浸、过滤后得到的酸浸渣中加入理论量的110%的H2SO4,于充分搅拌下,采用逐步法加入理论量120%的还原剂FeS,使酸浸渣中难溶于酸的猛还原浸出。
反应4h后过滤,与所得滤液中加入MnO2使溶液中的二价铁氧化为三价铁,加入氨水除去杂质铁。
其他重金属离子用加入Na2S形成硫化物沉淀的方法除去。
以上反应均在95℃下进行。
于除去重金属杂质后的硫酸锰净液中加入NH4HCO3,使生成难溶的碳酸锰沉淀,过滤,所得碳酸锰沉淀在烘箱中烘干。
方法二:
也可以用FeSO4—H2SO4溶液浸出法提取猛。
其主要反应为:
MnO2+FeSO4+2H2SO4=MnSO4+Fe2(SO4)3+2H2O
Fe2(SO4)3+6NH3﹒H2O=Fe(OH)3+(NH4)2SO4
MnSO4+NH4HCO3=MnCO3↓+NH4HSO4
按每1000mL2.2mol/LH2SO4溶液溶解57克铁屑配制FeSO4—H2SO4混合液。
在大烧杯中,向已经预处理过的锰粉中加入混合液,控制温度不低于80℃,搅拌器转速45r/min,反应时间1小时,抽滤。
将滤液转移至烧杯中,加热至60℃,滴加碳酸氢铵溶液,搅拌,当pH为4.5左右时,停止滴加,抽滤,将滤液转移至烧杯中,此时滤液为MnSO4、(NH4)2SO4混合液。
继续滴加碳酸氢铵溶液,至沉淀完全,抽滤,洗涤固体至无硫酸根离子,烘干固体,即得到碳酸锰。
方法三:
将水洗过的锰粉在马弗炉内750℃下灼烧1小时,碳和汞基本被除尽,部分高价锰也被还原为氧化锰。
2MnO2+C=2MnO+CO2MnO2+C=MnO+COMnO2+CO=MnO+CO2
用硝酸和双氧水溶解灼烧后的粉末,向硝酸锰溶液中边搅拌边缓慢滴加0.5mol/L的碳酸钠溶液,滴加不能过快以免局部浓度过大使碳酸锰氧化,抽滤,洗涤沉淀,烘干,即得碳酸锰。
方法四:
在灼烧锰粉以后,用草酸还原高价锰。
MnO2+H2C2O4+4H+=Mn2++2CO2+2H2O
除去铁等杂质后,向溶液中加入碳酸钠溶液,得到碳酸锰沉淀。
方法五:
在灼烧锰粉以后,用盐酸做还原剂还原高价锰。
生产时间:
5-6小时生产成本:
>9.6元/kg利润:
<-2.1元/kg
4.实验方法选择及实验内容:
4.1不同方法的分析及选择
碳还原法若碳和锰粉混合不均匀,反应不完全,产率很低。
用草酸做还原剂,容易产生草酸锰沉淀,而损失碳酸锰。
用盐酸作为还原剂,会产生大量氯气,在溶液中不易排尽,且会污染环境。
考虑到实验操作的方便性、产率和对环境的影响,本实验选择以下方法:
将预处理过的黑粉高温灼烧后,用硫酸和双氧水浸出锰,除去铁等杂质后,用碳酸氢铵与硫酸锰进行复分解反应制备碳酸锰。
4.2实验流程图及方程式
2MnO2+C→2MnO+CO2
MnO2+C→MnO+CO
MnO2+CO→MnO+CO2
MnO+H2SO4→MnSO4+H2O
MnO2+H2O2+H2SO4=MnSO4+2H2O+O2
4.3实验内容
实验仪器:
剪刀、小锤、砂纸、玻璃棒、表面皿、烧杯、布氏漏斗、吸滤瓶、真空泵、洗瓶、滴管、煤气灯、三脚架、石棉网、蒸发皿、小试管、试管架、滴定管、滴定管夹、玻璃挂钩、干燥器、坩锅、微波炉、烘箱、台天平、电子天平。
实验试剂:
3%H2O2溶液、稀氨水、硫酸溶液、Na2S溶液、NH4HCO3溶液、盐酸、KSCN溶液
实验步骤:
1.锌锰干电池的预处理
剖开锌锰电池,剥离碳粉。
将电池中的黑色粉末置于烧杯中,用2mol/L的硫酸浸泡。
将黑色糊状物的浸取液过滤,滤渣先放在蒸发皿上,在煤气灯上蒸干。
再在400-500℃下灼烧至无明亮火星,冷却得到棕色固体粉末。
称量。
(灼烧的目的一是除去碳粉,二是使高价锰氧化分解。
灼烧至碳完全分解,资料显示在500℃分解,碳不易烧去,温度越高,碳越易烧去;在600℃,碳可以烧去,但锰的高价氧化物不易还原为氧化锰,温度>750℃,锌将以蒸汽形式进入烟气。
本实验的下步操作将使用双氧水充分还原。
故只需使得碳粉完全分解。
)
2.制MnSO4
取5克左右棕色固体至250mL烧杯中,适量的3mol/L的硫酸。
连好水浴装置,
保持水浴温度稳定的85℃左右,分批加入3%的双氧水。
每次等待反应较为缓和后再继续加,避免双氧水过量。
直至不再有气泡产生为止,使过量的双氧水分解,冷却,过滤。
3+
3.除杂(Fe)
向所得的溶液加热煮沸,并加入氨水调节PH为4-5左右,搅拌均匀,使其沸腾5分钟以上。
冷却并加活性炭搅拌。
使其沉淀充分,过滤至滤液几近无色。
若仍有明显黄色,则重新加热煮沸调PH,再过滤。
4.制得产品
向溶液中逐批加入7.5%的NH4HCO3溶液,调节PH为8左右,搅拌5分钟后静置30分钟。
抽滤,并用水洗涤沉淀。
用BaCl2检验溶液中是否有SO42-,无SO42-时达到洗涤终点。
将产品放在60-70℃水浴下干燥。
称量。
3.3实验步骤及现象记录
由于实验时间和实验室条件限制,实际实验中只制备了碳酸锰,实验记录如表4。
表4碳酸锰制备实验记录表
5.产品纯度分析
二价锰的含量分析:
称取0.18g的样品,称准之0.0002克。
加20ml水,滴加6mol/L盐酸溶液,水浴加热至样品溶解,必要时加1-2滴过氧化氢至暗色退去。
再加100ml水,2ml的10%盐酸羟胺溶液,用0.05mol/LEDTA标准液滴定,近终点时,加10mlNH3-NH4Cl
(PH=10),5滴5%铬黑T指示剂。
继续滴定溶液由紫红色变为纯蓝色:
实验数据电池剥离
量:
5.07g
黑色粉末52.35g
实验取黑
量:
灼烧后固4.65g
滴加H2SO4体
滴加8.3mL
称取NH4HCO3质量:
6.26g制得产品MnCO3:
3.30g含量分析:
MnCO3的纯度按下式计算:
记录:
后碳棒质总质量:
色粉末质体质量:
3mol/L积:
20mLH2O2体积:
w
Mn%Mn%理论
*100%
4.2碳酸锰回收实际成本结算
表6,表7分别是实验中实际使用的试剂的量和试剂及产品的价目表。
试剂使用量列表试剂浓度用量纯水500mL硝酸6mol/L36mL过氧化氢3%40mL氨水1:
640mL碳酸钠溶液0.5mol/L98mL
表6试剂使用量列表
药品
CuNa2CO3KClO3NaHCO3NH4HCO3(NH4)2CO3
MnO2Na2SO3H2C2O4Na2C2O4MnCO3
规格ARCPCPCPCPCPCPCPCPCPAR
重量500g500g500g500g500g500g500g500g500g500g500g
试剂与产品价目表价格(元)药品40.00NaAc9.00活性炭18.0011.5015.0015.0050.3010.0017.7029.0030.00
HClH2SO4HNO3NH3
•H2OH2O2HAcNaOHNaClOKMnO4
规格
CPCPCPCPCPCPARARCPCPCP
重量500g1000g500mL500mL500mL500mL500mL500mL500g500g500g
价格(元)9.0032.005.507.507.505.008.0018.007.5012.8015.20
表7试剂与产品价目表
根据表6和表7,并参考表2中纯水价格的数据,假设回收电池为零成本,可以算出本实验中碳酸锰回收的成本和利润。
表8碳酸锰回收利益估算表
这样的计算虽然有准确价格数据,但仍是估算。
因为一方面实验中洗涤及配制所需浓度溶液用的水量不精确;另一方面,这里售出碳酸锰的收入是按照分析纯的级别算的,而其实碳酸锰的纯度达不到分析纯的标准(含量>99%),所以实际收入应该更低。
不过,成本也可以更低,实验中所加硝酸的量大于需求量,若按孔祥平[15]的结论,硝酸只需要15mL,同时考虑更节约用水和工业上水的部分循环利用的话,成本可控制在0.85元/g左右。
不过这仍不一定精确,因为孔祥平所用电池与本实验所用电池不同,成分自然有所差异。
特别地,本实验中的电池是无汞镉的,那么应该含有特殊的汞镉替代品,故成分相差可能较大,那么浸泡需要的酸量也可能会不同。
但是,即使控制了成本,碳酸锰的回收实验仍是亏损的。
如果在算上回收成本较低的碳棒、锌皮和铁皮的话,总利润可以达到正值,但是这也反映了废旧电池回收这项工程的利润较低,这或许是现阶段该项事业仍未发展起来的原因之一。
5总结
废旧电池的综合回收和利用是个庞大而复杂的课题。
从废旧电池中可以回收锌、锰、铜、铁、碳电极、氯化铵等物质。
从废旧电池中回收碳酸锰要特别注意铁离子的除杂,测定锰时要注意铁的掩蔽,否则会给实验的准确性带来重大影响。
废旧电池的回收发展较慢,一定程度上是因为回收成本过高,所以亟需更有效地回收方法或者是新型清洁电池的发明与生产
参考文献:
[1]李运刚.废干电池回收利用述评.环境保护,2000,
(2):
43-45.
[2]彭清静,傅伟昌,邹晓勇.用均匀沉淀法制备高纯碳酸锰.吉首大学学报,2001,22(3):
48-50.
[3]倪晓蕊,张鹏,郭斌.废旧干电池的干湿法处理工艺.华北电力大学学报,2003,30(4):
100-102.
[4]于长顺,马春.废旧干电池的回收与利用技术的研究.实验室科学,2005,4
(2):
118-121.
[5]裴秀中.废干电池回收制氧化锌超细粉体.北京工商大学学报,2005,23(5):
11-13.
[6]余自明.用废干电池生产二氧化锰和七水硫酸锌工艺的研究.化学世界,2005,(8):
508-509.
[7]谭艳芝,李良,丘克强,陈启元,潘育方.废锌锰电池中锌的真空回收处理.电源技术,
2006,30(3):
213-216.
[8]沈丽霞.废旧干电池的回收和再利用.辽宁化工,2007,36(11):
725-727.
[9]高宇,阎立芳.锌粉含量测定.河北化工,2008,31(3):
75-76.
[10]王玲,王珊珊,屈亚娟,刘妮,李有聪,唐志华.废旧电池中铜锌锰及氯化铵的分离和
利用.广东微量元素化学,2008,15(9):
57-60.
[11]赵东江,李秋生,白晓波,马松艳.酸浸法由废旧锌锰电池制取碳酸锰的研究.环境科学
与技术,2009,32(5):
158-160.
[12]刘玉洁.FeSO4—H2SO4溶液浸出法从废旧干电池中回收锰制备硫酸锰工艺的研究.科技信
息,2006,(8):
4-5.
[13]何乐萍,张树蔚,高贵华,周静,高发奎,陈兴国.废干电池碳包中锰的回收机碳粉的
纯化技术研究.甘肃科技,2008,24(23):
66-68.
[14]孔祥平.废旧锌锰干电池中锰的回收条件研究.应用化工,2009,38(7):
990-994.
[15]南京大学大学化学实验教学组.大学化学实验.北京:
高等教育出版社,2009.
[16]毛海荣.无机化学实验.南京:
东南大学出版社,2006.295-296.
[17]李文军.无机化学实验.北京:
化学工业出版社,2008.107-109.
[18]王玲,何娉婷.大学化学实验.北京:
国防工业出版社,2004.123-126.
[19]丁杰.无机化学实验.北京:
化学工业出版社,2010.117-121.