专题21 实验排序题专练高三化学冲刺复习主观题一遍过原卷版.docx
《专题21 实验排序题专练高三化学冲刺复习主观题一遍过原卷版.docx》由会员分享,可在线阅读,更多相关《专题21 实验排序题专练高三化学冲刺复习主观题一遍过原卷版.docx(15页珍藏版)》请在冰豆网上搜索。
专题21实验排序题专练高三化学冲刺复习主观题一遍过原卷版
专题21实验排序题专练
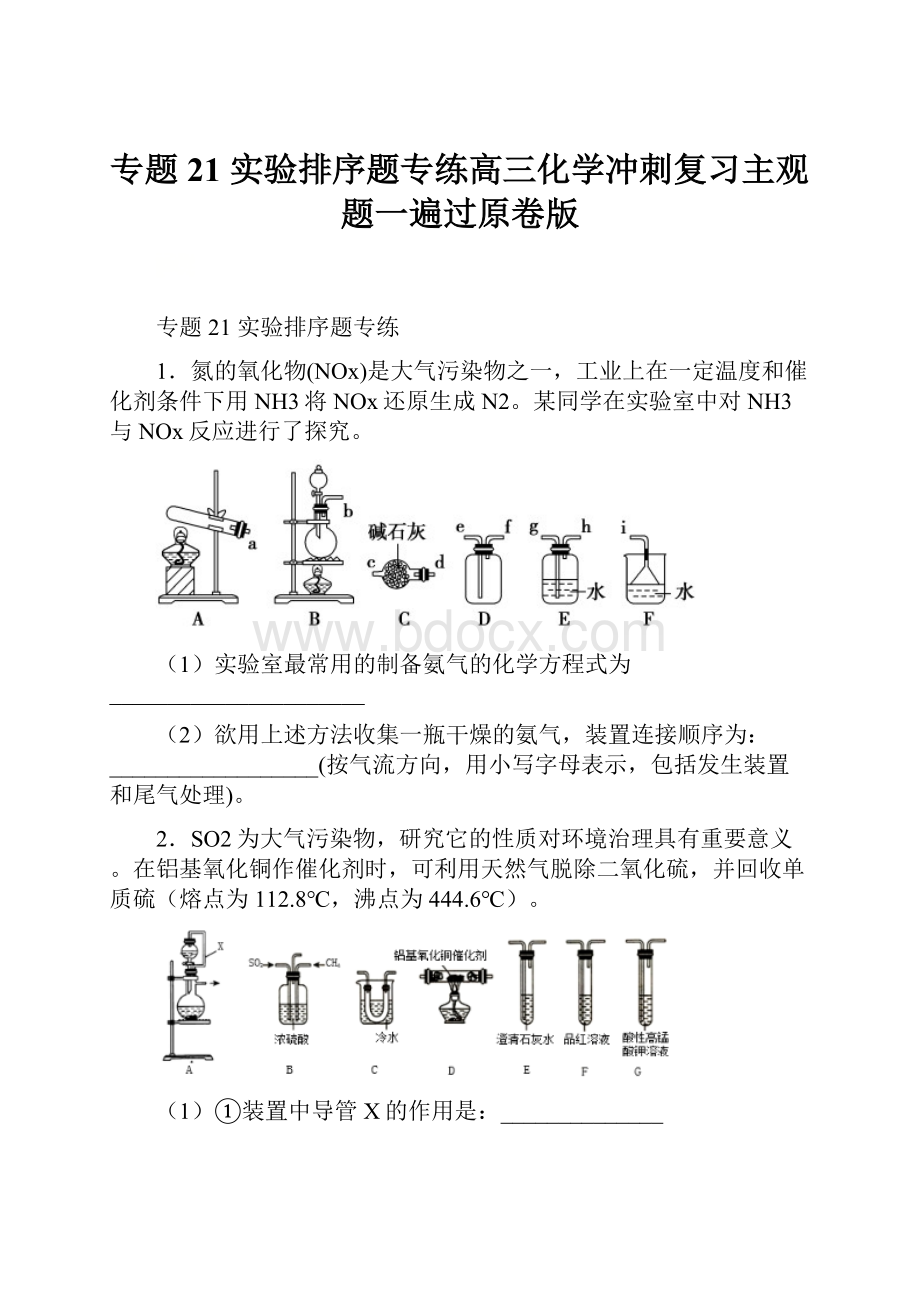
1.氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。
某同学在实验室中对NH3与NOx反应进行了探究。
(1)实验室最常用的制备氨气的化学方程式为______________________
(2)欲用上述方法收集一瓶干燥的氨气,装置连接顺序为:
__________________(按气流方向,用小写字母表示,包括发生装置和尾气处理)。
2.SO2为大气污染物,研究它的性质对环境治理具有重要意义。
在铝基氧化铜作催化剂时,可利用天然气脱除二氧化硫,并回收单质硫(熔点为112.8℃,沸点为444.6℃)。
(1)①装置中导管X的作用是:
______________
(2)利用制得的CH4和SO2并结合B~G装置验证反应产物:
CH4+2SO2
2S+CO2+2H2O生成的单质S和CO2。
①B装置作用除了干燥气体和充分混合气体外还有______________________
②实验装置依次连接的合理顺序为B、______________(每个装置只用一次)
3.某学习小组查阅资料可知高温下,FeCl2与O2反应一定生成Fe2O3,可能生成FeC13或Cl2。
该小组同学利用如下装置对该反应进行探究。
回答下列问题:
查阅资料:
FeCl2固体呈绿色,熔点为674℃,沸点为1023℃;FeC13在100℃左右升华。
(l)装置A中盛放蒸馏水的仪器名称为____。
(2)按气流从左到右的顺序,上述装置合理的连接顺序为____(填仪器接口的小写字母)。
4.二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点为-105℃,沸点为79℃,140℃以上时易分解。
并且Li-SOCl2电池可用于心脏起搏器。
该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。
电池的总反应可表示为4Li+2SOC12=4LCl+S+SO2。
(1)甲同学设计如图所示的装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并利用装置F验证生成物中的某种气体(夹持及加热装置略)。
①用原理解释SOCl2在该实验中的作用:
_________________________________。
②装置的连接顺序为A→B→______________________。
5.磺酰氯(SO2Cl2)是一种重要的有机合成试剂,主要用作氯化剂或氯磺化剂,也用于制造医药品、染料、表面活性剂等。
实验室可利用SO2与Cl2反应制取少量SO2Cl2,所需装置如图所示(部分装置略):
已知:
①Na2SO3+H2SO4
Na2SO4+H2O+SO2↑。
②SO2Cl2的熔点为-54.1℃,沸点为69.1℃,密度为1.67g/mL。
它在常温下较稳定、遇水剧烈水解,100℃以上易分解。
回答下列问题:
(1)检查装置A气密性的操作是___________。
(2)选择实验装置(A~E)并连接接口(a~h)顺序:
(A-a)___________(b-B-c)___________(h-E)(装置可重复使用)。
(3)B装置中的冷凝管需连接冷凝水,它应从___________(填“m”或“n”)接入。
6.FeCl3是重要的化工原料,无水氯化铁在300℃以上升华,遇潮湿空气极易潮解
(1)制备无水氯化铁
①仪器X的名称为____。
②装置的连接顺序为a→____→i,k→____(按气流方向,用小写字母表示)。
7.化学实验是科学探究过程中的一种重要方法,掌握化学实验的基本操作和物质的制备、转化及性质的探究尤为重要,请结合所学化学实验知识回答以下问题。
如图A、B、C是实验室常见的气体发生装置:
(1)①选择上图装置组装一套实验装置来收集一瓶干燥的氨气,所选装置的连接顺序为:
发生装置→___→___,______→_____→i(按气流方向,用小写英文字母表示)。
(2)①若用A装置制取Cl2,产生Cl2的离子方程式为__________________________________。
8.亚硝酰氯NOCl可用于合成清洁剂等。
它可用Cl2与NO在常温常压下合成:
它的熔点为-64.5℃,沸点为-5.5℃,常温下是黄色的有毒气体,遇水易水解。
请按要求回答下列相关问题:
(1)过量铁屑和稀硝酸充分反应制备NO的离子方程式为:
______________________。
(2)制备NOCl的装置如下图所示,连接顺序为:
a→_________________________(按气流自左向右方向,用小写字母表示)。
①装置A和B作用是①干燥NO和Cl2,②___________________________________________。
②装置D的作用是______________________________________。
9.氨与硝酸都是氮的重要化合物,在工农业生产中有广泛应用。
回答下列问题:
(1)氨气的制备
①氨气制取的发生装置可以选择上图中的_________(填字母),反应的化学方程式为_____________________________________________。
②选择上图装置组装一套实验装置来收集一瓶干燥的氨气,所选装置的连接顺序为:
发生装置→______→______→______→_____→i(按气流方向,用小写英文字母表示)。
③可用如图装置进行氨的喷泉实验,引发喷泉的操作是_______________________________。
10.有下列装置图
Ⅰ.探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与____________(填装置编号)连接;装置C中的烧瓶内固体宜选用________________________。
a.碱石灰b.氯化钙c.五氧化二磷d.浓硫酸
(2)装置A、E、E连接可制取纯净、干燥的氯气,A中发生的离子反应方程式为:
_________________;则两个E装置内的药品依次是_________、_____________。
11.硫是一种自然界分布较广的元素,在很多化合物中都含有该元素,回答下列问题:
(1)装置A中反应的化学方程式为________________________________。
(2)使分液漏斗中液体顺利流下的操作是_______________________________________。
(3)选用上面的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按照A→C→F的顺序连接装置即可证明,乙同学认为该方案不合理,其理由是___________________________________________。
②丙同学设计的合理实验方案为:
A→C→____→____→D→F,其中装置C的作用是_______________,证明亚硫酸的酸性强于次氯酸的实验现象是___________________。
12.三氯化硼(BCl3)是一种重要的化工原料。
实验室制备BCl3的原理B2O3+3C+3Cl2=2BCl3+3CO,某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。
已知:
BCl3的熔点为-107.3℃,沸点为12.5℃,遇水水解生成H3BO3和HCl,请回答下列问题:
(实验Ⅰ)制备BCl3并验证产物CO
(1)该实验装置中合理的连接顺序为G→_____→_____→_____→____→F→D→I。
其中装置E的作用是___________________________。
(2)装置J中反应的化学方程式为____________________________________。
13.氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。
某同学在实验室中对NH3与NO2反应进行了探究。
回答下列问题:
(1)用消石灰和氯化铵固体制备NH3
①NH3的发生装置应选择上图中的_______(填序号),制备NH3的化学方程式为______。
②欲收集一瓶干燥的NH3,选择上图中的装置,其连接顺序为:
发生装置→_________(按气流方向,用小写字母表示)。
14.某学习小组的同学对氯气与铁的反应及产物进行了如下探究:
(1)装置的连接顺序为a→__________→___________→______________→_______________→b→c→f。
(2)硬质玻璃管中可观察到的现象是_________________________;硬质玻璃管与收集器之间没有用导管连接,原因是______________________________________________。
15.化学是一门以实验为基础的学科,试回答以下问题:
(1)选用装置乙、丙、戊制备、收集一氧化氮气体,乙中塑料板上若放置石灰石,戊中盛满稀NaOH溶液,仪器正确的连接顺序为_____(用接口字母表示);戊中盛放稀NaOH溶液的原因是_____。
16.二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水。
某小组在实验室中探究ClO2与Na2S的反应。
请回答下列问题:
(1)ClO2的制备(已知:
SO2+2NaClO3+H2SO4=2ClO2+2NaHSO4)
①装置A中反应的化学方程式为_____________。
②欲收集一定量的ClO2,选择上图中的装置,其连接顺序为a→______(按气流方向,用小写字母表示)。
17.氢化铝锂(LiAlH4)是有机合成中的重要还原剂。
某课题组设计实验制备氢化铝锂并测定其纯度。
已知:
氢化铝锂、氢化锂遇水都剧烈反应并产生同一种气体。
活泼金属硫化物与酸反应产生H2S气体。
Ⅰ、制备氢化锂:
选择下图中的装置制备氢化锂(有些装置可重复使用):
(1)装置的连接顺序(从左至右)为A→___________________________________。
(2)检查好装置的气密性,打开装置A中分液漏斗的活塞后,点燃酒精灯前需进行的实验操作是________。
18.草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,170℃以上分解。
常温下它的电离常数K1=5.4×10-2,K2=5.4×10-5。
回答下列问题:
(1)查阅资料知:
草酸晶体175℃分解成CO2、CO、H2O,请写出草酸晶体分解的化学反应方程式:
_____。
(2)请用下列的装置(图中加热装置已略去)分解草酸晶体以制备少量CO气体,最佳的连接顺序为:
_____。
(填字母序号)
19.常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8℃,42℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水反应生成HClO。
(制备产品)
将氯气和空气(不参与反应)按体积比1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。
(1)各装置的连接顺序为→→→C→。
_____
(2)装置B中多孔球泡和搅拌棒的作用是_________;装置C的作用是_____。
20.二氧化氯(ClO2) 是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水。
某小组在实验室中探究ClO2与Na2S的反应。
回答下列问题:
(1)ClO2的制备:
已知:
SO2+2NaClO3+H2SO4=2ClO2↑+2NaHSO4
①装置A中反应的化学方程式为__________。
②欲收集ClO2,选择上图中的装置,其连接顺序为a→__________(按气流方向,用小写字母表示)。
③装置D的作用是___________________。
21.1814年戴维发现了一氯化碘(沸点97.4℃),是一种红棕色易挥发液体,它的性质与卤素相似,可用作强氧化剂。
干燥的氯气与碘反应可以制备ICl,请用下列装置来制备ICl。
回答下列问题:
(1)制备ICl时,各装置接口的连接顺序是__________。
(2)能否将装置B中的饱和食盐水换成水______(填“能”或“不能“);请用平衡移动的观点解释其理由________________。
(3)D装置中的烧瓶需放在冷水中,其目的是____________。
22.请从图中选出必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性。
①A极发生的电极反应式是________________,B极发生的电极反应式是_______________。
②设计上述气体实验装置时,各接口的正确连接顺序为_________________________________________________________。
③实验中,在盛有KI淀粉溶液的容器中发生反应的离子方程式为______________________。
23.四氯化钛(TiCl4)是生产金属钛及其化合物的重要中间体。
室温下,四氯化钛为无色液体。
某化学兴趣小组同学以TiO2 和CCl4为原料在实验室制取液态TiCl4,装置如下图所示:
有关信息如下:
①反应原理:
TiO2(s)+CCl4(g)
TiCl4(g)+CO2(g)。
②反应条件:
无水无氧且加热。
③有关物质性质如下表所示:
物质
熔点/℃
沸点/℃
其他
CCl4
-23
76
与TiCl4互溶
TiCl4
-25
136
遇潮湿空气产生白雾
请回答下列问题:
(1)装置F中有氮气生成,该反应的化学方程式为_______________________。
(2)实验装置依次连接的顺序为F→B→______。
(3)实验开始前首先点燃____处(填“D”或“F”)酒精灯,目的是______________。
24.氢化钙固体是登山
运动员常用的能源提供剂。
某兴趣小组拟选用如下装置制备氢化钙。
回答下列问题:
(1)检查装
置E气密性的操作方法是。
(2)利用上述装置制取氢化钙时按气流方向连接顺序为(填仪器接口的字母编号)。
i→_______→_______→_________→→→→a
(3)根据完整的实验装置进行实验,实验步骤如下:
检查装置气密性后,装入药品;打开分液漏斗活塞;______________(请按正确的顺序填入下列步骤的标号)。
A.加热反应一段时间B.收集气体并检验其纯度
C.关闭分液漏斗活塞D.停止加热,充分冷却
25.FeCl3在现代工业生产中应用广泛。
经查阅资料得知:
无水FeCl3在空气中易潮解,加热易升华。
工业上,向500—600℃的铁屑中通入氯气可生产无水氯化铁;向炽热铁屑中通入氯化氢可以生产无水氯化亚铁。
某化学研究性学习小组模拟工业生产流程制备无水FeCl3并对产物做了如下探究实验,请回答下列问题:
(1)装置的连接顺序为a→(用b、c…h表示)。
(2)i.A中装置气密性检验方法。
ii.D中碱石灰的作用是。