第3章立体化学基础.docx
《第3章立体化学基础.docx》由会员分享,可在线阅读,更多相关《第3章立体化学基础.docx(15页珍藏版)》请在冰豆网上搜索。
第3章立体化学基础
第3章立体化学基础
一、异构体的分类
异构现象是有机化学中存在着的极为普遍的现象。
其异构现象可归纳如下:
对映异构是指分子式、构造式相同,构型不同,互呈镜像对映关系的立体异构现象。
对映异构体之间的物理性质和化学性质基本相同,只是对平面偏振光的旋转方向(旋光性能)不同。
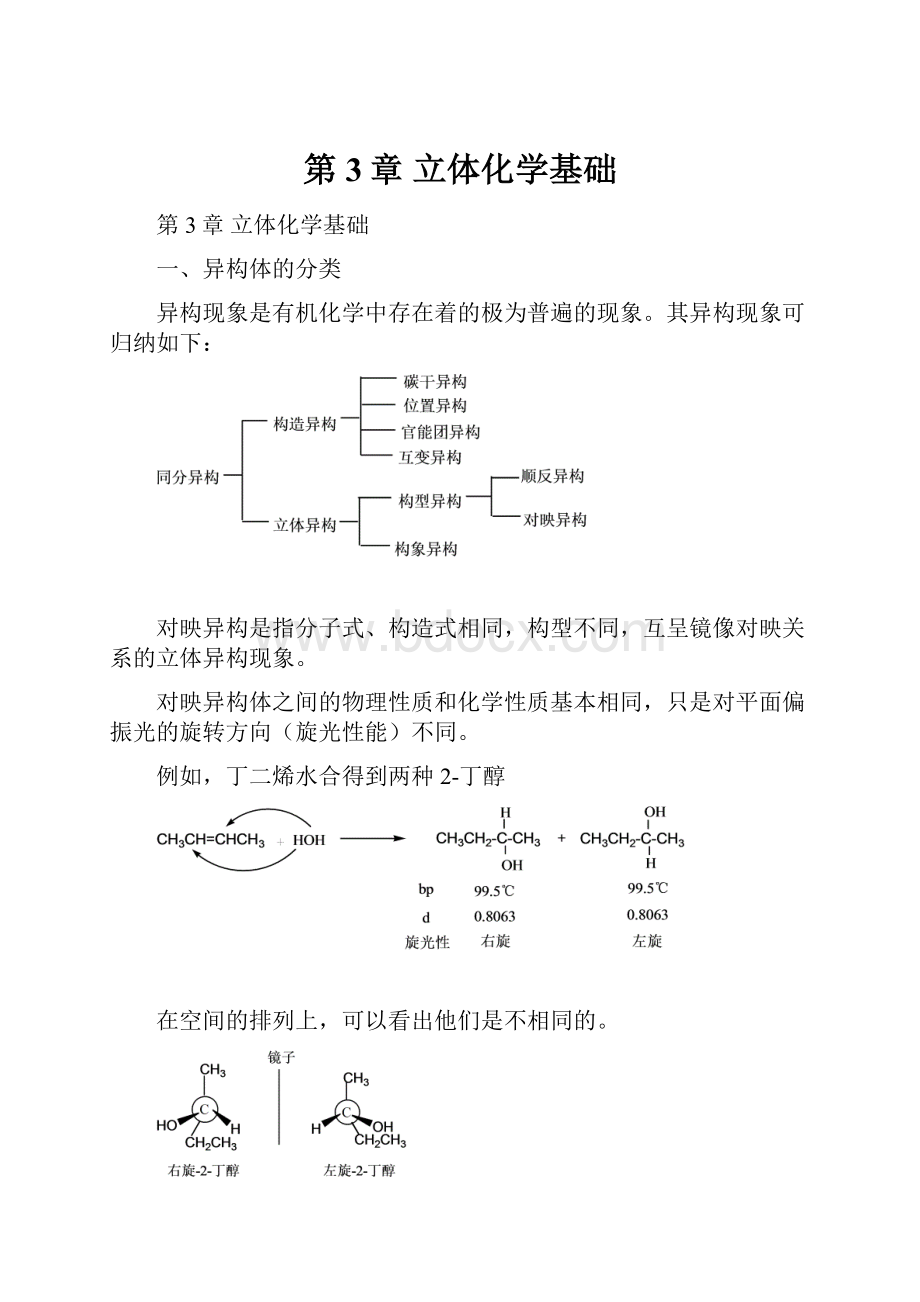
例如,丁二烯水合得到两种2-丁醇
在空间的排列上,可以看出他们是不相同的。
可见,这两个异构体是互相对映的,互为物体与镜像关系,故称为对映异构体。
对映异构体中,一个使偏振光向右旋转,另一个使偏振光向左旋转,所以对映异构体又称为旋光异构。
二、物质的旋光性
(一)平面偏振光和物质的旋光性
1.平面偏振光
光波是一种电磁波,它的振动方向与前进方向垂直。
在光前进的方向上放一个(Nicol)棱晶或人造偏振片,只允许与棱晶晶轴互相平行的平面上振动的光线透过棱晶,而在其它平面上振动的光线则被挡住。
这种只在一个平面上振动的光称为平面偏振光,简称偏振光或偏光。
2.物质的旋光性
能使平面偏振光振动平面旋转的物质称为物质的旋光性,具有旋光性的物质称为旋光性物质(也称为光活性物质)。
能使偏振光振动平面向右旋转的物质称右旋体,能使偏振光振动平面向左旋转的物质称左旋体,使偏振光振动平面旋转的角度称为旋光度,用α表示。
(二)旋光仪与比旋光度
1旋光仪
测定化合物的旋光度是用旋光仪,旋光仪主要部分是有两个尼可尔棱晶(起偏棱晶和检偏棱晶),一个盛液管和一个刻度盘组织装而成。
其测定原理见P120
若盛液管中为旋光性物质,当偏光透过该物质时会使偏光向左或右旋转一定的角度,如要使旋转一定的角度后的偏光能透过检偏镜光栅,则必须将检偏镜旋转一定的角度,目镜处视野才明亮,测其旋转的角度即为该物质的旋光度α。
如下图所示
2比旋光度
旋光性物质的旋光度的大小决定于该物质的分子结构,并与测定时溶液的浓度、盛液的长度、测定温度、所用光源波长等因素有关。
为了比较各种不同旋光性物质的旋光度的大小,一般用比旋光度来表示。
比旋光度与从旋光仪中读到的旋光度关系如下。
当物质溶液的浓度为1g/ml,盛液管的长度为1分米时,所测物质的旋光度即为比旋光度。
若所测物质为纯液体,计算比旋光度时,只要把公式中的C换成液体的密度d即可。
最常用的光源是钠光(D),λ=589.3nm,所测得的旋光度记为
所用溶剂不同也会影响物质的旋光度。
因此在不用水为溶剂时,需注明溶剂的名称,例如,右旋的酒石酸在5%的乙醇中其比旋光度为:
=+3.79(乙醇,5%)。
上面公式即可用来计算物质的比旋光度,也可用以测定物质的浓度或鉴定物质的纯度。
三分子的手性和对称性
(一)映异构现象的发现(略)
(二)性和对称因素
1.手性
以乳酸CH3C*HOHCOOH为例来讨论,乳酸有两种不同构型(空间排列)
特征:
(1)、不能完全重叠,
(2)、呈物体与镜象关系(左右手关系)。
物质分子互为实物和镜象关系(象左手和右手一样)彼此不能完全重叠的特征,称为分子的手性。
具有手性(不能与自身的镜象重叠)的分子叫做手性分子。
连有四个各不相同基团的碳原子称为手性碳原子(或手性中心)用C*表示。
凡是含有一个手性碳原子的有机化合物分子都具有手性,是手性分子。
2分子对称因素
物质分子能否与其镜象完全重叠(是否有手性),可从分子中有无对称因素来判断,最常见的分子对称因素有对称面和对称中心。
(1)、对称面
假设分子中有一平面能把分子切成互为镜象的两半,该平面就是分子的对称面,例如:
具有对称面的分子无手性。
(2)、对称中心
若分子中有一点P,通过P点画任何直线,如果在离P等距离直线两端有相同的原子或基团,则点P称为分子的对称中心。
例如:
有对称中心的分子没有手性。
物质分子在结构上具有对称面或对称中心的,就无手性,因而没有旋光性。
物质分子在结构上即无对称面,也无对称中心的,就具有手性,因而有旋光性。
四、含一个手性碳原子的化合物
(一)对映体
1 对映体——互为物体与镜象关系的立体异构体。
含有一个手性碳原子的化合物一定是手性分子,含有两种不同的构型,是互为物体与镜象关系的立体异构体,称为对映异构体(简称为对映体)。
对映异构体都有旋光性,其中一个是左旋的,一个是右旋的。
所以对映异构体又称为旋光异构体。
2 对映体之间的异同点
(1)、物理性质和化学性质一般都相同,比旋光度的数值相等,仅旋光方向相反P128。
(2)、在手性环境条件下,对映体会表现出某些不同的性质,如反应速度有差异,生理作用的不同等。
(二)外消旋体
等量的左旋体和右旋体的混合物称为外消旋体,一般用(±)来表示。
外消旋体与对映体的比较(以乳酸为例):
旋光性物理性质化学性质生理作用
外消旋体不旋光mp18℃基本相同各自发挥其左右
对映体旋光mp53℃基本相同旋体的生理功能
(三)对映体构型的表示方法
1 构型的表示方法
对映体的构型可用立体结构(楔形式和透视式)和费歇尔(E·Fischer)投影式表示,
(1)、立体结构式
(2)、Fischer投影式
为了便于书写和进行比较,对映体的构型常用费歇尔投影式表示:
投影原则:
①横、竖两条直线的交叉点代表手性碳原子,位于纸平面。
②横线表示与C*相连的两个键指向纸平面的前面,竖线表示指向纸平面的后面。
③将含有碳原子的基团写在竖线上,编号最小的碳原子写在竖线上端。
使用费歇尔投影式应注意的问题:
①基团的位置关系是“横前竖后”
②不能离开纸平面翻转180°;也不能在纸平面上旋转90°或270°与原构型相比。
③将投影式在纸平面上旋转180°,仍为原构型。
2.判断不同投影式是否同一构型的方法:
(1)、将投影式在纸平面上旋转180°,仍为原构型。
(2)、任意固定一个基团不动,依次顺时针或反时针调换另三个基团的位置,不会改变原构型。
(3)、对调任意两个基团的位置,对调偶数次构型不变,对调奇数次则为原构型的对映体。
例如:
五、含多个手性碳原子化合物的对映异构
(一)含两个不同手性碳原子的化合物
这类化合物中两个手性碳原子所连的四个基团不完全相同。
例如:
我们以氯代苹果酸为例来讨论
1.对映异构体的数目
其Fischer投影式如下:
含n个不同手性碳原子的化合物,对映体的数目有2n个,外消旋体的数目2n-1个。
2.非对映体
不呈物体与镜象关系的立体异构体叫做非对映体。
分子中有两个以上手性中心时,就有非对映异构现象。
非对映异构体的特征:
①物理性质不同(熔点、沸点、溶解度等)。
②比旋光度不同。
③旋光方向可能相同也可能不同。
④化学性质相似,但反应速度有差异。
(二)个相同手性碳原子的化合物
酒石酸、2,3-二氯丁烷等分子中含有两个相同的手性碳原子。
同上讨论,酒石酸也可以写出四种对映异构体
(3)、(4)为同一物质,因将(3)在纸平面旋转180°即为(4)。
因此,含两个相同手性碳原子的化合物只有三个立体异构体,少于2n个,外消旋体数目也少于2n-1个。
内消旋体与外消旋体的异同
相同点:
都不旋光
不同点:
内消旋体是一种纯物质,外消旋体是两个对映体的等量混合物,可拆分开来。
从内消旋酒石酸可以看出,含个手性碳原子的化合物,分子不一定是手性的。
故不能说含手性碳原子的分子一定有手性。
六、构型的标记——R、S命名规则
1970年国际上根据IUPAC的建议,构型的命名采用R、S法,这种命名法根据化合物的实际构型或投影式就可命名。
R、S命名规则:
1.按次序规则将手性碳原子上的四个基团排序。
2.把排序最小的基团放在离观察者眼睛最远的位置,观察其余三个基团由大→中→小的顺序,若是顺时针方向,则其构型为R(R是拉丁文Rectus的字头,是右的意思),若是反时针方向,则构型为S(Sinister,左的意思)。
实例:
快速判断Fischer投影式构型的方法:
① 当最小基团位于横线时,若其余三个基团由大→中→小为顺时针方向,则此投影式的构型为S,反之为R。
② 当最小基团位于竖线时,若其余三个基团由大→中→小为反时针方向,则此投影式的构型为R,反之为S。
实例:
含两个以上C*化合物的构型或投影式,也用同样方法对每一个C*进行R、S标记,然后注明各标记的是哪一个手性碳原子。
例如:
七、外消旋体的拆分(略)
八、亲电加成反应的立体化学
烯烃亲电加成反应的历程可通过加成反应的立体化学实验事实来证明,我们以2-丁烯与溴的加成为例进行讨论。
实验:
2-丁烯与溴的加成的立体化学事实说明,加溴的第一步不是形成碳正离子
若是形成碳正离子的话,因碳正离子为平面构型,溴负离子可从平面的两面进攻碳正离子,其产物就不可能完全是外消旋体,也可能得到内消旋体,这与实验事实不符。
用生成溴鎓离子中间体历程可很好的解释上述立体化学事实。
形成的环状结构中间体(溴鎓离子),即阻碍环绕碳碳单键的旋转,同时也限制Br–只能从三元环的反面进攻,又因Br–进攻两个碳原子的机会均等,因此得到的是外消旋体。
反-2-丁烯与溴加成同上讨论,产物为内消旋体。
上述顺-2-丁烯与溴加成主要得到外消旋体产物的反应是有立体选择性的反应。
凡是一个反应能产生几种非对映异构体的可能而主要只产生一种时称为有立体选择性的反应。
其他烯烃与溴的加成都为反式加成,但其立体选择性与反应条件有一定的关联。