高考化学高中化学物质的分类及转化一解题方法和技巧及练习题.docx
《高考化学高中化学物质的分类及转化一解题方法和技巧及练习题.docx》由会员分享,可在线阅读,更多相关《高考化学高中化学物质的分类及转化一解题方法和技巧及练习题.docx(18页珍藏版)》请在冰豆网上搜索。
高考化学高中化学物质的分类及转化一解题方法和技巧及练习题
高考化学高中化学物质的分类及转化
(一)解题方法和技巧及练习题
一、高中化学物质的分类及转化
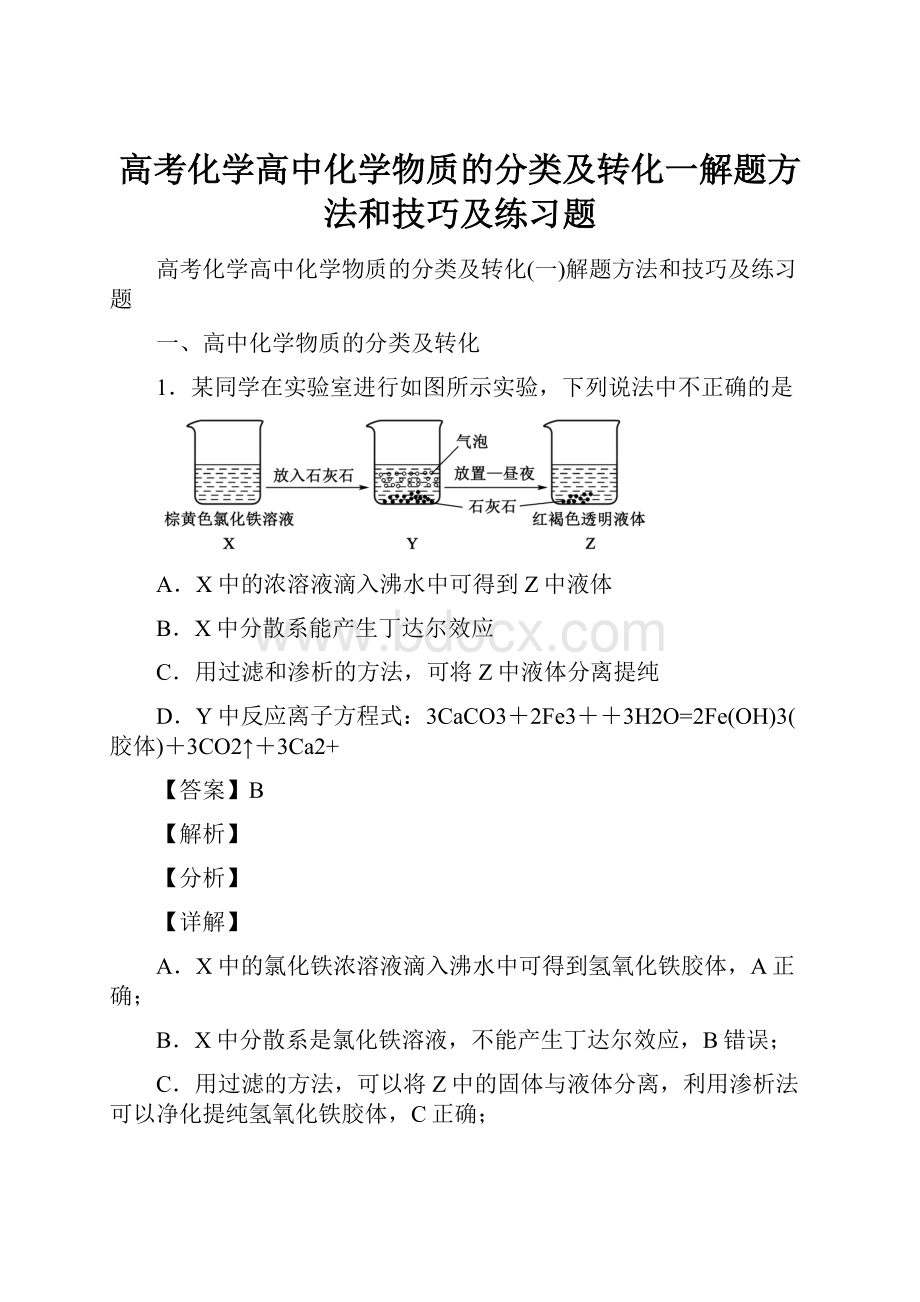
1.某同学在实验室进行如图所示实验,下列说法中不正确的是
A.X中的浓溶液滴入沸水中可得到Z中液体
B.X中分散系能产生丁达尔效应
C.用过滤和渗析的方法,可将Z中液体分离提纯
D.Y中反应离子方程式:
3CaCO3+2Fe3++3H2O=2Fe(OH)3(胶体)+3CO2↑+3Ca2+
【答案】B
【解析】
【分析】
【详解】
A.X中的氯化铁浓溶液滴入沸水中可得到氢氧化铁胶体,A正确;
B.X中分散系是氯化铁溶液,不能产生丁达尔效应,B错误;
C.用过滤的方法,可以将Z中的固体与液体分离,利用渗析法可以净化提纯氢氧化铁胶体,C正确;
D.CaCO3能与H+结合生成CO2和H2O,促进Fe3+的水解,D正确;
答案选B。
2.下列关于胶体的说法不正确的是( )
A.直径为1.3×10﹣9m的“钴酞菁”分子分散在水中能形成胶体,则该分子的直径比Na+大
B.煮沸饱和FeCl3溶液可以制得Fe(OH)3胶体
C.丁达尔现象可以用来区别胶体和溶液
D.明矾净水利用了胶体的性质
【答案】B
【解析】
【分析】
【详解】
A.直径为1.3×10﹣9m的“钴酞菁”分子处于胶体粒子的范围,分散在水中形成胶体,Na+溶液分散系粒子直径小于1nm,即钴酞菁”分子的直径比Na+大,A正确;
B.制得Fe(OH)3胶体为向沸水中滴加5-6滴FeCl3饱和溶液,不是加热饱和FeCl3溶液,B错误;
C.丁达尔现象是胶体的特征现象,会产生一条明亮的光路,能与溶液进行区分,C正确;
D.明矾净水是铝离子水解产生了氢氧化铝胶体,利用了胶体的聚沉的性质,D正确;
答案为B。
【点睛】
本题易错点为B,煮沸饱和氯化铁溶液易得到氢氧化铁沉淀,而不是胶体。
3.在给定条件下,下列选项所示的物质间转化均能实现的是
A.CaCl2(aq)
CaCO3
CaO
B.Na
Na2O
NaOH
C.(C6H10O5)n(淀粉)
C6H12O6(葡萄糖)
C2H5OH
D.Cu2S
Cu
CuSO4
【答案】C
【解析】
【详解】
A.二氧化碳与氯化钙溶液不反应,碳酸钙受热分解生成氧化钙和二氧化碳,其中第一步不能实现转化,选项A错误;
B.钠在氧气中点燃反应生成过氧化钠而不是生成氧化钠,氧化钠与水反应生成氢氧化钠,其中第一步不能实现转化,选项B错误;
C.淀粉在稀硫酸催化下水解最终生成葡萄糖,葡萄糖在酒化酶的催化下反应生成乙醇和二氧化碳,两步转化均能实现,选项C正确;
D.高温条件下硫化亚铜与氧气反应生成铜和二氧化硫(火法炼铜),铜与稀硫酸不反应无法得到硫酸铜,第一步转化不能实现,选项D错误;
答案选C。
4.下面的“诗”情“化”意,分析正确的是()
A.“粉身碎骨浑不怕,要留清白在人间”只发生了物理变化
B.“日照澄洲江雾开”中伴有丁达尔效应
C.“试玉要烧三日满,辨材须待七年期”中“玉”的成分是硅酸盐,该句诗表明玉的硬度很大
D.“绿蚁新醅酒,红泥小火炉”,“新醅酒”即新酿的酒,在酿酒过程中,葡萄糖发生了水解反应
【答案】B
【解析】
【分析】
A.有新物质生成的变化是化学变化;
B.雾属于胶体,胶体能产生丁达尔效应;
C.“玉”的成分是硅酸盐,熔点很高;
D.葡萄糖是单糖不能发生水解反应。
【详解】
A.“粉身碎骨浑不怕,要留清白在人间”是碳酸钙的分解反应,反应中有新物质生成,是化学变化,故A错误;
B.“日照澄州江雾开”中,雾属于胶体,胶体能产生丁达尔效应,故B正确;
C.“玉”的成分是硅酸盐,熔点很高,‘试玉要烧三日满’与硬度无关,故C错误;
D.葡萄糖是单糖不能发生水解反应,在酿酒过程中葡萄糖转化为酒精不是水解反应,故D错误。
故选B。
5.下列判断合理的是()
①硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
③根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④根据分散系是否具有丁达尔效应将分散系分为溶液、胶体和浊液
⑤根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
⑥根据Na2O、Na2O2组成元素相同,均与H2O反应,故均属于碱性氧化物
A.②⑥B.②⑤C.①②⑤⑥D.②③④⑤
【答案】B
【解析】
【分析】
【详解】
①纯碱为碳酸钠,属于盐类,故①错误;
②蔗糖在水溶液中和熔融状态均不导电,属于非电解质,硫酸钡熔融状态能完全电离,属于强电解质,水不完全电离,属于弱电解质,故②正确;
③根据电解质在熔融状态下或水溶液中能否完全电离将电解质分为强电解质和弱电解质,故③错误;
④根据分散质粒子直径的大小将分散系分为溶液、胶体和浊液,故④错误;
⑤有电子转移的化学反应为氧化还原反应,没有电子转移的化学反应为非氧化还原反应,故⑤正确;
⑥碱性氧化物为能跟酸发生反应只生成盐和水,而Na2O2与酸发生反应还生成氧气,则过氧化钠不是碱性氧化物,故⑥错误;
综上所述,正确的为②⑤,答案为B。
6.下列物质的组成中一定含有氧元素的是
①水②酸③碱④盐⑤氧化物
A.①B.①⑤C.①③⑤D.①②③④⑤
【答案】C
【解析】
【分析】
【详解】
①水的分子式为H2O,含有氧元素,所以正确;
②酸分为无氧酸(如盐酸)和含氧酸(如碳酸),前者不含氧元素,后者含有氧元素,所以错误;
③碱除氨水(NH3•H2O)外,一般在组成上都含氢氧根,故一定含氧元素,所以正确;
④盐分为无氧酸盐(如氯化钠)和含氧酸盐(如碳酸钠),前者不含氧元素,后者含有氧元素,所以错误;
⑤氧化物是指由两种元素组成的且其中一种是氧元素的化合物,故一定含氧元素,所以正确;
答案选C。
【点睛】
本题考查了物质的分类知识,透彻理解有关概念,明确物质的分类组成,明确概念间的相互关系是解题的关键,易错点为③根据碱指电离出的阴离子全部是氢氧根离子的化合物来判断。
7.近年来,我国大力弘扬中华优秀传统文化,体现了中华民族的“文化自信”。
下列有关说法错误的是( )
A.成语“百炼成钢”“蜡炬成灰”中均包含了化学变化
B.诗句“折戟沉沙铁未销”中的金属在常温下能溶于浓硝酸
C.谚语“雷雨肥庄稼”,其过程中包含了氧化还原反应
D.制备“陶冶新平肇汉唐,宋明瓷夺宝珠光”中的瓷,主要原料为黏土
【答案】B
【解析】
【分析】
【详解】
A.百炼成钢包含碳和氧气反应生成二氧化碳的变化,蜡炬成灰包含蜡烛燃烧生成二氧化碳和水,都包含化学变化,故A正确;
B.诗句“折戟沉沙铁未销”中的金属为铁,常温下铁在浓硝酸中钝化不能溶解,故B错误;
C.雷雨肥田是指氮气和氧气放电生成一氧化氮,一氧化氮被氧气氧化为二氧化氮,二氧化氮溶于水反应生成硝酸,硝酸在土壤中形成铵盐被吸收;反应的化学方程式为:
N2+O2
2NO,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO属于氧化还原反应,故C正确;
D.瓷器是利用黏土高温煅烧制得,制备“陶冶新平肇汉唐,宋明瓷夺宝珠光”中的瓷,主要原料为黏土,故D正确;
综上所述,答案为B。
8.以铁作阳极,利用电解原理可使废水中的污染物凝聚而分离,其工作原理如图所示。
下列说法错误的是()
A.电极b为阴极
B.a极的电极反应式:
Fe-2e-=Fe2+
C.处理废水时,溶液中可能发生反应:
4Fe2++O2+8OH-+2H2O=4Fe(OH)3
D.电路中每转移3mol电子,生成1molFe(OH)3胶粒
【答案】D
【解析】
【分析】
根据图示可知,铁做阳极,失电子,发生氧化反应,Fe-2e-=Fe2+,所以a为阳极,b电极为阴极,发生还原反应,2H2O+2e-=H2+2OH-。
【详解】
A.根据图示a电极为Fe电极,连接电源正极,作阳极,失去电子,发生氧化反应,b电极连接电源负极,作阴极,A正确;
B.由图示可知:
a电极为Fe电极,失去电子,发生氧化反应,阳极的电极反应式为Fe-2e-=Fe2+,B正确;
C.Fe2+具有还原性,容易被溶解在溶液的氧气氧化变为Fe3+,氧气得到电子变为OH-,Fe3+与OH-结合形成Fe(OH)3,根据电子守恒、电荷守恒及原子守恒,在处理废水时,溶液中可能发生的反应为:
4Fe2++O2+8OH-+2H2O=4Fe(OH)3,C正确;
D.Fe(OH)3胶粒是许多Fe(OH)3的集合体,所以电路中每转移3mol电子,生成Fe(OH)3胶粒的物质的量小于1mol,D错误;
故合理选项是D。
9.2019年10月9日,瑞典皇家科学院宣布,将2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·惠廷厄姆和吉野彰,以表彰他们在锂离子电池研发领域作出的贡献。
磷酸铁锂(LiFePO4)是一种锂电池高效正极材料。
它属于
A.酸B.碱C.盐D.单质
【答案】C
【解析】
【详解】
磷酸铁锂(LiFePO4)是有金属阳离子和酸根离子组成,所以是盐,
故选:
C。
10.下列说法正确的是
A.盐酸、烧碱、食盐和水分别属于酸、碱、盐和氧化物
B.碳酸钙、水和乙醇分别属于强电解质、弱电解质和非电解质
C.强弱电解质的判断依据是其水溶液的导电性的强弱
D.在复分解反应中,强酸一定可以与弱酸盐反应制取弱酸
【答案】B
【解析】
【分析】
【详解】
A.盐酸是混合物,而酸属于纯净物的范畴,故A错误;
B.碳酸钙是盐属于强电解质,水是氧化物属于弱电解质,乙醇是有机物属于非电解质,故B正确;
C.判断强弱电解质的依据是看其在水中的电离程度,不是导电性大小,故C错误;
D.在复分解反应中,硫酸与硫化铜不能反应制硫化氢,因为硫化铜是难溶于酸的固体,故D错误;
故选B。
【点睛】
根据电解质和非电解质的所属物质类别进行判断,绝大多数盐属于电解质,部分氧化物属于电解质,大多数有机物属于非电解质;根据电解质的电离程度区别强电解质和弱电解质。
11.在给定条件下,下列选项所示的物质间转化均能实现的是
A.H2SiO3
SiO2
SiCl4
B.Cu
Cu(NO3)2(aq)
Cu(NO3)2(s)
C.ClCH2-CH2Cl
HOCH2CH2OH
HOOC-COOH
D.Al
Al2O3
NaAlO2(aq)
【答案】D
【解析】
【分析】
【详解】
A.盐酸不能直接和二氧化硅反应得到四氯化硅,故A错误;
B.硝酸铜溶液加热蒸发由于水解不能得到硝酸铜固体,故B错误;
C.不能将醇通过新制氢氧化铜悬浊液一步氧化成酸,故C错误;
D.Al
Al2O3
NaAlO2(aq),均可实现,故D正确;
故答案选:
D。
12.化学与生活密切相关,下列说法正确的是
A.酿酒工艺中加入的“酒曲”与面包工艺中加入的“发酵粉”作用相同
B.氨水显碱性,不能与金属反应,所以运输过程中可以用铁罐车
C.葡萄酒中通常添加微量的SO2,既可以杀菌消毒,又可以防止营养成分被氧化
D.大多数胶体的胶粒带电,利用这一性质可进行“血液透析”和“静电除尘”
【答案】C
【解析】
【详解】
A、酒曲与发酵粉的作用不同:
在经过强烈蒸煮的白米中,移入曲霉的分生孢子,然后保温,米粒上便会茂盛地生长出菌丝,此即酒曲;酿酒加曲,是因为酒曲上生长有大量的微生物,以及微生物分泌的酶,其中糖分经过部分酶的作用酒化变为乙醇;而发酵粉的主要成分是NaHCO3,面包工艺中加入发酵粉是为了中和微生物产生的酸,同时生成的CO2气体可以是面团变为多孔,显得松软可口;A错误;
B、一般情况下,氨水不会与金属反应,但是氨水呈弱碱性,若用铁罐车运输,会加快铁罐的腐蚀速率(吸氧腐蚀),B错误;
C、在葡萄酒的生产过程中,SO2的作用是对生产设备消毒杀菌,还可以杀死酿造完的葡萄酒中的酵母,保证葡萄酒的稳定,最后装瓶也会填入少量SO2,保证葡萄酒不被氧化和生物稳定,C正确;
D、血液是一种胶体,利用渗析的原理可以除去血液中的毒性小分子物质,而血液中的必要成分不能通过透析膜,与胶粒是否带电无关,D错误;
故选C。
13.现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
甲同学:
向1mol·L-1的FeCl3溶液中加少量NaOH溶液。
乙同学:
直接加热饱和FeCl3溶液。
丙同学:
向25mL沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
试回答下列问题:
(1)其中操作正确的同学是_____________。
(2)证明有Fe(OH)3胶体生成的实验操作是_________。
利用的胶体性质是__________。
(3)在胶体中加入电解质溶液或带有相反电荷的胶体粒子能使胶体粒子沉淀出来。
丁同学利用所制得的Fe(OH)3胶体进行实验:
①将其装入U形管内,用石墨作电极,通电一段时间后发现阴极区附近的颜色逐渐变深,这表明Fe(OH)3胶体粒子带______(填“正”或“负”)电荷。
②向其中加入饱和Na2SO4溶液,产生的现象是_____________。
【答案】丙用一束光照射得到的液体,从侧面观察能否看到一条光亮的“通路”丁达尔效应正有红褐色沉淀生成
【解析】
【分析】
【详解】
(1)实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,故答案为丙;
(2)胶体具有丁达尔效应,当用激光笔照射时,会有一道明亮的光路,故答案为使一束光射向烧杯中的液体,若能产生丁达尔效应,则证明生成了氢氧化铁胶体;
(3))①Fe(OH) 3胶粒带正电,通电时带正电荷的粒子向阴极移动,阴极附的颜色逐渐变深,故答案为正;
②向其中加入Na 2SO 4,电离出的SO 42-使Fe(OH) 3胶体发生聚沉,生成红褐色沉淀,故答案为产生红褐色沉淀。
14.乙醛能与银氨溶液反应析出银,如果条件控制适当,析出的银会均匀分布在试管上,形成光亮的银镜,这个反应叫银镜反应。
某实验小组对银镜反应产生兴趣,进行了以下实验。
(1)配制银氨溶液时,随着硝酸银溶液滴加到氨水中,观察到先产生灰白色沉淀,而后沉淀消失,形成无色透明的溶液。
该过程可能发生的反应有_________
A.AgNO3+NH3·H2O=AgOH↓+NH4NO3B.AgOH+2NH3·H2O=Ag(NH3)2OH+2H2O
C.2AgOH=Ag2O+H2OD.Ag2O+4NH3·H2O=Ag(NH3)2OH+3H2O
(2)该小组探究乙醛发生银镜反应的最佳条件,部分实验数据如表:
实验
序号
银氨溶液/mL
乙醛的量/滴
水浴温度/℃
反应混合液的pH
出现银镜时间
1
1
3
65
11
5
2
1
3
45
11
6.5
3
1
5
65
11
4
4
1
3
50
11
6
请回答下列问题:
①推测当银氨溶液的量为1mL,乙醛的量为3滴,水浴温度为60℃,反应混合液pH为11时,出现银镜的时间范围是____________________。
②进一步实验还可探索_______________对出现银镜快慢的影响(写一条即可)。
(3)该小组查阅资料发现强碱条件下,加热银氨溶液也可以析出银镜,并做了以下两组实验进行分析证明。
已知:
Ag(NH3)2++2H2O
Ag++2NH3·H2O。
装置
实验序号
试管中的药品
现象
实验Ⅰ
2mL银氨溶液和数滴较浓NaOH溶液
有气泡产生,一段时间后,溶液逐渐变黑,试管壁附着银镜
实验Ⅱ
2mL银氨溶液和数滴浓氨水
有气泡产生,一段时间后,溶液无明显变化
①两组实验产生的气体相同,该气体化学式为____________,检验该气体可用____________试纸。
②实验Ⅰ的黑色固体中有Ag2O,产生Ag2O的原因是____________。
(4)该小组同学在清洗试管上的银镜时,发现用FeCl3溶液清洗的效果优于Fe2(SO4)3溶液,推测可能的原因是____________,实验室中,我们常选用稀HNO3清洗试管上的银镜,写出Ag与稀HNO3反应的化学方程式____________。
【答案】ABCD5~6min银氨溶液的用量不同或pH不同NH3湿润的红色石蕊在NaOH存在下,加热促进NH3·H2O的分解,逸出NH3,促使Ag(NH3)2++2H2O
Ag++2NH3·H2O平衡正向移动,c(Ag+)增大,Ag+、OH-反应产生的AgOH立即转化为Ag2O:
Ag++2OH-=Ag2O↓+H2O产物AgCl的溶解度小于Ag2SO43Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O
【解析】
【分析】
(1)灰白色沉淀含有AgOH和Ag2O,最后为澄清溶液,说明这两种物质均溶于浓氨水;
(2)①由实验1和实验4知在5~6min之间;②根据表格数据,采用控制变量法分析;
(3)根据物质的成分及性质,结合平衡移动原理分析产生的气体和Ag2O的原因;
(4)FeCl3和Fe2(SO4)3的阳离子相同,因此从阴离子的角度考虑。
氯化银的溶解度小于硫酸银,从沉淀溶解平衡分析。
【详解】
(1)向氨水中滴加硝酸银溶液,首先发生复分解反应:
AgNO3+NH3·H2O=AgOH↓+NH4NO3,AgOH能够被氨水溶解,会发生反应AgOH+2NH3·H2O=Ag(NH3)2OH+2H2O;反应产生的AgOH不稳定,会发生分解反应:
2AgOH=Ag2O+H2O,分解产生的Ag2O也会被氨水溶解得到氢氧化二氨合银,反应方程式为:
Ag2O+4NH3·H2O=Ag(NH3)2OH+3H2O,故合理选项是ABCD;
(2)①当银氨溶液的量为1mL,乙醛的量为3滴,水浴温度为60℃,反应混合液pH为11时,由实验1和实验4可知出现银镜的时间范围是在5~6min之间;
②根据实验1、2可知,反应温度不同,出现银镜时间不同;根据实验1、3可知:
乙醛的用量不同,出现银镜时间不同;在其他条件相同时,溶液的pH不同,出现银镜时间也会不同,故还可以探索反应物的用量或溶液pH对出现银镜快慢的影响;
(3)①在银氨溶液中含有Ag(NH3)2OH,该物质在溶液中存在平衡:
Ag(NH3)2++2H2O
Ag++2NH3·H2O,NH3+H2O
NH3·H2O
NH4++OH-,加热并加入碱溶液时,电离平衡逆向移动,一水合氨分解产生氨气,故该气体化学式为NH3,可根据氨气的水溶液显碱性,用湿润的红色石蕊检验,若试纸变为蓝色,证明产生了氨气;
②生成Ag2O的原因是:
在NaOH存在下,加热促进NH3·H2O的分解,逸出NH3促使Ag(NH3)2++2H2O
Ag++2NH3·H2O平衡正向移动,c(Ag+)增大,Ag+、OH-反应产生的AgOH立即转化为Ag2O:
Ag++2OH-=Ag2O↓+H2O;
(4)FeCl3和Fe2(SO4)3的阳离子都是Fe3+,阴离子不同,而在清洗试管上的银镜时,发现用FeCl3溶液清洗的效果优于Fe2(SO4)3溶液,这是由于Cl-与Ag+结合形成的AgCl是难溶性的物质,而SO42-与Ag+结合形成的Ag2SO4微溶于水,物质的溶解度:
Ag2SO4>AgCl,物质的溶解度越小,越容易形成该物质,使银单质更容易溶解而洗去,因此使用FeCl3比Fe2(SO4)3清洗效果更好。
【点睛】
本题考查了物质性质实验的探究,明确物质的性质和实验原理是本题解答的关键,注意要采用对比方法,根据控制变量法对图表数据不同点进行分析,知道银氨溶液制备方法,侧重考查学生实验能力、分析问题、总结归纳能力。
15.A~N均为中学化学中的常见物质,其中A是日常生活中不可缺少的物质,也是化工生产中的重要原料,单质M是目前使用量最大的金属,常温下B、E、F为气体,G为无色液体,这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。
回答下列问题:
(1)H的化学式为_______________,D的电子式为_____________。
(2)工业上用A制取N反应的化学方程式为:
____________________。
(3)I的饱和溶液滴入沸水中反应的离子方程式为:
_____________________。
(4)G与M反应的化学方程式为____________________________。
【答案】Fe3O4
2NaCl+2H2O
Cl2↑+H2↑+2NaOHFe3++3H2O
Fe(OH)3(胶体)+3H+3Fe+4H2O(g)
Fe3O4+4H2
【解析】
【分析】
单质M是目前使用量最大的金属,则M为Fe;气体单质B与Fe反应生成I,I能与Fe反应生成K,K被B氧化得到I,而I中Fe为+3价,可推知B具有强氧化性,则B为Cl2,I为FeCl3,K为FeCl2;A是日常生活中不可缺少的物质,也是化工生产上的重要原料,电解熔融的A得到B与C,因此A为NaCl、C为Na;G为无色液体,与钠反应得到气体E,C在气体F中点燃生成D,D与G反应得到气体F与N,可推知G为H2O,E为H2、F为O2,D为Na2O2,N为NaOH,由转化关系可知,H为Fe3O4,J为HCl,以此解答该题。
【详解】
根据上述分析可知:
A为NaCl,B为Cl2,C为Na,D为Na2O2,E为H2、F为O2,G为H2O,H为Fe3O4,I为FeCl3,J为HCl,K为FeCl2,M是Fe,N是N为NaOH。
(1)根据上述分析可知H的化学式为Fe3O4,D为Na2O2,该物质是离子化合物,Na+与O22-之间通过离子键结合,O22-中2个O原子之间通过共价键结合,因此Na2O2的电子式为
。
(2)在业上用电解饱和NaCl溶液的方法制取NaOH,该反应的化学方程式为:
2NaCl+2H2O
Cl2↑+H2↑+2NaOH。
(3)在实验室中一般是将FeCl3的饱和溶液滴入沸水中来制取Fe(OH)3胶体,该反应的离子方程式为:
Fe3++3H2O
Fe(OH)3(胶体)+3H+。
(4)Fe与水蒸气在高温下反应产生Fe3O4和氢气,则G与M反应的化学方程式为:
3Fe+4H2O(g)
Fe3O4+4H2。