物理化学框架结构12.docx
《物理化学框架结构12.docx》由会员分享,可在线阅读,更多相关《物理化学框架结构12.docx(32页珍藏版)》请在冰豆网上搜索。
物理化学框架结构12
《物理化学学习要点》
热力学第一定律
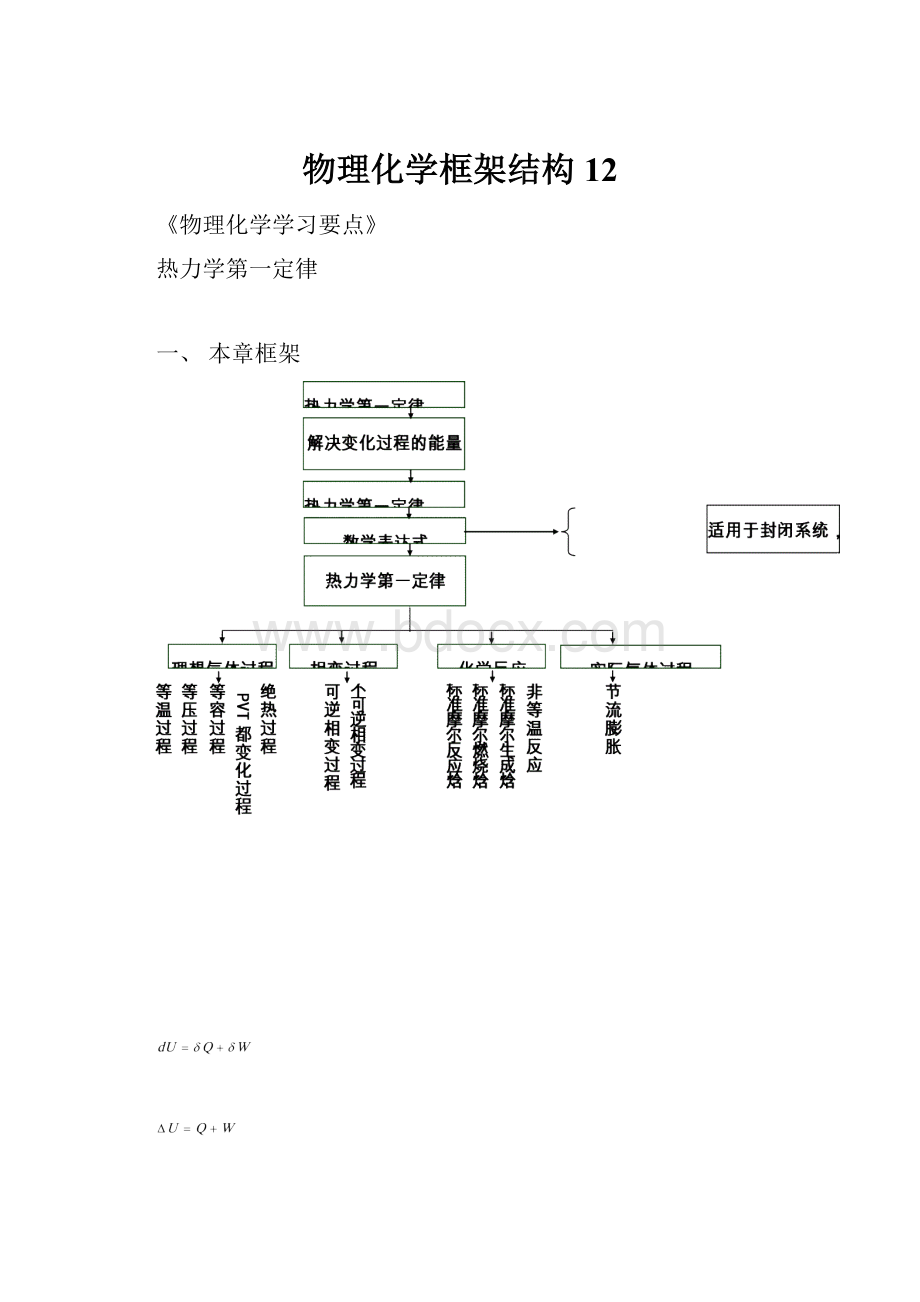
一、本章框架
二、本章要求
1、了解热力学基本概念:
系统、环境、功、热、平衡状态、状态函数、可逆过程等;
2、明确热力学第一定律和热力学能的概念;
3、明确焓、标准摩尔反应焓、标准摩尔生成焓和燃烧焓的定义;
4、熟练掌握在理想气体单纯PVT变化、相变化及化学变化过程中计算热、功、△U、△H的原理和方法;
三、考核要求:
1.热力学概论
1.1热力学的目的、内容和方法(了解)
1.2热力学的一些基本概念
1.2.1体系与环境,体系的性质(理解)
1.2.2 热力学平衡态和状态函数(理解)
2.热力学第一定律
2.1热和功(掌握)
2.2热力学能(掌握)
2.3热力学第一定律的表述与数学表达式(应用)
3.体积功与可逆过程
3.1等温过程的体积功(应用)
3.2可逆过程与最大功(理解)
4.焓与热容
4.1焓的定义(了解)
4.2焓变与等压热的关系(应用)
4.3等压热容和等容热容(理解)
5.热力学第一定律对理想气体的应用
5.1理想气体的热力学能和焓(掌握)
5.2理想气体的Cp与Cv之差(理解)
5.3理想气体的绝热过程 (掌握)
6.热力学第一定律对实际气体的应用
6.1节流膨胀与焦耳-汤姆逊效应(了解)
7.热力学第一定律对相变过程的应用(掌握)
8.化学热力学
8.1化学反应热效应
8.1.1等压热效应与等容热效应(掌握)
8.1.2反应进度(了解)
8.2赫斯定律与常温下反应热效应的计算
8.2.1赫斯定律(应用)
8.2.2标准摩尔生成焓与标准摩尔燃烧焓 (掌握)
8.3标准反应焓变与温度的关系—基尔霍夫定律(应用)
四、重要概念
1、系统与环境;
2、隔离系统、封闭系统、敞开系统;
注意:
隔离系统Q=0,W=0
3、广延性质(加和性:
V,U,H,S,A,G)
强度性质(摩尔量,T,p);
4、功W和热Q;
注意W与Q的符号;W与Q均为途径函数
5、热力学能;
6、焓;
7、热容;
8、状态与状态函数;
9、平衡态;
10、 可逆过程;
11、节流过程;
12、真空膨胀过程;
13、标准态;
14、标准摩尔反应焓,标准摩尔生成焓,标准摩尔燃烧焓
五、重要公式与适用条件
1.体积功:
W=-p外dV(封闭系统,计算体积功)
2.热力学第一定律:
∆U=Q+W,dU=Q+W(封闭系统,非体积功为零)
3.焓的定义:
H=U+pV
4.热容:
定容摩尔热容CV,m=QV/dT=(Um/T)V
定压摩尔热容Cp,m=Qp/dT=(Hm/T)P
理性气体:
Cp,m-CV,m=R;
凝聚态:
Cp,m-CV,m≈0
理想单原子气体CV,m=3R/2,Cp,m=CV,m+R=5R/2
5.标准摩尔反应焓:
由标准摩尔生成焓∆fHBθ(T)或标准摩尔燃烧焓∆cHBθ(T)计算
∆rHmθ=∑vB∆fHBθ(T)=-∑vB∆cHBθ(T)
6.基希霍夫公式(适用于相变和化学反应过程)
∆rHmθ(T2)=∆rHmθ(T1)+
7.等压摩尔反应热与等容摩尔反应热的关系式
Qp-QV=∆rHm(T)-∆rUm(T)=∑vB(g)RT
8.理想气体的可逆绝热过程方程:
六、各种过程Q、W、∆U、∆H的计算
1、理想气体:
等温过程dT=0,∆U=∆H=0,Q=W;
非等温过程,∆U=nCV,m∆T,∆H=nCp,m∆T,
单原子气体CV,m=3R/2,Cp,m=CV,m+R=5R/2
2、对于凝聚相,状态函数通常近似认为与温度有关,而与压力或体积无关,即
∆U≈∆H=nCp,m∆T
3.等压过程:
p外=p=常数,非体积功为零W'=0
(1)W=-p外(V2-V1),∆H=Qp=
,∆U=∆H-∆(pV),Q=∆U-W
(2)真空膨胀过程p外=0,W=0,Q=∆U
理想气体结果:
dT=0,W=0,Q=∆U=0,∆H=0
(3)等外压过程:
W=-p外(V2-V1)
Example1:
1mol理想气体于27℃、101325Pa状态下受某恒定外压恒温压缩到平衡,再由该状态恒容升温到97℃,则压力升到1013.25kPa。
求整个过程的W、Q、∆U及∆H。
已知该气体的CV,m恒定为20.92J.mol-1.K-1。
解题思路:
需先利用理想气体状态方程计算有关状态:
(T1=27℃,p1=101325Pa,V1)→(T2=27℃,p2=p外=?
,V2=?
)→(T3=97℃,p3=1013.25kPa,V3=V2)
首先计算功W,然后计算∆U,再计算Q,∆H。
4.等容过程:
dV=0
W=0,QV=∆U=
,∆H=∆U+V∆p
5.绝热过程:
Q=0
(1)绝热可逆过程W=
=∆U=
,∆H=∆U+∆pV
理想气体:
(2)绝热一般过程:
由方程W
=∆U=
建立方程求解。
6.节流过程(等焓过程):
∆H=0,Q=0
焦耳-汤姆逊系数μJ-T=(T/p)H,理想气体μJ-T=0,实际气体μJ-T≠0
7.相变过程:
(1)可逆相变(正常相变或平衡相变):
在温度T对应的饱和蒸气压下的相变,如水在常压下的0℃结冰或冰溶解。
TheEnd!
《物理化学学习要点》
热力学第二定律
一、本章框架
二、本章要求
1.了解自发过程的共同特征;
2.理解第二、第三定律的表述;
3.了解卡诺循环的意义;
4.理解克劳修斯不等式;
5.掌握熵增原理和平衡判据的一般准则;
6.明确熵、赫姆霍兹函数、吉布斯函数、标准摩尔熵及标准摩尔生成吉布斯自由能的定义并会应用;
7.熟练掌握在理想气体单纯PVT变化、相变及化学变化过程中计算△S、△A、△G的原理和方法;
8.理解热力学基本方程;
9.掌握推导热力学公式的演绎方法;
10.了解麦克斯韦关系式的推导及应用;
三、重要概念
1.卡诺循环
2.热机效率
3.熵
4.亥姆霍兹函数
5.吉布斯函数
四、主要公式与定义式
1.热机效率:
η=-W/Q1=(Q1+Q2)/Q1=1-T2/T1
2.卡诺定理:
任何循环的热温熵小于或等于0
Q1/T1+Q2/T2≤0
3.熵的定义式:
dS=Qr/T
4.亥姆霍兹(Helmholtz)函数的定义式:
A=U-TS
5.吉布斯(Gibbs)函数的定义式:
G=H-TS,G=A+pV
6.热力学第三定律:
S*(0K,完美晶体)=0
7.过程方向的判据:
(1)等温等压不做非体积功过程(最常用):
dG<0,自发(不可逆);dG=0,平衡(可逆)。
(2)一般过程用熵判据:
∆S(隔离系统)>0,自发(不可逆);
∆S(隔离系统)=0,平衡(可逆)。
∆S(绝热系统)>0,自发(不可逆);
∆S(绝热系统)=0,平衡(可逆)。
(3)等温等容不做非体积功过程:
dA<0,自发(不可逆);dA=0,平衡(可逆)。
8.热力学基本方程与麦克斯韦关系式
基本式:
dU=TdS-pdV
其他式:
dH=d(U+pV)=TdS+Vdp
dA=d(U-TS)=-SdT–pdV
dG=d(H-TS)=-SdT+Vdp
在上系列式,应重点掌握dG=-SdT+Vdp
在恒压下的关系式dG=-SdT和恒温时的关系式dG=-Vdp。
麦克斯韦关系式(了解):
若dF=Mdx+Ndy,则(M/y)x=(N/x)y
即:
利用dU=TdS-pdV关系有:
-(T/V)S=(p/S)V
dH=TdS+Vdp关系有:
(T/p)S=(V/S)p
dA=-SdT-pdV关系有:
(S/V)T=(p/T)V
dG=-SdT+Vdp关系有:
-(S/p)T=(V/T)p
五、∆S、∆A、∆G的计算
1.∆S的计算
(1)理想气体pVT过程的计算
dS=Qr/T=(dU-Wr)/T=(nCV,mdT-pdV)/T
(状态函数与路径无关,理想气体:
p=nRT/V)
积分结果:
∆S=nCV,mln(T2/T1)+nRln(V2/V1)(代入:
V=nRT/p)
=nCp,mln(T2/T1)+nRln(p1/p2)(Cp,m=CV,m+R)
特例:
等温过程:
∆S=nRln(V2/V1)
等容过程:
∆S=nCV,mln(T2/T1)
等压过程:
∆S=nCp,mln(T2/T1)
(2)等容过程:
∆S=
(nCV,m/T)dT
(3)等压过程:
∆S=
(4)相变过程:
可逆相变∆S=∆H/T
(5)环境过程:
认为是恒温的大热源,过程为可逆
∆S=Qr(环)/T(环)=-Q(系)/T(环)
(6)绝对熵的计算:
利用热力学第三定律计算的熵为绝对熵,过程通常涉及多个相变过程,是一个综合计算过程。
(7)标准摩尔反应熵的计算
∆rSmθ=∑vBSmθ(B,T)
2.∆G的计算
(1)平衡相变过程:
∆G=0
(2)等温过程:
∆G=∆H-T∆S
(3)非等温过程:
∆G=∆H-∆TS=∆H-(T2S2-T1S1)=∆H-(T2∆S-S1∆T)
诀窍:
题目若要计算∆G,一般是恒温过程;若不是恒温,题目必然会给出绝对熵。
3.∆A的计算
(1)恒温恒容不做非体积功可逆过程:
∆A=0
(2)恒温:
∆A=∆U-T∆S=∆G-∆(pV)
(3)非恒温过程:
∆G=∆U-∆TS=∆U-(T2S2-T1S1)=∆U-(T2∆S-S1∆T)
诀窍:
题目若要计算∆A,一般是恒温过程;若不是恒温,题目必然会给出绝对熵。
TheEnd!
《物理化学学习要点》
化学势
一、 本章框架
二、本章要求
1、掌握组成表示法及其相互关系;
2、掌握拉乌尔定律和亨利定律并会用于计算;
3、理解偏摩尔量及化学势的含义及意义;
4、掌握有关依数性的计算;
5、了解理想气体混合物、理想液态混合物、理想稀溶液中各组分化学势的表达式、逸度和活度的标准态及对组分活度系数的简单计算。
三、重要概念
1、组成表示:
物质B的摩尔分数xB、质量分数wB、(物质的量)浓度cB、质量摩尔浓度bB.
注意:
混合物(各组分标准态相同)与溶液(分溶剂和溶质,标准态不同);
2、拉乌尔定律和亨利定律;
3、偏摩尔量与化学势;
4、理想液态混合物;
5、理想稀溶液;
6、非理想溶液混合物;
7、逸度和逸度系数;
8、活度和活度系数;
9、稀溶液的依数性。
四、重要定理与公式
1.拉乌尔定律:
稀溶液溶剂A的蒸气压与纯溶剂的蒸气压关系pA=pA*xA
2.亨利定律:
稀溶液挥发性溶质B的蒸气压pA=kxA,k为亨利常数
3.稀溶液的依数性:
(1)蒸气压下降:
pA=pA*-pA=pA*xB
(2)凝固点降低:
Tf=KfbB,Kf–溶剂有关的凝固点降低常数
(3)沸点升高:
Tb=KbbB,Kf–溶剂有关的沸点升高常数
(4)渗透压:
在半透膜两边的平衡压力差π=cRT
4.化学势定义μ=(G/nB)T,p,nc≠nB
(1)理想气体的化学势
μ=μ+RTln(p/p)
(2)分配定律:
在T,P下,某溶质B在溶剂A构成的两相达到平衡时有
=K(T,p)
(3)实际气体的化学势与逸度f
μ=μ+RTln(fB/p)
其中逸度系数fB=γBpB,理想气体γB=1。
5.过程方向判据:
dT=0,dp=0,W'=0时
(1)相变过程:
自发过程方向μ<0。
可逆相变μ=0
(2)化学反应:
恒温恒压下自发过程方向vBμB<0。
6.理想液态混合物的性质
理想液态混合物:
任一组分在全部组成范围内都符合拉乌尔定律的混合物。
(1)化学势μB=μB+RTlnxB
(2)混合过程性质的变化量
mixV=0,mixH=0,
mixS=-nRxblnxB,
mixG=mixH-TmixS=nRTxblnxB,
7.真实液态混合物:
浓度用活度代替
μB=μB+RTlnaB
其中aB=fBxB,fB–活度系数。
五、典型题型
1.根据稀溶液的性质作依数性等方面的计算
2.在相平衡一章中常用拉乌尔定律和亨利定律。
Example1:
香烟中主要含有尼古丁(Nicotine),是致癌物质。
经元素分析得知其中含9.3%的H,72%的C和18.7%的N。
现将0.6克尼古丁溶于12.0克的水中,所得溶液在101325Pa下的凝固点为-0.62℃,求出该物质的摩尔质量MB并确定其分子式.
(已知水的摩尔质量凝固点降低常数为1.86K·kg·mol-1)。
解:
假设尼古丁的摩尔质量为MB,根据凝固点下降公式△Tf=KfbB
则有
MB=150g·mol-1
可算出各原子数
C:
Mr(B)w(C)/Ar(C)=150×0.72/12=9.0
N:
Mr(B)w(N)/Ar(N)=150×0.1870/14=2.0
H:
Mr(B)w(H)/Ar(H)=150×0.093/1=13.9
所以分子式为(C9N2H14)
Example2:
在293K时将6.84g蔗糖(C12H22O11)溶于1kg的水中。
已知293K时此溶液的密度为1.02g·cm-3,纯水的饱和蒸气压为2.339kPa,试求:
(1) 此溶液的蒸气压;
(2) 此溶液的沸点升高值。
已知水的沸点升高常数Kb=0.52K·mol-1·kg。
(3) 此溶液的渗透压。
(8分)
解:
(1)蔗糖的摩尔质量为342g,
x蔗糖=(6.84/342)/[(6.84/342)+1000/18.2]=0.0004
p=p*(1-x蔗糖)=2.339kPa×(1-0.0004)=2.338kPa
(2) b蔗糖=(6.84/342)mol/1kg=0.02mol·kg-1
Tb=Kbb蔗糖=(0.52×0.02)K=0.01K
(3)c=n蔗糖/V=(6.84/342)mol/(1.00684kg/1.02kg·dm-3)=0.02026mol·dm-3
=cRT=0.02026mol·1000m-3×8.3145J·mol-1·K-1
TheEnd!
《物理化学》学习要点
相平衡
一、 本章框架
二、 本章要求
1、理解相律的推导、意义、应用;
2、掌握单组份系统T—P图和二组份系统典型P—X图、T—X图的特点和绘制方法;
3、理解相图中各相区、线和特殊点的意义;
4、理解步冷曲线和热分析法;
5、掌握二组分低共熔系统相图的绘制;
6、会用杠杆规则进行计算;
7、了解精馏原理、三组份系统相图的表示方法;
8、理解克拉佩龙方程和克劳修斯—克拉佩龙方程的推导及应用。
三、主要内容
1、相律;
2、克拉佩龙方程;
3、单组份系统相图;
4、二组份系统相图;
5、理想液态混合物气液平衡;
6、真实液态混含物气液平衡;
7、部分互溶液—液及液一液-气平衡;
8、完全不互溶气液平衡;
9、液固平衡;
10、精馏原理;
11、热分析法;
12、杠杆规则三组份系统相图的表示方法。
四、主要概念
组分数;
自由度;
相图;
共熔点;
三相线;
步冷曲线
五、重要定律与公式
1、相律:
F=C-P+n,其中:
C=S-R-R’
(1)强度因素T,p可变时n=2
(2)对单组分系统:
C=1,F=3-P
(3)对双组分系统:
C=2,F=4-P;应用于平面相图时恒温或恒压,F=3-P。
2、相图
(1)相图:
相态与T,p,x的关系图,通常将有关的相变点联结而成。
(2)实验方法:
实验主要是测定系统的相变点。
常用如下四种方法得到。
对于气液平衡系统,常用方法蒸气压法和沸点法;
液固(凝聚)系统,通常用热分析法和溶解度法。
3、单组分系统的典型相图
对于单组分系统C=1,F=C-P+2=3-P。
当相数P=1时,自由度数F=2最大,即为双变量系统,通常绘制蒸气压-温度(p-T)相图,见下图。
(a)正常相图(b)水的相图(c)硫的相图
图6-1常见的单组分系统相图
4、二组分系统的相图
类型:
恒压的t-x(y)和恒温的p-x(y)相图。
相态:
气液相图和液-固(凝聚系统)相图。
(1)气液相图
根据液态的互溶性分为完全互溶(细分为形成理想混合物、最大正偏差和最大负偏差)、部分互溶(细分为有一低共溶点和有一转变温度的系统)和完全不溶(溶液完全分层)的相图。
可以作恒温下的p-x(压力-组成)图或恒压下的t-x(温度-组成)图,见图6-2和图6-3。
(a)理想混合物(b)最大负偏差的混合物(c)最大正偏差的混合物
图6-2二组分系统恒温下的典型气液p-x相图
(a)理想或偏差不大的混合物(b)具有最高恒沸点(大负偏差)(c)具有最低恒沸点(大正偏差)
(d)有最高会溶点的部分互溶系统(e)有最高和最低会溶点的部分互溶系统(f)沸点与会溶点分离
(g)液相部分互溶的典型系统(h)液相有转沸点的部分互溶系统(i)液相完全不互溶的系统
图6-3二组分系统恒压下的典型气液相图
(2)液-固系统相图:
通常忽略压力的影响而只考虑t-x图。
简单的相图也可分为固相部分完全互溶(形成固溶体,)、固相部分互溶(细分为有一低共溶点和有一转变温度的系统)、固相完全不互溶(形成低共熔混合物)、固相形成稳定化合物和固相形成不稳定化合物的相图,见下。
液相完全互溶,固相完全互溶、固相部分互溶和完全不互溶的液固相图与液相完全互溶、部分互溶和完全不互溶的气液相图的形状相似,只不过在液固相图中的固态和液态在气液相图中变为液态和气态。
稳定化合物熔化时固相和液相组成相同,其相图见下图,相当于两个双组分系统A-C和C-B相图的组合。
不稳定化合物加热到一定温度后分解成一种固体和溶液,溶液组成与化合物组成不同,典型为H2O-NaCl系统,见图6-4。
(a)固相部分互溶系统(b)固相有转溶点的部分互溶系统(c)固相完全不互溶的系统
(d)形成稳定的化合物(e)形成不稳定的化合物
图6-4二组分液固系统的典型相图
从上可知,只要知道气-液系统或液-固系统的相图特征,便可知道另一系统的相图特征。
(3)双组分系统的相图在恒温或恒压下得到,故相律F=C-P+1。
单相区:
P=1,F==C-P+1=2-1+1=2
两相区:
P=2,F=C-P+1=2-2+1=1
三相线:
P=3,F=C-P+1=2-3+1=0,为无变量系统。
5、杠杆规则
图6-5杠杆规则示意图
在任意的两相平衡区,如图6-5。
某系统中物质的总量为n,组成为xo,在某一温度下达到两相平衡,其对应的左右相态物质的量分别为nL、nR,组成分别为xL、xR,则有
或
—杠杆规则
若横坐标为质量百分数m,则杠杆规则可改写为
利用杠杆规则,加上式
或
,即可计算出平衡时两个相态分布的量。
三相线:
在相区中平行于组成轴的直线。
一般规律:
由左右各为单相区或单相组分线包围的区域必是两相区,而由两个两相区包围的区域或分隔线必是单相区或单相线或三相线。
具体可见下图的情况。
6、复杂相图
(a)(b)
图6-6二组分凝聚系统统的温度-组成图
7.步冷曲线(或称冷却曲线)的绘制
步冷曲线即系统加热到高温后让其冷却得到的系统温度与时间的关系曲线。
系统冷却过程中,无相变时,温度随时间平滑下降,即出现连续下降的平滑曲线,但低温区的斜率稍小些;出现相变时,因有热效应,会出现折点,曲线斜率变小;若出现自由度为0的相变(如单组分系统的相变点或双组分系统的三相线上),曲线变水平,斜率为0。
基于上述原理,很容易根据t-x相图绘出步冷曲线。
TheEnd!
《物理化学》学习要点
化学平衡
一、 本章框架
二、 本章要求
1、理解标准平衡常数的含义;
2、掌握有关理想气体、简单复相化学平衡的计算方法;
3、掌握标准摩尔反应吉布斯自由能的求算和应用;
4、能判断一定条件下化学反应可能进行的方向和限度;
5、会分析温度、压力、组成等因素对平衡的影响;
6、会计算不同温度下的标准平衡常数及平衡组成;
7、了解Kf、Ka等概念;
三、主要内容
1、化学反应平衡条件;
2、化学反应等温方程式;
3、压力商;
4、标准平衡常数;
5、复相化学平衡;
6、标准摩尔反应吉布斯自由能;
7、平衡常数与温度的关系--范特霍夫等压方程式;
8、各种因素对平衡组成的影响系统与环境;
四、主要公式
1.理想气体反应的等温方程:
∆rGm=∆rGmθ+RTlnQp
其中:
(1)压力商Qp=
注意:
对于多相反应,通常只考虑气相组分,固相或液相的活度近似认为不变。
(2)标准反应摩尔吉布斯函数变:
∆rGmθ=
=-RTlnKθ
(3)标准平衡常数:
Kθ=exp(-∆rGmθ/RT)=QP(平衡)
(即平衡常数的两种计算方法)
(4)等温等总压时,∆rGm=∆rGmθ+RTlnQp=RTln(Qp/Kθ)<0即Qp2.平衡常数与温度的关系-化学反应的等压方程
dlnKθ/dT=∆rHmθ/(RT2)(微分式)
(1)∆rHmθ为常数ln(K2θ/K1θ)=-(∆rHmθ/R)(1/T2-1/T1)(定积分)
(不定积分)
(2)∆