无机材料科学基础答案第六章Word版.docx
《无机材料科学基础答案第六章Word版.docx》由会员分享,可在线阅读,更多相关《无机材料科学基础答案第六章Word版.docx(36页珍藏版)》请在冰豆网上搜索。
无机材料科学基础答案第六章Word版
6-1略。
6-2什么是吉布斯相律?
它有什么实际意义?
解:
相律是吉布斯根据热力学原理得出的相平衡基本定律,又称吉布斯相律,用于描述达到相平衡时系统中自由度数与组分数和相数之间的关系。
一般形式的数学表达式为F=C-P+2。
其中F为自由度数,C为组分数,P为相数,2代表温度和压力两个变量。
应用相率可以很方便地确定平衡体系的自由度数。
6-3固体硫有两种晶型,即单斜硫、斜方硫,因此,硫系统可能有四个相,如果某人实验得到这四个相平衡共存,试判断这个实验有无问题?
解:
有问题,根据相律,F=C-P+2=1-P+2=3-P,系统平衡时,F=0,则P=3,硫系统只能是三相平衡系统。
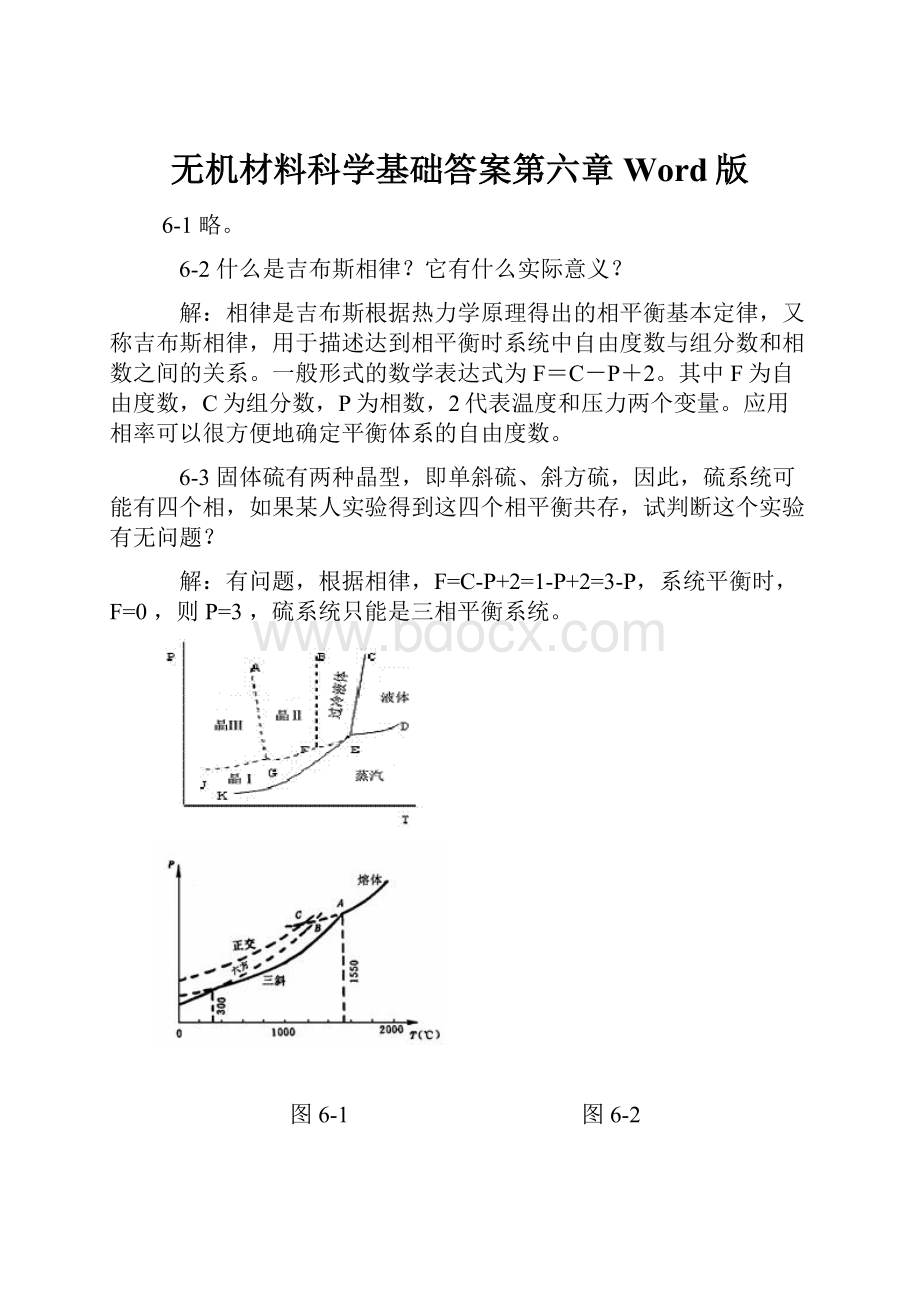
图6-1 图6-2
6-4如图6-1是钙长石(CaAl2Si2O)的单元系统相图,请根据相图回解:
(1)六方、正交和三斜钙长石的熔点各是多少?
(2)三斜和六方晶型的转变是可逆的还是不可逆的?
你是如何判断出来的?
(3)正交晶型是热力学稳定态?
还是介稳态?
解:
(1)六方钙长石熔点约1300℃(B点),正钙长石熔点约1180℃(C点),三斜钙长石的熔点约为1750℃(A点)。
(2)三斜与六方晶型的转变是可逆的。
因为六方晶型加热到转变温度会转变成三斜晶型,而高温稳定的三斜晶型冷却到转变温度又会转变成六方晶型。
(3)正交晶型是介稳态。
6-5图6-2是具有多晶转变的某物质的相图,其中DEF线是熔体的蒸发曲线。
KE是晶型I的升华曲线;GF是晶型II的升华曲线;JG是晶型III的升华曲线,回答下列问题:
(1)在图中标明各相的相区,并写出图中各无变量点的相平衡关系;
(2)系统中哪种晶型为稳定相?
哪种晶型为介稳相?
(3)各晶型之间的转变是可逆转变还是不可逆转变?
解:
(1)KEC为晶型Ⅰ的相区,EFBC过冷液体的介稳区,AGFB晶型Ⅱ的介稳区,JGA晶型Ⅲ的介稳区,CED是液相区,KED是气相区;
(2)晶型Ⅰ为稳定相,晶型Ⅱ、Ⅲ为介稳相;因为晶型Ⅱ、Ⅲ的蒸汽压高于晶型Ⅰ的,即它们的自由能较高,有自发转变为自由能较低的晶型Ⅰ的趋势;
(3)晶型Ⅰ转变为晶型Ⅱ、Ⅲ是单向的,不可逆的,多晶转变点的温度高于两种晶型的熔点;晶型Ⅱ、Ⅲ之间的转变是可逆的,双向的,多晶转变点温度低于Ⅱ、Ⅲ的熔点。
6-6在SiO2系统相图中,找出两个可逆多晶转变和两个不可逆多晶转变的例子。
解:
可逆多晶转变:
β-石英←→α-石英α-石英←→α-鳞石英
不可逆多晶转变:
β-方石英←→β-石英γ-鳞石英←→β-石英
6-7C2S有哪几种晶型?
在加热和冷却过程中它们如何转变?
β-C2S为什么能自发地转变成γ-C2S?
在生产中如何防止β-C2S转变为γ-C2S?
解:
C2S有
、
、
、
四种晶型,它们之间的转变 如右图所示。
由于β-C2S是一种热力学非平衡态,没有能稳定存在的温度区间,因而在相图上没有出现β-C2S的相区。
C3S和β-C2S是硅酸盐水泥中含量最高的两种水硬性矿物,但当水泥熟料缓慢冷却时,C3S将会分解,β-C2S将转变为无水硬活性的γ-C2S。
为了避免这种情况的发生,生产上采取急冷措施,将C3S和β-C2S迅速越过分解温度或晶型转变温度,在低温下以介稳态保存下来。
6-8今通过实验测得如图6-3所示的各相图,试判断这些相图的正确性。
如果有错,请指出错在何处?
并说明理由。
图6-3
解:
第一图错,B组元有一个固定的熔点,因此液相线和固相线在B侧应交于一点。
第二图错,A、B组元具有一个低共熔点,因此A、B的两条液相线应交于一点。
第三图错,析晶过程中,达到共熔点后,系统进入低共熔过程,从液相中析出固溶体α、β,系统进入三相平衡状态,系统的温度不能变,因此中间的那条线应与AB平行。
第四图错,具有低共熔点的有限固溶体二元系统相图中γ固溶体不可能存在。
第五图错,具有转熔点的有限固溶体二元系统相图中γ固溶体不可能存在。
6-9根据图6-4所示的二元系统相图回解:
(1)注明各相区;
(2)写出无变量点的性质及其相平衡关系;(3)写出M1和M2熔体的平衡冷却析晶过程;(4)计算从熔体刚冷至TP温度及离开TP温度时系统中存在各相的百分含量。
解:
(1)相区如图所示:
(2)转熔点P:
低共熔点E:
(3)
液:
固:
图6-4
液:
固:
(4)
点,刚到
时
离开
时,
点,刚到
时
离开
时,
6-10 图6-5为具有一个不一致熔融化合物的二元系统,在低共熔点E发生如下析晶的过程:
L
A+AmBn。
E点B含量为20%,化合物AmBn含B量为64%,今有C1和C2两种配料,其配料点分置于E点两侧。
已知C1中B含量是C2中B含量的1.5倍,且在达低共熔点温度前的冷却析晶过程中,从该二配料中析出的初晶相含量相等。
试计算C1和C2的组成。
图6-5
解:
设A-B二元相图中组成以质量百分数表示。
和
两种配料量均为G(kg)。
据题意,初相在低共溶点前析出,则
和
二配料组成必在AP之间(若在PB之间,初相比在转熔点P前析出)。
又该二配料组成不同,而析出的初相含量相等,可知二配料点一定分置于低共溶点E两侧,析出初相分别为
和A。
设
含B的量为x%,
含B量为y%,则根据杆杠规则可以建立下面方程:
解联立方程,得x=26%,y=17.3%。
所以,
组成为含B的量26%,
组成为含B17.3%
6-11图6-6是一个未完成的具有一个不一致熔化合物并形成固溶体的二元系统相图。
请根据已给出的诸点完成此相图的草图。
解:
草图如下:
图6-6
6-12已知A和B两组成构成具有低共熔点的有限固溶体的二元系统。
试根据下列实验数据绘制粗略相图。
已知A的熔点为1000℃,B熔点为700℃。
含B为25mol%的试样在500℃完全凝固,其中含
73.3mol%初晶相SA(B)和26.7mol%(SA(B)+SB(A))共生体。
含B为50mol%的试样在同一温度下凝固完毕,其中含40mol%初晶相SA(B)和60mol%(SA(B)+SB(A))共生体,而SA(B)相总量占晶相总量的50%。
实验数据均在达到平衡状态时测定。
解:
因a、b点温度及低共熔温度已知,欲绘此相图之草图,关键是求出C、E、D三点之组成。
由于二个试样析出初晶相均为
,且在同一温度下凝固完毕(此温度显然即低共熔温度,可知该二试样的组成必都落在CE间。
设C点含B量为x,E点含B量为z。
根据题意借助杠杆规则可以获得下面关系式。
解上述联立方程,得x=0.051,y=0.799,z=0.949,据此,可确定C点含B量0.05mol,E点含B量为0.80mol,D点含B量为0.95mol。
这样相图中C、E、D位置可以找到,从而绘出相图的草图如下:
6-13根据Al2O3-SiO2系统相图说明:
(1)铝硅质耐火材料:
硅砖(含SiO2>98%)、粘土砖(含Al2O335%~50%)、高铝砖(含Al2O360%~90%)、刚玉砖(含Al2O3>90%)内,各有哪些主要的晶相?
(
2)为了保持较高的耐火度,在生产硅砖时应注意什么?
(3)若耐火材料出现40%的液相便软化不能使用,试计算含40mol%Al2O3的粘土砖的最高使用温度。
解:
(1) 硅砖(含SiO2>98%)主要晶相:
SiO2、2Al203·2SiO3固溶体(莫来石), 粘土砖(含Al20335~50%)主要晶相:
SiO2、A3S2,高铝砖(含Al20360~90%)主要晶相:
60~72%A3S2 72~90%Al203、A3S2。
(2) 为了保持硅砖的耐火度,要严格防止原料中混如Al203。
SiO2熔点为1723℃,SiO2液相很陡,加入少量的Al203后,硅砖中会产生大量的液相,SiO2的熔点剧烈下降。
如加入1wt%Al203,在低共熔点(1595℃)时产生的液相量为1/5.5=18.2%,会使硅砖的耐火度大大下降;
(3) 根据相图,当出现40%液相时,由杆杠规则可知,
,得x=0.1,在相图中作出析晶路线,可以估计出粘土砖的最高温度约为1670℃。
Al2O3-SiO2系统相图
6-14根据CaO-SiO2系统相图回答下列问题:
(1)若以含CaO80%的熔体1000g冷却到2150℃以后(温度即将离开2150℃时),会获得何种产物?
这些产物的量各为多少?
(2)若以CaO、SiO2二组元配料,加热至熔融后再冷却,要求产物中只有C2S和C3S,则配料范围应选在哪里?
若平衡冷却能达到目的吗?
为什么?
应采取什么措施?
解:
CaO-SiO2系统如下:
CaO-SiO2系统相图
(1)根据上图,可知,含CaO80%的熔体1000g冷却到即将离开转熔点M时(2150℃),产物为C3S和CaO,根据杆杠规则可知:
C3S为
,CaO为
。
(2)若要求产物中只有C2S和C3S,据相图可知,配料范围应选在含CaO65%~74%之间。
平衡冷却不能达到目的,因为平衡冷却得到的是C2S和CaO,为使产物只有C2S和C3S,应在温度降至1250℃急冷。
6-15在CaO-SiO2和Al2O3-SiO2系统中,SiO2的液相线都很陡,解释为什么在硅砖生产中可掺入少量CaO做矿化剂不会降低硅砖的耐火度,而在硅砖中却要严格防止混入Al2O3,否则便会使硅砖耐火度大大下降。
解:
SiO2中加入少量的CaO,在低共熔点1436℃时,液相量为2/37=5.4%,液相量增加不多,不会降低硅砖的耐火度,故可加少量CaO作矿化剂。
6-16加热粘土矿物高岭石(Al2O3·2SiO2·2H2O)至600℃时,高岭石分解为水蒸气和Al2O3·2SiO2,继续加热到1595℃时会发生什么变化?
在该温度下长时间保温达到平衡,系统的相组成如何?
当系统生成40%液相时,应达到什么温度?
在什么温度下该粘土完全熔融?
解:
Al2O3·2SiO2·H2O Al2O3·2SiO2+H2O
Al2O3·2SiO2相图中SiO2%=33%mol
(1)加热到1595℃时,生成A3S2
(2)1595℃长时间保温,系统中为液相和A3S2,L%==21.8%
(3)完全熔融即固相完全消失,应为33%直线与液相线交点处温度。
6-17将含有MgO和Al2O3的熔体冷却到一定温度,然后滤去析出的晶体并对剩下的液相进行分析,得知液相中含MgO为65%,
而且知道液相量是物系总量的70%,求原始熔体的组成。
解:
MgO 45.5%;Al2O3 54.5%
6-18指出图6-7所示一些三元系统相图中的错误,并说明理由。
解:
(a)此相图上等界线相应的连线可将图面划分成五个副三角形,但是只有四个无变量点,这是不可能的。
事实上三元化合物XYZ的初晶区不可能延伸到YZ边上。
图6-7
6-19请划分图6-8所示四个相图中的副三角形。
图6-8
解:
如下图所示
6-20在浓度三角形中画出下列配料的组成点的位置。
M:
A=10%、B=70%、C=20%;N:
A=10%、B=20%、
C=70%;P:
A=70%、B=20%、C=10%。
若将3kgM、2kgN和5kgP混合,试根据杠杆规则用作图法找出新配料Q的组成点位置。
解:
如图所示
6-21图6-9是最简单的三元系统投影图,图中等温线从高温到低温的次序是:
t5>t4>t3>t2>t1,根据此投影图回解:
(1)三个组元A、B、C熔点的高低次序是怎样排列的?
(2)各液相面的陡势排列如何?
哪个最陡?
哪个最平坦?
(3)指出组成为65%A、15%B、20%C的熔体在什么温度下开始析晶?
析晶过程怎样?
(表明液、固相组成点的变化及结晶过程各阶段中发生的变化过程)
解:
(1)熔点:
TB>TA>TC
(2)B最陡,C次之,A最平坦;
(3)如图所示,在M点所在的温度下开始析晶,
析晶过程如下:
图6-9 图6-10
6-22图6-10为ABC三元系统相图,根据此相图:
(l)判断化合物K和D的性质;
(2)标出各条界线上的温度下降方向;(3)划分副三角形;
(4)判断各无变量点的性质,并写出相平衡关系式。
解:
(1)K为一致熔融三元化合物;D为一致熔融二元化合物。
(2)如右图所示。
(3)如右图所示。
(4)无变量点M、N、O、P均为低共熔点,
向平衡关系如下:
M
N
O
P
6-23试分析图6-11上配料点1、2、3的结晶过程,写出结晶过程的相平衡表达式(表明液、固相组成点的变化及结晶过程各阶段系统中发生的相变化和自由度数的变化)。
解:
1点冷却析晶过程:
2点冷却析晶过程:
3点冷却析晶过程:
图6-11 图6-12
6-24图6-12所示为生成一个三元化合物的三元系统相图。
(1)判断三元化合物N的性质;
(2)标出界线上的温降方向(转熔界线用双箭头);(3)指出无变量点K、L、M的性质,并写出相平衡方程;(4)分析点l、2的结晶过程,写出结晶过程的相平衡表达式。
解:
(1)N为不一致熔融三元化合物
(2)如图所示
(3)副△ACN 对应M 低共熔点
副△BCN 对应L 低共熔点
副△ABN 对应K 单转熔点
(4)1的结晶过程:
2的结晶过程:
6-25根据图6-13三元系统相图:
(1)判断无变量点E、P的性质,并写出相平衡关系式;
(2)分析熔体M1、M2和M3的冷却析晶过程,并总结判断结晶产物和结晶结束点的规则;(3)加热组成为M4的混合物,将于什么温度出现液相?
在该温度下出现的最大液相量是多少?
在什么温度下完全熔融?
写出其加热过程相平衡表达式。
解:
(1)E为低共熔点
P为单转熔点
(2)①熔体M1的冷却析晶过程:
②熔体M2的冷却析晶过程:
③熔体M3的冷却析晶过程:
熔体组成点所在副三角形三个顶点所代表的晶相违结晶产物;三晶相对应的初晶区所包围的无变量点为结晶结束点。
(3)加热组成为M4的混合物,将于E点对应的温度出现液相。
在该温度下出现的最大液相量为
,在M4点对应的温度下完全熔融。
加热过程相平衡表达式:
图6-13 图6-14
6-26图6-14为一个三元系统相图。
根据此图:
(1)判断化合物D的性质,标出图中各边界和界线温降方向并判断界线性质;
(2)判断无变量点E、F、G的性质,并写出相平衡关系式;(3)写出熔体M1和M2的冷却析晶过程;(4)计算熔体M2液相刚到结晶结束点时以及结晶结束后的各相含量。
解:
(1)化合物D为不一致熔融三元化合物;
(2)E 低共熔点
F 单转熔点
G 单转熔点
(3)熔体M1的冷却析晶过程:
熔体M2的冷却析晶过程:
(4)熔体M2液相刚到结晶结束点时各相的含量:
熔体M2液相到结晶结束点后各相的含量:
6-27图6-15为生成2个一致熔融二元化合物的三元系统,据图回答下列问题:
(l)可将其划分为几个副三角形?
(2)标出图中各边界及相区界线上温度下降方向。
(3)判断各无变量点的性质,并写出相平衡关系式。
解:
(1)三个副三角形,△AS1S2、△S1S2B、△S2CB
(2)如下图所示
(3)无变量点E1、E2、E3都是低共熔点,各向平衡关系式如下:
△AS1S2 E1
△S1S2B E2
△S2CB E3
图6-15 图6-16
6-28图6-16是生成一致熔融二元化合物(BC)的三元系统投影图。
设有组成为35%A、35%B、30%C的熔体,试确定其在图中的位置。
冷却时该熔体在何温度下开始析出晶体?
解:
M点的位置如下图所示,M点所在温度约1050℃,1050℃开始析晶。
6-29根据图6-17回答下列问题:
(l)说明化合物S1、S2的性质;
(2)在图中划分副三角形及用箭头指示出各界线的温度下降方向及性质;(3)指出各无变量点的性质并写出各点的平衡关系;(4)写出1、3组成的熔体的冷却结晶过程;(5)计算熔体1结晶结束时各相百分含量,若在第三次结晶过程开始前将其急冷却(这时液相凝固成为玻璃相),各相的百分含量又如何?
(用线段表示即可);(6)加热组成2的三元混合物将于哪一点温度开始出现液相?
在该温度下生成的最大液相量是多少?
在什么温度下完全熔融?
写出它的加热过程。
解:
(1)S1为一致熔融二元化合物,S2为不一致熔融化合物。
(2)如图所示。
(3)E 低共熔点
P1 单转熔点
P2 单转熔点
(4)1组成的熔体的冷却结晶过程
3组成的熔体的冷却结晶过程
(5)熔体1结晶结束时各相百分含量
在第三次结晶过程开始前将其急冷却,各相的百分含量
(6)在P2点对应的温度开始出现液相,在该温度下出现的最大液相量为:
在2点对应的温度下完全熔融。
组成2加热过程:
图6-17 图6-18
6-30根据图6-18回答下列问题:
(1)说明化合物S的熔融性质,并分析相图中各界线上温度变化的方向以及界线和无变量点的性质;
(2)写出组成点为1、2、3及4各熔体的冷却结晶过程;(3)分别将组成为5和组成为6的物系,在平衡的条件下加热到完全熔融,说明其固液相组成的变化途径。
解:
(1)化合物S为不一致熔融三元化合物;P1E、P2E均为共熔界线,P1P2为转熔界线;无变量点E为低共熔点,P1、P2均为单转熔点。
(2)组成点为1的熔体的冷却结晶过程:
组成点为2的熔体的冷却结晶过程:
组成点为3的熔体的冷却结晶过程:
组成点为4的熔体的冷却结晶过程:
(3)组成为5物系的熔融过程:
组成为6物系的熔融过程:
6-31根据图6-19回答下列问题:
(1)用箭头标出各界线的温度下降方向并说明界线性质;
(2)指出各无变量点E、P、R、Q的性质,并写出其相平衡关系;(3)写出熔体M的结晶过程,说明液相离开R点的原因;(4)画出AB、BC二元系统相图。
解:
(1)界线Ee2、e1P、ab、PE、RE、QR、e3Q均为共熔界线,界线aP、bR为转熔界线。
(2)E 低共熔点
P 单转熔点
Q 过渡点
(3)熔体M的结晶过程:
熔体M在副△BCS内,其结晶结束点应在E点,所以液相离开R点。
图6-19
6-32比较各种三元无变量点(低共熔点,单转熔点,双转熔点,过渡点和多晶转变点)的特点,写出它们的平衡关系。
解:
低共熔点指是一种无变量点,系统冷却时几种晶相同时从熔液中析出,或加热时同时融化。
相平衡关系为L(E)
若无变量点处于交叉位置的是单共熔分别点,在共轭位置的是双转熔点。
相转变关系为
,
过渡点就是转熔性质和共熔性质转变的点,无对应三角形,相平衡的三晶相组成在一条直线上。
多晶转变点两种或者三种晶型发生晶型转变的温度点。
6-38如图6-25为CaO-Al2O3-SiO2系统的富钙部分相图,若原始液相组成位于硅酸盐水泥的配料圈内,并恰好在CaO和C3S初相区的边界曲线上。
(1)分析此液相组成的结晶过程;
(2)在缓慢冷却到无变量点K的温度1455℃时急剧冷却到室温,则最终获得哪些相,各相含量多少?
图6-25 CaO-Al2O3-SiO2系统高钙区部分相图
解:
(1)
,
(2) 溶体平衡冷却得到产物是C2S,C3S和C3A,其固相组成点为P点,各晶相可根据P点在△C2S—C3S—C3A中的位置按双线法求得,C2S=14.6%,C3S=63.9%,C3A=21.5%。
实际生产过