水溶液中的离子平衡综合应用.docx
《水溶液中的离子平衡综合应用.docx》由会员分享,可在线阅读,更多相关《水溶液中的离子平衡综合应用.docx(15页珍藏版)》请在冰豆网上搜索。
水溶液中的离子平衡综合应用
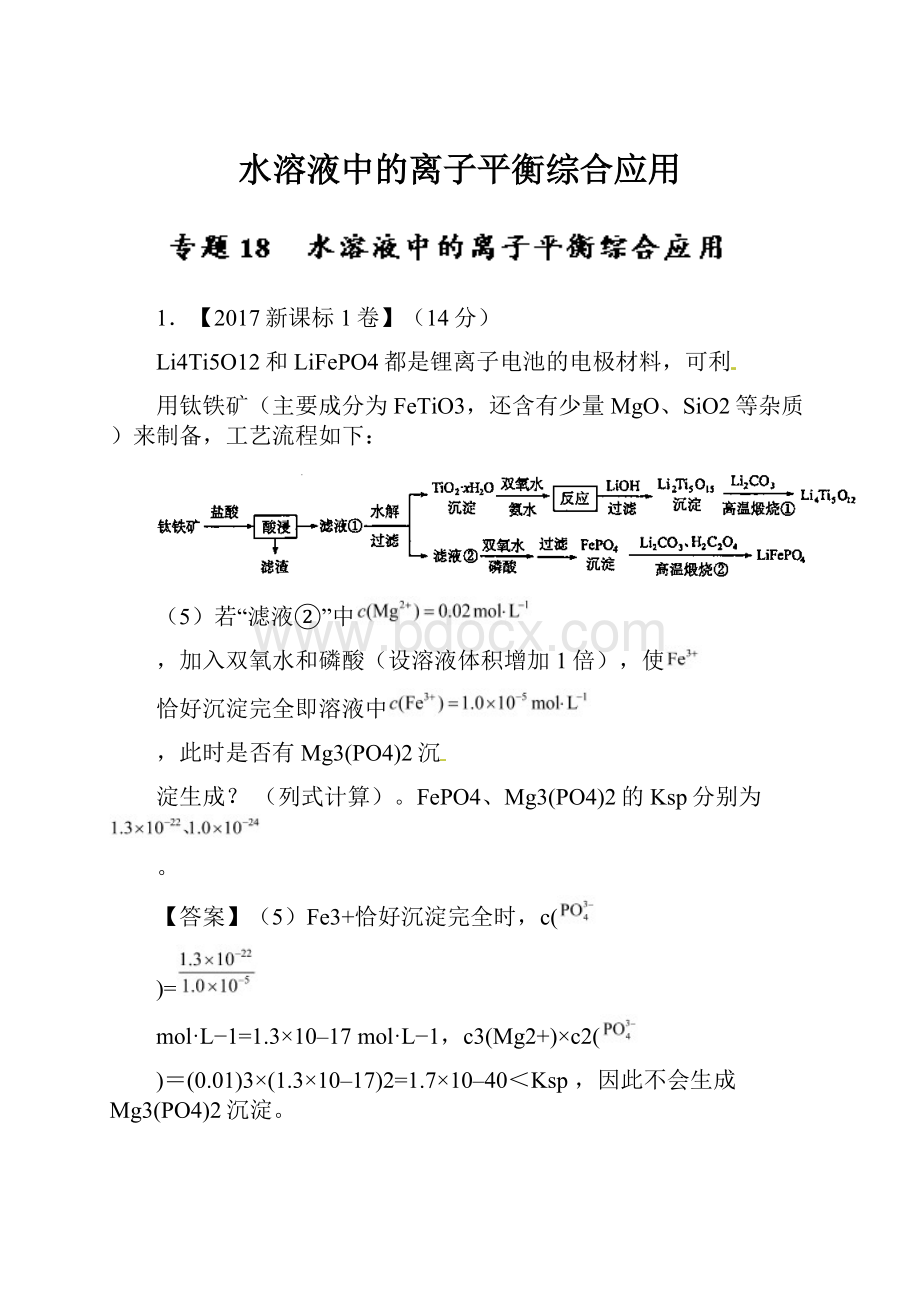
1.【2017新课标1卷】(14分)
Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利
用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
(5)若“滤液②”中
,加入双氧水和磷酸(设溶液体积增加1倍),使
恰好沉淀完全即溶液中
,此时是否有Mg3(PO4)2沉
淀生成?
(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为
。
【答案】(5)Fe3+恰好沉淀完全时,c(
)=
mol·L−1=1.3×10–17mol·L−1,c3(Mg2+)×c2(
)=(0.01)3×(1.3×10–17)2=1.7×10–40<Ksp,因此不会生成Mg3(PO4)2沉淀。
2.【2017新课标1卷】(14分)
近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。
回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是_________(填标号)。
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的导电能力低于相同浓度的亚硫酸
C.0.10mol·L−1的氢硫酸和亚硫酸的pH分别为4.5和2.1
D.氢硫酸的还原性强于亚硫酸
【答案】
(1)D
【解析】
(1)A.根据复分解反应的规律:
强酸+弱酸盐=强酸盐+弱酸,可知酸性H2SO3>H2CO3>H2S,A错误;B.亚硫酸、氢硫酸都是二元弱酸,由于溶液中离子浓度越大,溶液的导电性就越强,所以等浓度的亚硫酸的导电性比氢硫酸的强,可以证明酸性:
H2SO3>H2S,B错误;C.等浓度的二元弱酸,酸电离产生的c(H+)越大,溶液的酸性越强,则其pH就越小。
所以亚硫酸溶液的pH比等浓度的氢硫酸的小,可以证明酸性:
H2SO3>H2S,C错误;D.物质的还原性大小与微粒中元素的化合价及微粒结构有关,与其电离产生氢离子的浓度大小无关,因此不能证明二者的酸性强弱,D正确。
答案选D。
3.【2017天津卷】(14分)H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题。
方法2:
用氨水除去SO2
(5)已知25℃,NH3·H2O的Kb
=1.8×10−5,H2SO3的Ka1=1.3×10−2,Ka2=6.2×10−8。
若氨水的浓度为2.0mol·L−1,溶液中的c(OH−)=_________________mol·L−1。
将SO2通入该氨水中,当c(OH−)降至1.0×10−7mol·L−1时,溶液中的c(
)/c(
)=___________________。
【答案】(5)6.0×10−30.62
4.【2016新课标1卷】
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4−(绿色)、Cr2O72−(橙红色)、CrO42−(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl−,利用Ag+与CrO42−生成砖红色沉淀,指示到达滴定终点。
当溶液中Cl−恰好沉淀完全(浓度等于1.0×10−5mol·L−1)时,溶液中c(Ag+)为_______mol
L−1,此时溶液中c(CrO42−)等于__________mol
L−1。
(已知Ag2CrO4、AgCl的Ksp分别为2.0×10−12和2.0×10−10)。
【答案】(3)2.0×10-5;5×10-3;
【解析】(3)当溶液中Cl−完全沉淀时,即c(Cl-)=1.0×10−5mol·L−1,根据溶度积常数Ksp(AgCl)=2.0×10−10,可得溶液中c(Ag+)=Ksp(AgCl)÷c(Cl-)=2.0×10−10÷(1.0×10−5mol·L−1)=2.0×10-5mol·L−1;则此时溶液中c(CrO42−)=Ksp(Ag2CrO4)/c2(Ag+)=2.0×10−12÷(2.0×10-5mol·L−1)=5×10-3mol·L−1;
5.【2016新课标2卷】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为___________________(已知:
N2H4+H+
N2H5+的K=8.7×107;KW=1.0×10-14)。
联氨与硫酸形成的酸式盐的化学式为。
【答案】(4)8.7×10-7N2H6(HSO4)2
6.【2016上海卷】随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。
完成下列填空:
(
3)碳酸:
H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:
H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
0.1mol/LNa2CO3溶液的pH_____0.1mol/LNa2C2O4溶液的pH。
(选填“大于”、“小于”或“等于”)
等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是___________。
若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____。
(选填编号)
a.>>>
B.>>>
c.>>>
D.>>>
(4)人体血液中的碳酸和碳酸氢盐存在平衡:
H++HCO3-
H2CO3,当有少量酸性或碱性物
质进入血液中时,血液的pH变化不大,用平衡移动原理解
释上述现象。
_____________
【答案】(3)大于;草酸;ac(4)当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变。
(合理即给分)
【解析】(3)根据电离常数可知草酸的酸性强于碳酸,则碳酸钠的水解程度大于草酸钠,所以0.1mol/LNa2CO3溶液的pH大于0.1mol/LNa2C2O4溶液的pH。
草酸的酸性强于碳酸,则等浓度草酸溶液和碳酸溶液中,氢离子浓度较大的是草酸。
a.草酸的两级电离常数均大于碳酸的,所以草酸的两级的电离程度均大于碳酸的,因此溶液中>>>>,a正确;b.根据a中分析可知b错误;c.根据a中分析可知c正确;d.根据a中分析可知d错误,答案选ac。
(4)根据平衡可知当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变。
7.【2015北京卷】(14分)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%,写出CO2溶于水产生HCO3-的方程式:
。
(2)在海洋循环中,通过下图所示的途径固碳。
①写出钙化作用的离子方程式:
。
②同位素示踪法证实光合作用释放出的O2只来自于H2O,用18O标记物质的光合作用的化学方程式如下,将其补充完整:
+=(CH2O)x+x18O2+xH2O
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收CO2,用N2从酸化后的还说中吹出CO2并用碱液吸收(装置示意图如下),将虚线框中的装置补充完整并标出所用试剂。
②滴定。
将吸收液洗后的无机碳转化为NaHCO3,再用xmol/LHCl溶液滴定,消耗ymlHCl溶液,海水中溶解无机碳的浓度=mol/L。
【答案】
(1)CO2+H2O
H2CO3,H2CO3
HCO3-+H+
(2)①Ca2++2HCO3-=CaCO3↓+CO2+H2O②xCO22xH218O
(3)①
②xy/z
(3)①注意酸化的试剂要用硫酸,一定不能用盐酸,HCl会挥发出来影响后续的滴定。
②该滴定过程转化的关系式为:
CO2~HCO3-~HCl
11
n(CO2)xmol/L×y×10-3L
解得:
n(CO2)=xy×10-3mol所以:
c(CO2)=xy/zmol/L
8.【2015福建卷】(15分)研究硫元素及其化合物的性质具有重要意义。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的c(H2S)+c(HS-)=mol·L-1.
②某溶液含0.020mol·L-1Mn2+、0.10mol·L-1H2S,当溶液pH=时,Mn2+开始沉淀。
(3)25℃,两种酸的电离平衡常数如右表。
Ka1
Ka2
H2SO3
1.3×10-2
6.3×10-4
H2CO3
4.2×10-7
5.6×10-11
①HSO3-的电离平衡常数表达式K=。
②0.10mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为。
【答案】
(2)①0.043;②5。
(3)①
;②c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
③H2SO3+HCO3-=HSO3-+CO2↑+H2O。
电离程度越大,电离平衡常数就越大。
所以根据表格数据可知H2SO3的二级电离平衡常数大于H2CO3的一级电离平衡常数,故H2SO3溶液和NaHCO3溶液反应的主要是复分解反应的规律:
强酸与弱酸的盐发生反应制取弱酸。
其离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O。
【考点定位】考查元素原子结构示意图的书写、物质性质的化学方程式书写、盐的水解平衡、弱电解质电离平衡、沉淀溶解平衡的知识在离子浓度大小比较的应用。
9.【2015新课标1卷】(15分)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。
回答下列问题:
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中
为:
_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
【答案】
(2)4.7×10-7;
10.【2015新课标2卷】(14分)酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
化合物
Zn(OH)2
Fe(OH)2
Fe(OH
)3
Ksp近似值
10-17
10-17
10-39
回答下列问题:
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:
加稀硫酸和H2O2溶解,铁变为_____,加碱调节至pH为时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_____时,锌开始沉淀(假定Zn2+
浓度为0.1mol/L)。
若上述过程不加H2O2后果是,原因是。
【答案】(4)Fe3+;2.7;6;Zn2+和Fe2+分离不开;Fe(OH)2和Zn(OH)2的Ksp相近
【解析】(4)双氧水具有强氧化性,能把铁氧化为铁离子,因此加入稀硫酸和双氧水,溶解后铁变为硫酸铁。
根据氢氧化铁的溶度积常数可知,当铁离子完全沉淀时溶
液中铁离子浓度为10—5mol/L,则溶液中氢氧根的浓度=
,所以氢离子浓度
是2×10—3mol/L,pH=2.7,因此加碱调节pH为2.7时铁刚好完全沉淀。
Zn2+
浓度为0.1mol/L,根据氢氧化锌的溶度积常数可知开始沉淀时的氢氧根浓度为=
=10—8mol/L,氢离子浓度是10—6mol/L,pH=6,即继续加碱调节pH为6时锌开始沉淀。
如果不加双氧水,则铁与稀硫酸反应生成硫酸亚铁,由于氢氧化亚铁和氢氧化锌的溶度积常数接近,因此在沉淀锌离子的同时亚铁离子也沉淀,导致生成的氢氧化锌不纯,无法分离开
Zn2+和Fe2+。
11.【2015浙江卷】Ⅰ.
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式_____________。
【答案】Ⅰ.(3)AgCl+Br-=AgBr+Cl-
【解析】(3)AgBr比AgCl更难溶,生成的淡黄色沉淀为了溴化银,离子方程式为AgCl+Br-=AgBr+Cl-。
12.【2015天津卷】(14分)FeCl3具有净水
作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。
请回答下列问题:
(1)FeCl3净水的原理是。
FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为。
【答案】
(1)Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质;2Fe3++Fe=3Fe2+
(2)①2
13.【2015上海卷】
(5)室温下,0.1mol/LNaClO溶液的pH0.1mol/LNa2SO3溶液的pH(选填“大于”、“小于”或“等于”)。
浓度均为0.1mol/L的Na2SO3和Na2CO3的混合溶液中,SO32–、CO32–、HSO3–、HCO3–浓度从大到小的顺序为。
已知:
H2S
O3Ki1=1.54×10-2Ki2=1.02×10-7
HClOKi1=2.95×10-8
H2CO3Ki1=
4.3×10-7Ki2=5.6×10-11
【答案】(5)大于;SO32–>CO32–>HCO3–>HSO3–。
14.【2015山东卷】(19分)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
(2)
Ca2+
Mg2+
Fe3+
开始沉淀时的pH
11.9
9.1
1.9
完全沉淀时的pH
13.9
11.1
3.2
加入NH3·H2O调节pH=8可除去(填离子符号
),滤渣Ⅱ中含
(填化学式)。
加入H2C2O4时应避免过量,原因是。
已知:
Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
【答案】
(2)Fe3+;Mg(OH)2、Ca(OH)2;H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少。
【解析】
(2)根据流程图和表中数据,加入NH3•H2O调pH为8,只有Fe3+完全沉淀,故可除去Fe3+;加入NaOH调pH=12.5,Mg2+也完全沉淀,Ca2+部分沉淀,所以滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;根据Ksp(BaC2O4)=1.6×10-7,H2C2O4过量时Ba2+转化为BaC2O4沉淀,BaCl2·2H2O产品的产量减少。
15.【2015江苏卷】(12分)软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O,反应的化学方程式为:
MnO2+SO2=MnSO4
(2)已知:
Ksp=1×10-33,Ksp=3×10-39,pH=7.1时Mn(OH)2开始沉淀。
室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度小于1×10-6mol·L-1),需调节溶液pH范围为________。
【答案】
(2)5.0【解析】
(2)制备MnSO4,再根据信息,pH小于7.1,氢氧化铝完全变成沉淀时的pH:
Ksp=1×
10-33=c(Al3+)×c3(OH-),c(Al3+)=1×10-6mol·L-1,得出:
c(OH-)=1×10-9mol·L-1,
c(H+)=Kw/c(OH-)=10-5,pH=5,同理计算出Fe(OH)3完全变成沉淀时,pH约为3.5,故范围是:
5.016.【2015江苏卷】
(4)CaSO3水悬浮液中加入Na2SO4溶液,达到平衡后溶液中c(SO32-)=________;CaSO3水悬浮液中加入Na2SO4溶液能提高NO2的吸收速率,其主要原因是_________。
【答案】(4)Ksp(CaSO3)×c(SO42-)/Ksp(CaSO4),CaSO3转化为CaSO4使溶液中SO32-的浓度增大,加快SO32-与NO2的反应速率。
17.【2015海南卷】(9分)银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。
回答下列问题。
(2)已知Ksp(AgCl)=1.8×10-10,若向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸,混合后溶液中的Ag+的浓度为mol·L-1,pH为。
【答案】
(2)1.8×10-7mol/L;2
【解析】
(2)根据反应中HCl和硝酸银的物质的量可知HCl过量,则计算剩余的氯离子的物质的量浓度为(0.02-0.018)mol/L/2=0.001mol/L,根据AgCl的溶度积的表达式计算即可;因为该反应中氢离子未参加反应,所以溶液的体积变为100mL时,氢离子的浓度为0.01mol/L,则pH=2。
18.【2015海南卷】(8分)氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为(用离子方程式表示),0.1mol·L-1的氨水中加入少量的NH4Cl固体,溶液的PH(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度(填“增大”或“减小”)。
【答案】
(1)NH3·H2O
NH4++OH-减小;