期末无机化学复习资料.docx
《期末无机化学复习资料.docx》由会员分享,可在线阅读,更多相关《期末无机化学复习资料.docx(11页珍藏版)》请在冰豆网上搜索。
期末无机化学复习资料
第十章过渡金属元素
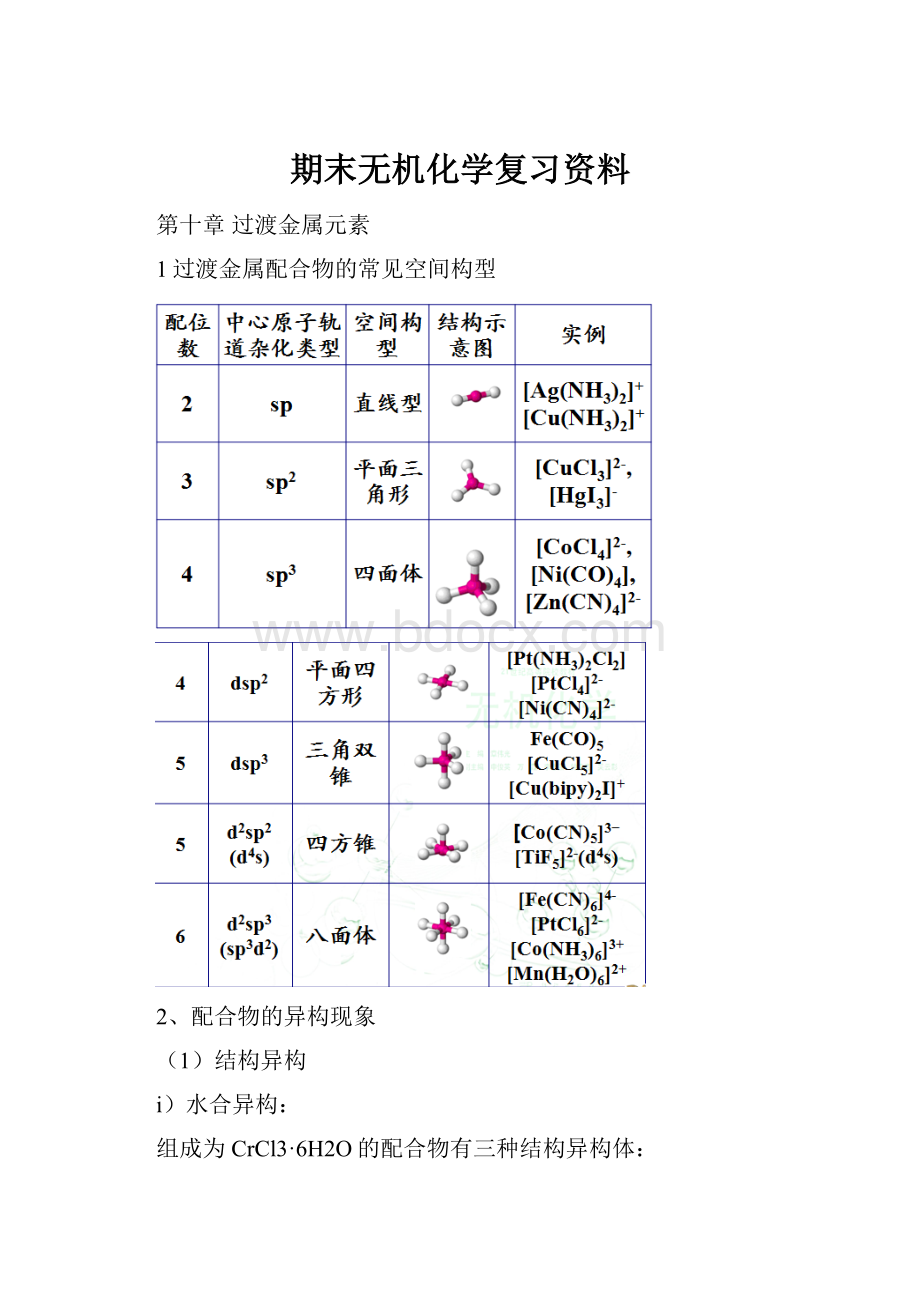
1过渡金属配合物的常见空间构型
2、配合物的异构现象
(1)结构异构
i)水合异构:
组成为CrCl3·6H2O的配合物有三种结构异构体:
[Cr(H2O)6]Cl3(紫色)
[CrCl(H2O)5]Cl2·H2O(灰绿色)
[CrCl2(H2O)4]Cl·2H2O(深绿色)
ii)键合异构:
[Fe(SCN)]2+(硫氰酸铁)
[Fe(NCS)]2+(异硫氰酸铁)
(2)立体异构:
I)几何异构:
Ii)对映异构(旋光异构或手性异构)
一对旋光异构体的熔点、折光率、溶解度、热力学稳定性等都几乎没有差别,但却可使平面偏振光发生方向相反的偏转,其中一种称为右旋旋光异构体(用符号D表示),另一种称为左旋旋光异构体(用符号L表示)。
3、配合物的价键理论
(1)基本要点
i)中心原子以空轨道接受配体的孤对电子,形成键,即ML共价键;
ii)中心原子能量相近的价层空轨道进行杂化,形成具有一定空间伸展方向的、能量相同的杂化轨道,每一个空的杂化轨道接受配位原子的一对孤对电子形成配位键;
(2)杂化轨道和空间构型
(3)配合物的磁性
配合物中存在未成对电子时表现顺磁性,否则为逆(抗)磁性。
磁性可用磁矩来描述。
4、外轨型(高自旋)和内轨型(低自旋)配合物
(1)外轨型配合物
中心离子的电子结构不发生变化,仅用外层的空轨道ns,np,nd进行杂化生成能量相同,数目相等的杂化轨道与配体结合。
(如卤素、氧等电负性较高的配位原子,如[FeF6]3-)
(2)内轨型配合物
中心原子使用内层的(n-1)d空轨道参加杂化所形成的配合物称为内轨型配合物。
(C(如CN-)、N(如NO2-)等电负性较低的配位原子)
注意:
对同一个中心原子而言,一般内轨型配合物比外轨型稳定。
4、高自旋和低自旋配合物
高自旋配合物:
具有较多的未成对电子而显顺磁性或磁矩较大;
低自旋配合物:
具有较少的未成对电子(磁矩较小)或呈抗磁性;
注意:
高低自旋配合物是相对的,只是对同一中心原子而言。
5、价键理论的局限性
不能解释配合物的特征光谱,也无法解释过渡金属配离子为何有不同的颜色;
6、配合物的晶体场理论
(1)基本要点
i)将配体看成点电荷而不考虑其结构和轨道,认为中心原子与配体之间是纯粹的正、负电荷静电作用力;
ii)配体对中心原子产生的静电场称为晶体场。
晶体场中特定位置的配体对中心原子价层的5个不同取向的d轨道的排斥作用使得本来简并的d轨道分裂为2组或2组以上能级不同的d轨道,产生晶体场分裂能;
iii)d电子在分裂后的能级上重新排布,产生晶体场稳定化能(CFSE),这是配合物能够形成的能量因素;
(2)晶体场中的能级分裂
i)d轨道在八面体场中的分裂
(3)影响晶体场分裂能大小的因素:
i)中心原子的氧化数越高,越大;
ii)中心原子的周期数越大,越大;
iii)对相同中心原子、相同配合物构型,分裂能值与配体有关
I−H2O及其前面的配体为弱场配体;
Iiii)中心原子和配体都相同,但空间构型不同,分裂后的d轨道能级分布和晶体场分裂能也不同;
(4)晶体场中的d电子排布
排布原则:
①最低能量原理
②洪特规则
③泡利不相容原理
电子成对能(P):
两个电子进入同一轨道时需要消耗的能量。
强场:
o>P弱场:
o四面体配合物中价层d电子一般都采取高自旋排布;
(5)晶体场稳定化能:
d电子从未分裂的球形场d轨道进入分裂的d轨道所产生的能量变化,称为晶体场稳定化能(CFSE);
(6)晶体场理论的应用
i)根据d-d跃迁解释配合物离子的颜色;
配合物吸收可见光中的某特定波长部分,就显示被吸收光的互补波长颜色;
由于极化作用(电荷转移跃迁)部分过渡金属的含氧酸根也有颜色;
ii)依据配合物中电子的自旋状态解释配合物的磁性;
强场低自旋,弱场高自旋
iii)晶体场稳定化能(CFSE)的大小可以用来判断过渡金属配合物的稳定性
7、3d过渡金属
(1)
(2)金属的性质
3d过渡金属与主族金属相比,一般具有较小的原子半径和较大的密度(除Sc和Ti因密度小于5g/cm3属轻金属外,皆属重金属)。
它们的硬度和熔、沸点均比IA和IIA金属高。
其中硬度和熔点最大的都是铬;
从Sc→V其3d电子数增加,参与形成金属键的电子数也增加,金属键增强,熔点依次升高。
Mn因3d为半满,相对稳定,全部3d电子难以参与形成金属键,则熔点显著降低。
从Fe到Ni,3d电子数大于5,3d电子参与形成金属键的能力逐渐减弱,所以熔点又降低。
(3)常见氧化态
过渡元素常有多种氧化态,一般可由+Ⅱ依次增加到与族数相同的氧化态,但Ⅷ族的Fe、Co、Ni不能达到族数氧化态;
(4)
8、3d过渡金属的单质
(1)由于3d过渡金属比较活泼,在自然界没有单质存在。
钪和钇与镧系性质相近,在自然界共生,被总称为稀土元素。
(2)
(3)
(4)
(5)单质的化学性质: