化学水平考试第二章化学物质及其变化.docx
《化学水平考试第二章化学物质及其变化.docx》由会员分享,可在线阅读,更多相关《化学水平考试第二章化学物质及其变化.docx(22页珍藏版)》请在冰豆网上搜索。
化学水平考试第二章化学物质及其变化
第二章化学物质及其变化
考试内容与要求
主干知识整合
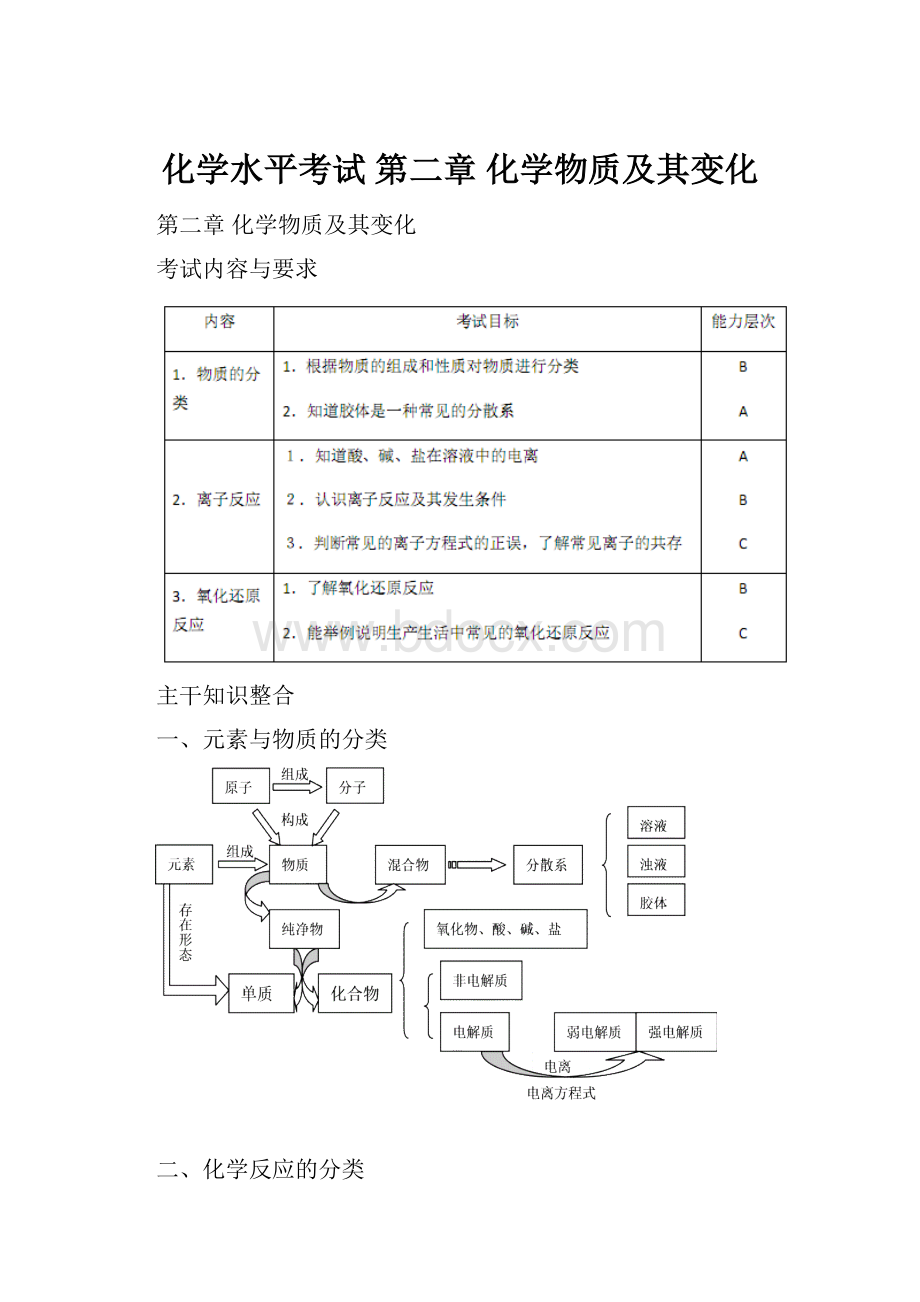
一、元素与物质的分类
二、化学反应的分类
基础撞关
1.(2009年广东)分类是学习和研究化学的一种重要方法,下列分类合理的是(C)
A、K2CO3和K2O都属于盐B、KOH和Na2CO3都属于碱
C、H2SO4和HNO3都属于酸D、Na2O和Na2SiO3都属于氧化物
2.(2010年北京春季)关于CuSO4溶液和Fe(OH)3胶体描述正确的是(C)
A.两者都能产生丁达尔现象
B.两者都不能产生丁达尔现象
C.CuSO4溶液不能产生丁达尔现象,Fe(OH)3胶体能产生丁达尔现象
D.CuSO4溶液能产生丁达尔现象,Fe(OH)3胶体不能产生丁达尔现象
3.(2010年江苏)下列反应的离子方程式书写正确的是(B)
A.钠和水反应Na+H2O=Na++OH-+H2↑
B.盐酸与氢氧化钠溶液反应H++OH-=H2O
C.三氯化铁腐蚀印刷线路板Fe3++Cu=Fe2++Cu2+
D.盐酸与碳酸钙反应制备二氧化碳CO32-+2H+=CO2↑+H2O
4.(2010年宁夏)下列各组中的离子,能在溶液中大量共存的是(D)
A.H+、Na+、Cl一、CO32-B.Na+、Cl一、Ba2+、SO42-
C.H+、K+、OH-、SO42-D.H+、Al3+、Ag+、NO3-
5.(2009年湖南)下列化学反应中,属于氧化还原反应的是(C)
A.SO3+H2O==H2SO4B.CaCO3====CaO+CO2↑
C.Zn+H2SO4==ZnSO4+H2↑D.AgNO3+HCl==AgCl↓+HNO3
知识归纳
1.简单分类法及其应用(参见2009年要点解读)
⑴物质分类的方法
①纯净物与混合物的区别
纯净物
混合物
有固定的组成和结构
有一定的熔、沸点
保持一种物质的性质
无固定组成和结构
无一定的熔、沸点
保持原有物质各自的化学性质
②物质分类的多种角度
⑵化学反应分类的方法
①四种基本反应类型
反应类型
举例
表示式
化合反应
C+O2
CO2
A+B==AB
分解反应
CaCO3
CaO+CO2↑
AB==A+B
置换反应
C+CuO
Cu+CO↑
A+BC==AC+B
复分解反应
AgNO3+NaCl==AgCl↓+NaNO3
AB+CD==AD+CB
②根据化合价是否变化——氧化还原反应和非氧化还原反应
③四种基本反应类型与氧化还原反应(或非氧化还原反应)的关系
④根据反应中是否有离子参与——离子反应和分子反应
【例题1】对下列化学反应从不同的角度进行分类:
①碳在氧气中燃烧;②硫在氧气中燃烧;③铁丝在氧气中燃烧;④铝粉在氧气中燃烧;⑤蜡烛在氧气中燃烧。
解析:
根据反应的特点及反应物质的类别等进行分类。
答案是:
分类标准1:
是不是化合反应。
反应①②③④是一类,都是化合反应;反应⑤为一类。
分类标准2:
反应物的特点。
反应①②为一类,都是非金属跟氧气反应,反应③④为一类,都是金属跟氧气反应,反应⑤为一类;分类标准3:
反应物的特点。
反应①②③④为一类,都是无机物(或单质)跟氧气反应,反应⑤为一类;……
2.分散系及其分类
分散系
⑴定义:
一种(或几种)物质以粒子形式分散到另一种物质里所形成的混合物。
⑵组成:
分散质——被分散成微粒的物质
分散剂——微粒分散在其中的物质
把一种(或多种)物质分散在另一种(或多种)物质中所得
到的体系,叫做分散系。
前者属于被分散的物质,称作分散质;
后者起容纳分散质的作用,称作分散剂。
溶液是一种分散系,其中溶质属于分散质,溶剂属于分散
剂。
悬浮液和乳浊液也是分散系,例如泥水中的水是分散
剂,泥土小颗粒是分散质,根据分散质和分散剂所处的状
态,它们之间有9种组合方式。
9种分散系
⑶分类:
分散系
溶液
胶体
悬(乳)浊液
分散系粒子的直径
<1nm
1nm~100nm
>100nm
分散质粒子的组成
小分子或离子
大分子或分子集合体
许多分子的集合体
外观
均一、透明
大多均一、透明
不均一、不透明
能否透过滤纸
能
能
一般不能
能否透过半透膜
能
不能
不能
实例
食盐水、糖水
淀粉胶体、Fe(OH)3胶体
泥水
⑷胶体
①胶体的本质特征:
分散质微粒的直径在1nm~100nm之间。
胶体是以分散质粒子大小为特征的,它只是物质的一种存在形式,如NaCl溶于水形成溶液,如果分散在酒精中可形成胶体。
可见,同种分散质在不同的分散剂中可以得到不同的分散系。
②胶体的性质
现象
定义
解释
应用
丁达尔现象
光束通过胶体时,形成光亮的通路的现象
胶体分散质的粒子比溶液中溶质的微粒大,使光波发生散射
区别溶液和胶体
布朗运动
在超显微镜下可观察到胶体粒子在做不停的、无秩序的运动,叫做布朗运动
水分子从各个方向撞击胶体粒子,而每一瞬间胶体粒子在不同方向受的力是不相同的
——
电泳现象
在外加电场的作用下,胶体粒子在分散剂里向电极做定向移动的现象
胶体粒子具有相对较大的表面积,能吸附离子而带电荷
分离蛋白质、氨基酸;血清电泳用于诊断疾病;电泳电镀
聚沉
中和胶体粒子所带的电荷,使胶体粒子聚集长大,形成颗粒较大的沉淀从分散剂里析出的过程
胶体粒子带电,加电解质或带相反电荷的胶体,中和了胶体粒子所带的电荷,从而使分散质聚集成较大的微粒,在重力作用下沉淀析出
制豆腐、果冻等
③胶体的分类
类型
分散剂状态
实例
固溶胶
固态
有色玻璃、烟水晶
液溶胶
液态
淀粉溶液、Fe(OH)3胶体
气溶胶
气态
烟、云、雾
④胶体稳定存在的原因
胶体粒子具有相对较大的表面积,能吸附离子而带电荷,所以胶体粒子带电。
同种胶体粒子带同种电荷,互相排斥而稳定存在。
一般说来,金属的氢氧化物、金属氧化物的胶体粒子带正电荷;非金属氧化物、金属硫化物、硅酸胶体的胶体粒子带负电荷。
⑤净化胶体的方法——渗析法
将胶体放入半透膜袋里,再将此袋放入水中,胶粒不能透过半透膜,而分子、离子可以透过半透膜,从而使杂质分子或离子进入水中而除去。
⑥胶体的应用:
土壤的保肥作用、制豆腐的化学原理、江河入海口处形成三角洲、明矾净水等。
注意:
①胶体中的分散质——可以是单个分子或离子或分子集合体
②胶体聚沉后一般情况下都生成沉淀,但有些胶体聚沉后,胶体粒子和分散剂凝聚在一起,成为不流动的冻状物,这类物质叫凝胶。
③电泳现象是由于胶体能带有电荷,在外加电场作用下能向阳极或阴极移动。
而有些胶体如淀粉溶液,胶粒为中性分子,无电泳现象。
【例题2】“纳米材料”是指粒子直径在几纳米到几十纳米的材料。
如将“纳米材料”分散到液体分散剂中,所得混合物具有的性质是:
A.不能透过滤纸B.有丁达尔效应产生
C.所得液体一定无色透明D.不稳定、很快会分层
解析:
纳米材料粒子的直径在1nm~100nm之间,因此所形成的分散系属于胶体,具有胶体的特性,如产生丁达尔效应,粒子可以透过滤纸等。
液态胶体在外观上和溶液相似,比较稳定、透明,但不一定无色。
答案是B。
3.酸、碱、盐在水溶液中的电离
⑴.电离、电离方程式
①电离:
酸、碱、盐等溶于水或受热熔化时,离解成能够自由移动的离子的过程。
②电离方程式:
表示电解质电离的化学方程式。
⑵.电解质与非电解质的区别
电解质
非电解质
定义
在水溶液里或熔融状态下能导电的化合物
在水溶液里和熔融状态下都不导电的化合物
化合物类型
离子化合物(强碱、盐),强极性共价化合物
非极性共价化合物、弱极性共价化合物、大多数有机物
能否直接电离
溶于水或熔融时,直接能电离
溶于水或熔融时,不能直接导电
通电时的现象
溶于水或熔融时能导电
溶于水或熔融时不能导电
实例
H2SO4、HF、CaO等
SO3、NH3、CH4等
⑶.强弱电解质的区别
强电解质
弱电解质
相同点
都是电解质,在水溶液中都能电离,都能导电,与溶解度无关
不
同
点
电离程度
完全电离
部分电离
电离过程
不可逆过程
可逆过程,存在电离平衡
表示方法
电离方程式用“==”
电离方程式用“
”
水溶液中微粒存在形式
电离出的阴、阳离子,不存在电解质分子
既有电离出的阴、阳离子,又有电解质分子
实例
绝大多数盐:
NaCl、BaSO4等。
强酸:
H2SO4、HCl、HClO4等。
强碱:
Ba(OH)2、Ca(OH)2等。
弱酸:
H2CO3、CH3COOH等。
弱碱:
NH3·H2O、Cu(OH)2等。
极少数盐。
【例题3】下列电离方程式中,正确的是D
ACaOH2==Ca2++2OHBFeCl2==Fe2++3Cl
CH2SO4==
+
DAl2SO43==2Al3++3
4.离子反应及其发生的条件
⑴.电解质在水溶液中反应的实质
多种电解质在水溶液中发生电离,产生能够自由移动的离子,不同离子之间发生反应生成沉淀、气体、水等。
①离子反应:
在溶液中或熔融状态时自由移动的离子之间的反应。
②离子反应发生的条件(离子不能大量共存的规律)——物质之间能发生复分解反应
生成难溶物或微溶物:
如Ba2+与CO32-、Ag+与Br-、Ca2+与SO42-、Ca2+与OH-、Mg2+与CO32-、OH-等之间发生离子反应。
生成气体或挥发性物质:
如NH4+与OH-,H+与OH-、CO32-、HCO3-、S2-、HS-、HSO3-、SO32-等之间发生离子反应。
生成弱电解质:
如H+与CH3COO-、CO32-、S2-、SO32-、F-等生成弱酸;OH-与NH4+、Cu2+、Fe3+等生成弱碱;H+与OH-生成水(水也是种弱电解质)。
⑵.离子方程式
①定义:
用实际参加反应的离子符号来表示反应的式子叫做离子方程式
②离子方程式的意义:
不仅表示某一个具体的化学反应,而且表示同一类型的离子反应。
如所有的强酸溶液和所有的强碱溶液反应生成可溶性盐和水都可用H++OH-=H2O来表示。
书写离子方程式的步骤:
写:
写出正确的化学方程式;
拆:
将化学方程式中易溶解于水且能完全电离的物质拆写成阴、阳离子符号;而难溶于水的物质、气态物质和水仍用化学式表示;
删:
删去方程式等号两边重复的离子;
查:
检查是否满足元素原子守恒、反应前后电荷守恒等。
书写离子方程式的方法:
化学式与离子符号使用要正确,其规律是:
一般易溶于水的强酸(H2SO4、HNO3、HCl、HBr、HI)、强碱(NaOH、KOH、Ba(OH)2、Ca(OH)2)、大多数可溶性盐均写成离子符号(拆);而单质、氧化物、弱电解质、非电解质极难溶于水的物质均写成化学式(不拆)。
微溶物有时拆,有时不拆。
例:
稀H2SO4与Ba(OH)2溶液反应
H++OH-===H2O(错误)
Ba2++SO42-===BaSO4↓(错误)
H++OH-+Ba2++SO42-===BaSO4↓+H2O(错误,不符合反应实际)
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O(正确)
判断离子方程式书写是否正确,注意两守恒:
方程式两边的原子数、电子数必须守恒。
若是氧化还原反应,还须遵守得失电子守恒。
例:
铁与FeCl3溶液反应
Fe+Fe3+===2Fe2+(错误,电荷未平)
Fe+2Fe3+===3Fe2+(正确)
Ⅰ、离子反应是在溶液中或熔融状态时进行的反应,凡非溶液中进行的反应一般不能写离子方程式,亦即没有自由移动离子参加的反应,不能写离子方程式。
例:
NH4Cl固体和Ca(OH)2固体混合加热,虽然也有离子和离子反应,但不能写成离子方程式,只能写化学方程式。
OH—+2NH4+
H2O+NH3↑(错误,反应物是固体,虽是强电解质不能拆)
Ca(OH)2+2NH4Cl
CaCl2+2H2O+2NH3↑(正确)
Ⅱ、单质、氧化物在离子方程式中一律写化学式;弱酸(HF、H2S、HClO、H2SO3等)、弱碱(如NH3·H2O)等难电离的物质必须写化学式;难溶于水的物质(如CaCO3、BaSO4、FeS、PbS、BaSO3、Fe(OH)3等)必须写化学式。
例:
碳酸钙与乙酸反应(弱电解质、难溶物不能拆)
CaCO3+2CH3COO—+H+==Ca2++2CH3COO-+H2O+CO2↑(错误,弱电解质不能拆)
CO32—+2CH3COOH==2CH3COO-+H2O+CO2↑(错误,难溶物不能拆)
CaCO3+2CH3COOH==Ca2++2CH3COO-+H2O+CO2↑(正确)
例:
氯气与水反应
Cl2+H2O===2H++Cl-+ClO-(错误,弱酸不能拆)
Cl2+H2O===H++Cl-+HClO(正确)
Ⅲ、多元弱酸的酸式盐的酸根离子在离子方程式中不能拆开写;强酸的酸式根在离子方程式中要拆开写。
例:
NaHSO3溶液和稀硫酸反应为:
HSO3-+H+=SO2↑+H2O;
NaHSO4溶液和NaOH溶液反应的离子方程式为:
H++OH-==H2O。
例:
NaHCO3溶液与NaOH溶液反应
H++OH-===H2O(错误,HCO3—酸式弱酸根不能再拆)
HCO3—+OH—===CO32—+H2O(正确)
Ⅳ、对于微溶物的处理有三种情况:
在生成物中有微溶物[如Ag2SO4、CaSO4、Ca(OH)2]析出时,微溶物用化学式表示;当反应物里有微溶物处于溶液状态(稀溶液),应写成离子的形式。
当反应物里有微溶物处于浊液或固态时,应写成化学式。
例:
CO2气体通人澄清石灰水中:
CO2+Ca2++2OH-=CaCO3↓+H2O;
在石灰乳中加入Na2CO3溶液:
Ca(OH)2+CO32-==CaCO3↓+2OH-。
⑶与量有关的复杂的离子方程式
①NaOH溶液与少量Ca(HCO3)2溶液反应:
2OH-+Ca2++2HCO3-===CaCO3↓+2H2O+CO32—
NaOH溶液加入过量Ca(HCO3)2溶液反应:
OH-+Ca2++HCO3-===CaCO3↓+2H2O
②NaHSO4溶液中加入过量的Ba(OH)2溶液
H++OH-+Ba2++SO42===BaSO4↓+H2O
NaHSO4溶液中加入少量的Ba(OH)2溶液
2H++SO42+2OH-+Ba2+===BaSO4↓+2H2O
③FeBr2溶液通入过量氯水
2Fe2++4Br—+3Cl2===2Fe3++2Br2+6Cl-
FeBr2溶液通入少量氯水
2Fe2++Cl2===2Fe3++2Cl—
【例题4】有下列物质A.CO2;B.稀盐酸;C.BaCO3;D.NaOH;E.铜。
是电解质的有:
;写出B和C反应的离子方程式:
;
解析:
本题能力层次为C,稀盐酸是混合物,铜是金属单质,CO2是非金属氧化物,它们都不属于电解质,答案是C、D;BaCO3+2H+=Ba2++H2O+CO2↑;
5.离子共存
下列几种情况离子反应能够发生,那么这些离子就不能大量共存。
①生成难溶物质。
如:
Cu2+和OH-不能大量共存:
Cu2++2OH-=Cu(OH)2↓
②生成挥发性的物质。
如:
CO32-和H+不能大量共存:
CO32-+2H+=H2O+CO2↑
③生成水(难电离的物质)。
如:
H+和OH-不能大量共存:
H++OH-=H2O
离子共存题易错点:
⑴在题目中告知是无色溶液,应排除具有颜色的离子
Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO4—(紫色)等离子。
⑵忽视因发生氧化还原而不能共存
如:
ClO—与I—、SO32—、S2—,酸性条件下ClO—与Cl—,酸性条件下NO3—与Fe2+,酸性条件下SO32—与S2—,酸性条件下MnO4—与Cl—。
⑶多元弱酸的酸式酸根离子不能与H+、OH—大量共存
HCO3—、HSO3-、
【例题5】(2010年江苏省)在溶液中能大量共存的离子组是(A)
A.
、
、
B.
C.
D.
6.氧化还原反应
1).元素化合价在化学反应中的变化(B)
⑴氧化还原反应:
凡有元素化合价升降的化学反应就是氧化还原反应。
氧化反应:
在氧化还原反应中,反应物所含元素化合价升高的反应称为氧化反应;
还原反应:
在氧化还原反应中,反应物所含元素化合价降低的反应称为还原反应。
非氧化还原反应:
凡没有元素化合价升降的化学反应,就是非氧化还原反应。
⑵氧化还原反应特征(判别方法):
化合价发生变化。
2).氧化还原反应的实质(B)
⑴元素化合价升降的实质:
化合价升高,该元素原子在反应中失去电子;化合价降低,该元素原子在反应中得到电子。
⑵氧化还原反应的本质:
反应过程中有电子得失(或偏移)。
3).氧化剂和还原剂(C)
⑴定义:
①从化合价角度定义:
在氧化还原反应中,所含元素的化合价降低的反应物,称为氧化剂;在氧化还原反应中,所含元素的化合价升高的反应物,称为还原剂。
②从电子转移角度定义:
在氧化还原反应中,得到电子(或电子偏近)的反应物,称为氧化剂;在氧化还原反应中,失去电子(或电子偏离)的反应物,称为还原剂。
⑵常见的氧化剂和还原剂
⑶价态与氧化剂、还原剂的关系:
①元素为最低价态时,只具有还原性。
I-,S2-等。
②元素为最高价态时,只具有氧化性。
Fe3+,H+,S+6等。
③元素处于中间价态时,既具有氧化性,又具有还原性。
如S、SO2,Fe2+,I2,H2O2。
⑷一般来说,氧化性:
氧化剂>氧化产物;还原性:
还原剂>还原产物。
4).电子转移方向和数目的表示方法
失去2×e-
双桥式:
箭头由反应物指向生成物中化合价有变化的同一种元素,标出“得到”“失去”及电子总数:
CuO+H2
Cu+H2O
得到2e-
单桥式:
在反应物间用箭头由失去电子的原子指向得到电子的原子,只标出电子总数:
2e-
CuO+H2
Cu+H2O
【例题5】写出符合下列条件的氧化还原反应方程式
A.一种单质氧化另一种单质
B.一种单质氧化一种化合物
C.一种化合物氧化另一种化合物
D.一种化合物氧化一种单质
解析:
本题能力层次为C。
甲物质氧化乙物质时,甲物质得到电子,有元素的化合价降低,乙物质失去电子,有元素的化合价升高。
参考答案是A.C+O2
CO2,B.2CO+O2
2CO2,C.MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,D.CuO+H2
Cu+H2O。
巩固练习
1.下列物质属于纯净物的是A
A.液氯B.漂白粉C.盐酸D.碘酒
2.(2010年湖南)有关物质的分类中,说法错误的是C
A、KNO3属于硝酸盐B、CaO属于氧化物
C、NaHCO3属于酸D、Na2CO3属于钠盐
3.下列不存在丁达尔效应的分散系是①有尘埃的空气、②溴水、③蒸馏水、④沸水中加几滴FeCl3浓溶液、⑤淀粉溶液C
A.②B.②③⑤C.②③D.①②③⑤
4.将某溶液逐滴加入Fe(OH)3溶胶内,开始时产生沉淀,继续滴加时沉淀又溶解,则该溶液是A
A.2mol/L的H2SO4溶液 B.2mol/L的NaOH溶液
C.2mol/L的MgSO4溶液 D.硅酸溶胶
5.加入NaOH溶液后,下列溶液中哪种离子数目会减少D
A.CO32-B.Fe3+C.SO42-D.H+
6.(2009年四川)在溶液中能大量共存的离子组是D
A.K+、NH4+、Cl—、OH—B.Na+、H+、SO42—、CO32—
C.Mg2+、K+、SO42—、OH—D.Ba2+、Cu2+、Cl—、NO3—
7.下列各组中的离子因发生氧化还原反应而不能大量共存的是C
A.H+、Na+、SO
、Cl-B.Ca2+、K+、S2-、CO
C.Fe2+、H+、Cl-、NO
D.HCO
、Br-、OH-、SO
8.下列关于氧化还原反应说法正确的是(C)
A.肯定一种元素被氧化,另一种元素被还原
B.某元素从化合态变成游离态,该元素一定被还原
C.在反应中不一定所有元素的化合价都发生变化
D.在氧化还原反应中非金属单质一定是氧化剂
9.能正确表示下列化学反应的离子方程式的是D
A.氢氧化钡溶液与硫酸的反应OH—+H+=H2O
B.澄清的石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O
C.铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag
D.碳酸钙溶于稀盐酸中CaCO3+2H+=Ca2++H2O+CO2
10.(2010年江苏省)高铁酸钾(
)是一种新型、高效、多功能水处理剂。
下列反应可制取
:
D
2
+3
+10KOH
2
+6KCl+8H2O
对于该反应,下列说法正确的是
A.该反应是置换反应B.钾元素化合价降低
C.
发生还原反应D.
是氧化剂
11.(2010年湖南)下列反应中,不属于氧化还原反应的是C
A、锌和硫酸反应:
Zn+H2SO4=ZnSO4+H2
B、碳酸钙和盐酸反应:
CaCO3+2HCl=CaCl2+CO2+H2O
C、过氧化钠和水反应:
2Na2O2+2H2O=4NaOH+O2
D、铁和硫酸铜溶液反应:
Fe+CuSO4=FeSO4+Cu
12.根据反应式:
①2Fe3++2I-===2Fe2++I2;②Br2+2Fe2+===2Br-+2Fe3+,可判断离子的还原性从强到弱的顺序是B
A.Br-、Fe2+、I-B.I-、Fe2+、Br-
C.Br-、I-、Fe2+D.Fe2+、I-、Br-
13.(2010年东城区模拟)
(1)实验室利用右图来制备氨气,该反应的化学方程式是____________________________________________________,可以用
____________________法收集氨气;氨气能使湿润的酚酞试纸变红,
氨气与水反应的方程式是___________________________________。
(2)下列物质含有少量杂质,请在空格中填上适宜的试剂将杂质除去,并写出相应的方程式(是离子反应的写离子方程式)。
物质
杂质
试剂
化学(离子)方程式
①CO2
HCl
②Fe(OH)3
Al(OH)3
③CH4
CH2=CH2
(1)2NH4Cl+Ca(O