CTD制剂部分学习之骨架篇教程文件.docx
《CTD制剂部分学习之骨架篇教程文件.docx》由会员分享,可在线阅读,更多相关《CTD制剂部分学习之骨架篇教程文件.docx(34页珍藏版)》请在冰豆网上搜索。
CTD制剂部分学习之骨架篇教程文件
CTD格式申报资料提交要求
(药学部分:
制剂——骨架篇)
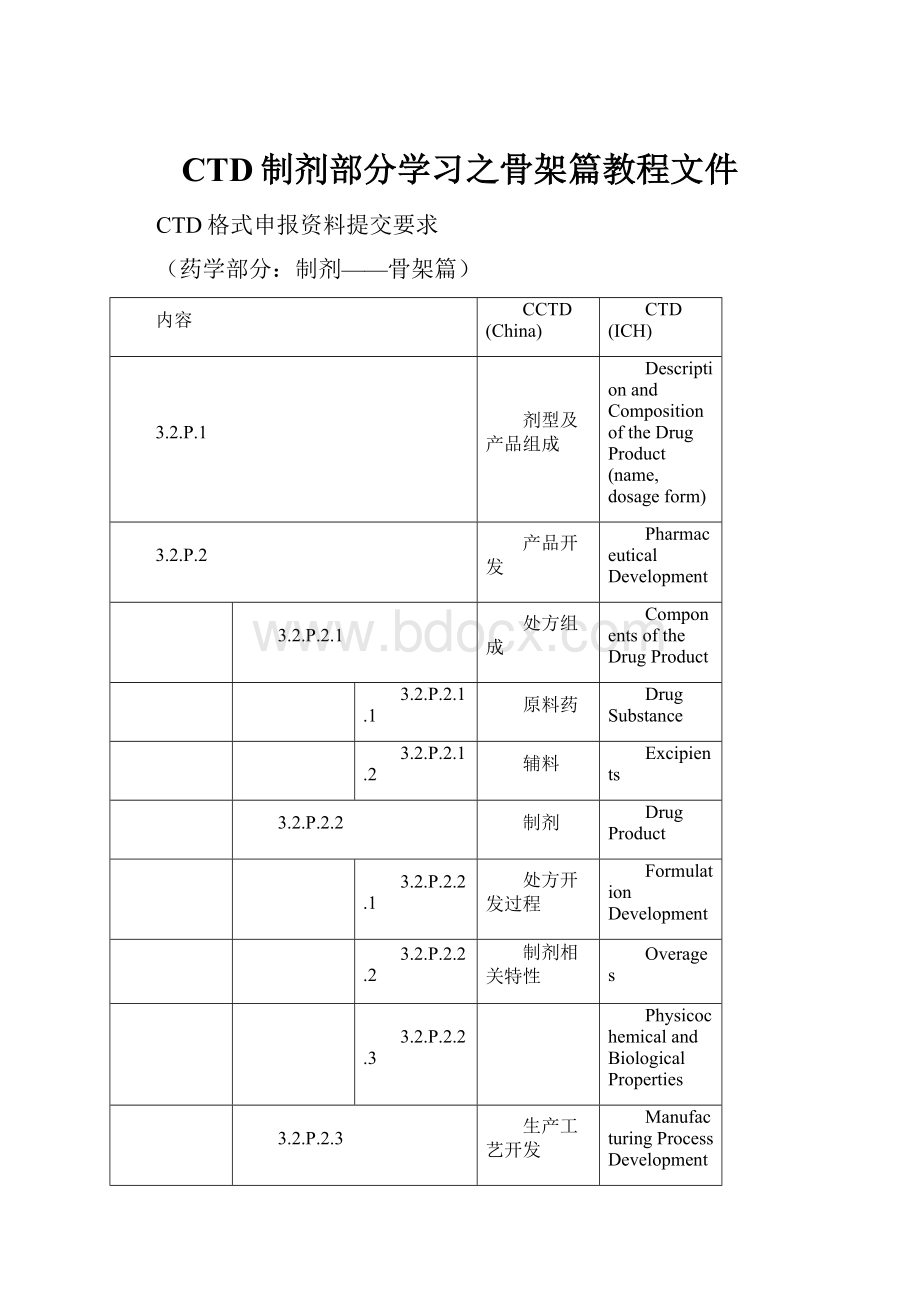
内容
CCTD(China)
CTD(ICH)
3.2.P.1
剂型及产品组成
DescriptionandCompositionoftheDrugProduct(name,dosageform)
3.2.P.2
产品开发
PharmaceuticalDevelopment
3.2.P.2.1
处方组成
ComponentsoftheDrugProduct
3.2.P.2.1.1
原料药
DrugSubstance
3.2.P.2.1.2
辅料
Excipients
3.2.P.2.2
制剂
DrugProduct
3.2.P.2.2.1
处方开发过程
FormulationDevelopment
3.2.P.2.2.2
制剂相关特性
Overages
3.2.P.2.2.3
PhysicochemicalandBiologicalProperties
3.2.P.2.3
生产工艺开发
ManufacturingProcessDevelopment
3.2.P.2.4
包装材料容器
ContainerClosureSystem
3.2.P.2.5
相容性
Microbiologicalattributes
3.2.P.2.6
Compatibility
3.2.P.3
生产
Manufacture
3.2.P.3.1
生产商
Manufacturer(s)
3.2.P.3.2
批处方
BatchFormula
3.2.P.3.3
生产工艺和工艺控制
DescriptionofManufacturingProcessandProcessControls
3.2.P.3.4
关键步骤和中间体的控制
ControlsofCriticalStepsandIntermediates
3.2.P.3.5
工艺验证和评价
ProcessValidationand/orEvaluation
3.2.P.4
辅料控制
ControlofExcipients
3.2.P.4.1
Specifications
3.2.P.4.2
Analyticalprocedures
3.2.P.4.3
Validationofanalyticalprocedures
3.2.P.4.4
Justificationofspecifications
3.2.P.4.5
Excipientsofhumanoranimalorigin
3.2.P.4.6
Novelexcipients(reftoA3)
3.2.P.5
制剂控制
ControlofDrugProduct
3.2.P.5.1
质量标准
Specifications
3.2.P.5.2
分析方法
Analyticalprocedures
3.2.P.5.3
分析方法验证
Validationofanalyticalprocedures
3.2.P.5.4
批检验报告
Justificationofspecifications
3.2.P.5.5
杂质分析
CharacterisationofImpurities
3.2.P.5.6
质量标准依据
JustificationofSpecification(s)
3.2.P.6
对照品
ReferenceStandardsorMaterials
3.2.P.7
Containerclosuresystem
3.2.P.8
稳定性
Stability
3.2.P.8.1
稳定性总结
StabilitySummaryandConclusion
3.2.P.8.2
上市后稳定性研究方案和承诺
Post-approvalStabilityProtocolandStability
3.2.P.8.3
稳定性数据
StabilityData
个人定义
CTD:
ICH的要求,英文水平所限,仅罗列上,没有核对。
CCTD:
中国式CTD,主要来自CDE发布的讨论稿模板,和重庆培训的相关内容。
申报资料正文及撰写要求
3.2.P.1剂型及产品组成
CTD
Adescriptionofthedrugproductanditscompositionshouldbeprovided.Theinformationprovidedshouldinclude,forexample:
∙Descriptionofthedosageform;
∙Composition,i.e.,listofallcomponentsofthedosageform,andtheiramountonaper-unitbasis(includingoverages,ifany)thefunctionofthecomponents,andareferencetotheirqualitystandards(e.g.,compendialmonographsormanufacturer’sspecifications)
∙Descriptionofaccompanyingreconstitutiondiluent(s);and
∙Typeofcontainerandclosureusedforthedosageformandaccompanyingreconstitutiondiluent,ifapplicable.
ReferenceICHGuidelines:
Q6AandQ6B
CCTD:
(1)说明具体的剂型,并以表格的方式列出单位剂量产品的处方组成,列明各成份在处方中的作用,执行的标准。
如有过量加入的情况需给予说明。
对于处方中用到但最终需去除的溶剂也应列出。
成份
用量
过量加入
作用
执行标准
工艺中使用到并最终去除的溶剂
(2)如附带专用溶剂,参照以上表格方式列出专用溶剂的处方。
(3)说明产品所使用的包装材料及容器。
举例:
3.2.P.2产品开发
CTD:
ThePharmaceuticalDevelopmentsectionshouldcontaininformationonthedevelopmentstudiesconductedtoestablishthatthedosageform,theformulation,manufacturingprocess,containerclosuresystem,microbiologicalattributesandusageinstructionsareappropriateforthepurposespecifiedintheapplication.Thestudiesdescribedherearedistinguishedfromroutinecontroltestsconductedaccordingtospecifications.Additionally,thissectionshouldidentifyanddescribetheformulationandprocessattributes(criticalparameters)thatcaninfluencebatchreproducibility,productperformanceanddrugproductquality.SupportivedataandresultsfromspecificstudiesorpublishedliteraturecanbeincludedwithinorattachedtothePharmaceuticalDevelopmentsection.Additionalsupportivedatacanbereferencedtotherelevantnonclinicalorclinicalsectionsoftheapplication.
ReferenceICHGuidelines:
Q6AandQ6B
CCTD
提供相关的研究资料或文献资料来论证剂型、处方组成、生产工艺、包装材料选择和确定的合理性,具体为:
应包含为了确定剂型、处方、生产工艺、直接接触药品的包装容器而开展的研究工作;
应确定并描述可影响批次可重复性、产品性能和药品质量的处方和工艺特性(关键参数);
特定研究或已发表文献的支持性数据和结果可列入此章节内或附于此章节;
其他支持性数据可参考申报资料相关非临床或临床章节。
3.2.P.2.1处方组成
3.2.P.2.1.1原料药
CTD:
Thecompatibilityofthedrugsubstancewithexcipientslistedin3.2.P.1shouldbediscussed.Additionally,keyphysicochemicalcharacteristics(e.g.,watercontent,solubility,particlesizedistribution,polymorphicorsolidstateform)ofthedrugsubstancethatcaninfluencetheperformanceofthedrugproductshouldbediscussed.
Forcombinationproducts,thecompatibilityofdrugsubstanceswitheachothershouldbediscussed.
CCTD:
参照《化学药物制剂研究的技术指导原则》,提供资料说明原料药和辅料的相容性,根据药物稳定性、拟考察的制备工艺,选择可靠的分析方法,有针对性的进行研究。
复方制剂还要说明两种成分的相容性,根据药物特性,剂型特点选择工艺制备方法,如混合制粒还是分开制粒。
分析与制剂生产及制剂性能相关的原料药的关键理化特性
晶型
溶解性:
不同pH、不同溶剂;结合渗透性了解药物的生物药剂学分类(BCS)
吸湿性
粒度分布粒度与制剂工艺、溶出或释放行为、生物利用度,进行批汇总分析。
尤其是难溶性药物。
3.2.P.2.1.2辅料
CTD:
Thechoiceofexcipientslistedin3.2.P.1,theirconcentration,theircharacteristicsthatcaninfluencethedrugproductperformanceshouldbediscussedrelativetotheirrespectivefunctions.
CCTD:
说明辅料种类和用量选择的依据,分析辅料用量是否在常规用量范围内,是否适合所用的给药途径,并结合辅料在处方中的作用分析辅料的哪些性质会影响制剂特性。
辅料选择:
符合药用要求,注射剂辅料应符合注射用要求;
不应与主药发生不良相互作用;
根据制剂需要选择必要的辅料。
3.2.P.2.2制剂研究
3.2.P.2.2.1处方开发过程
CTD:
Abriefsummarydescribingthedevelopmentofthedrugproductshouldbeprovided,takingintoconsiderationtheproposedrouteofadministrationandusage.Thedifferencesbetweenclinicalformulationsandtheformulation(i.e.composition)describedin3.2.P.1shouldbediscussed.Resultsfromcomparativeinvitrostudies(e.g.,dissolution)orcomparativeinvivostudies(e.g.,bioequivalence)shouldbediscussedwhenappropriate.
CCTD:
参照《化学药物制剂研究的技术指导原则》,提供处方的研究开发过程和确定依据,包括文献信息(如对照药品的处方信息)、研究信息(包括处方设计,处方筛选和优化、处方确定等研究内容)以及与对照药品的质量特性对比研究结果(需说明对照药品的来源、批次和有效期,自研样品批次,对比项目、采用方法),并重点说明在药品开发阶段中处方组成的主要变更、原因以及支持变化的验证研究。
如生产中存在过量投料的问题,应说明并分析过量投料的必要性和合理性,并提供支持性资料,如重复批次验证,数据验证。
关注点:
处方设计思路及预期达到目标
处方筛选、优化及处方确定,与对照药品进行质量对比研究:
基于前期对药物、辅料考察有针对性设计,系统设计各种处方进行筛选研究;进行制剂基本性能评价和稳定性评价(考察影响质量和稳定性的关键项目,关注制剂的个性化指标考察);确定影响制剂质量的关键因素。
处方筛选可以是实验室小规模,但要注意小试、中试放大、处方转移研究开发阶段的处方变化情况,重点讨论临床试验用处方和3.2.P.1中处方之间的差异,进行支持变化的验证研究。
3.2.P.2.2.2overages
CTD:
Anyoveragesintheformulation(s)describedin3.2.P.1shouldbejustified.
3.2.P.2.2.3制剂相关特性
CTD:
Parametersrelevanttotheperformanceofthedrugproduct,suchaspH,ionicstrength,dissolution,redispersion,reconstitution,particlesizedistribution,aggregation,polymorphism,rheologicalproperties,biologicalactivityorpotency,and/orimmunologicalactivity,shouldbeaddressed.
CCTD
对与制剂性能相关的理化性质,如pH,离子强度,溶出度,再分散性,复溶、粒径分布、聚合、多晶型、流变学等进行分析。
提供自研产品与对照药品在处方开发过程中进行的质量特性对比研究结果,例如有关物质等。
如为口服固体制剂,需提供详细的自研产品与对照药品在不同溶出条件下的溶出曲线比较研究结果,推荐采用f2相似因子的比较方式。
3.2.P.2.3生产工艺的开发
CTD:
Theselectionandoptimisationofthemanufacturingprocessdescribedin3.2.P.3.3,inparticularitscriticalaspects,shouldbeexplained.Whererelevant,themethodofsterilisationshouldbeexplainedandjustified.
Differencesbetweenthemanufacturingprocess(es)usedtoproducepivotalclinicalbatchesandtheprocessdescribedin3.2.P.3.3thatcaninfluencetheperformanceoftheproductshouldbediscussed.
CCTD:
简述生产工艺的选择和优化过程,生产工艺的选择优化,特别是生产过程的关键方面:
结合剂型特点、药物及辅料的理化性质、拟达到的质量指标设计和选择工艺,如遇湿热不稳定,工艺应避免水分、热的影响;制剂工艺设计和选择应充分考虑工业化放大生产的可行性;注意考察工艺各环节对产品质量的影响,确定制备工艺关键环节,建立相应质控参数。
重点描述工艺研究的主要变更(包括批量、设备、工艺参数等的变化)及相关的支持性验证研究:
技术转移、产地转移;设备变更、参数变化。
汇总研发过程中代表性批次(应包括但不限于临床研究批、中试放大批、生产现场检查批、工艺验证批等)的样品情况,包括:
批号、生产时间及地点、批规模、用途(如用于稳定性试验,用于生物等效性试验等)、分析结果(例如有关物质、溶出度以及其他主要质量指标)。
举例
批分析汇总
批号
生产日期
生产地点
规模
收率
样品用途
样品质量
含量
杂质
其它指标
根本不知道□
、DIY手工艺市场现状分析
(二)创业优势分析
可是创业不是一朝一夕的事,在创业过程中会遇到很多令人难以想象的疑难杂症,对我们这些80年代出生的温室小花朵来说,更是难上加难。
4、如果学校开设一家DIY手工艺制品店,你是否会经常去光顾?
创业首先要有“风险意识”,要能承受住风险和失败。
还要有责任感,要对公司、员工、投资者负责。
务实精神也必不可少,必须踏实做事;
“碧芝自制饰品店”拥有丰富的不可替代的异国风采和吸引人的魅力,理由是如此的简单:
世界是每一个国家和民族都有自己的饰品文化,将其汇集进行再组合可以无穷繁衍。
“碧芝”最吸引人的是那些小巧的珠子、亮片等,都是平日里不常见的。
店长梁小姐介绍,店内的饰珠有威尼斯印第安的玻璃珠、秘鲁的陶珠、奥利的施华洛世奇水晶、法国的仿金片、日本的梦幻珠等,五彩缤纷,流光异彩。
按照饰珠的质地可分为玻璃、骨质、角质、陶制、水晶、仿金、木制等种类,其造型更是千姿百态:
珠型、圆柱型、动物造型、多边形、图腾形象等,美不胜收。
全部都是进口的,从几毛钱一个到几十元一个的珠子,做一个成品饰物大约需要几十元,当然,还要决定于你的心意。
“碧芝”提倡自己制作:
端个特制的盘子到柜台前,按自己的构思选取喜爱的饰珠和配件,再把它们串成成品。
这里的饰珠和配件的价格随质地而各有同,所用的线绳价格从几元到一二十元不等,如果让店员帮忙串制,还要收取10%~20%的手工费。
喜欢□一般□不喜欢□
(四)大学生对手工艺制品消费的要求
3.2.P.2.4包装材料/容器
CTD
Thesuitabilityofthecontainerclosuresystem(describedin3.2.P.7)usedforthestorage,transportation(shipping)anduseofthedrugproductshouldbediscussed.Thisdiscussionshouldconsider,e.g.,choiceofmaterials,protectionfrommoistureandlight,compatibilityofthematerialsofconstructionwiththedosageform(includingsorptiontocontainerandleaching)safetyofmaterialsofconstruction,andperformance(suchasreproducibilityofthedosedeliveryfromthedevicewhenpresentedaspartofthedrugproduct).
CCTD:
(1)、包材类型、来源及相关证明文件,提供包材的检验报告(可来自包材生产商或供应商):
项目
包装容器
配件注2
包材类型注1
包材生产商
包材注册证号
包材注册证有效期
包材质量标准编号
注1:
关于包材类型,需写明结构材料、规格等。
例如,五层共挤膜输液袋,规格为内层:
改性乙烯/丙烯聚合物,第二层:
聚乙烯,第三层:
聚乙烯,第四层:
乙烯甲基丙烯酸酯聚合物,第五层:
多酯共聚物;聚丙烯输液瓶,规格为250ml;
铝塑泡罩包装,组成为:
3.2.PVC/铝、3.2.PVC/3.2.PE/3.2.PVDC/铝、3.2.PVC/3.2.PVDC/铝;
复合膜袋包装,组成为:
聚酯/铝/聚乙烯复合膜袋、聚酯/低密度聚乙烯复合膜袋。
注2:
表中的配件一栏应包括所有使用的直接接触药品的包材配件。
如:
塑料输液容器用组合盖、塑料输液容器用接口等。
(2)阐述包材的选择依据
(3)描述针对所选用包材进行的支持性研究
在常规制剂稳定性考察基础上,需考虑必要的相容性研究,特别是风险高的制剂(如注射剂、吸入气雾剂等)、含有有机溶剂的液体制剂或半固体制剂。
一方面可以根据迁移试验结果,考察包装材料中的成分(尤其是包材的添加剂成分)是否会渗出至药品中,引起产品质量的变化;另一方面可以根据吸附试验结果,考察是否会由于包材的吸附/渗出而导致药品浓度的改变、产生沉淀等,从而引起安全性担忧。
可提取物通过一定的提取溶剂和/或提取条件可以从塑料或系统中提取的物质。
上述提取溶剂和提取条件应至少与材料/系统和最终药物制剂之间的接触条件同样苛刻。
材料特性/估计对产品的影响
可浸出物由于在预期应用过程中与塑料材料或系统的相互作用而存在于最终药物制剂中的物质。
产品特性/实际对产品的影响。
3.2.P.2.5MicrobiologicalAttributes
CTD
Whereappropriate,themicrobiologicalattributesofthedosageformshouldbediscussed,including,forexample,therationalefornotperformingmicrobiallimitstestingfornon-sterileproductsandtheselectionandeffectivenessofpr