届高考化学二轮复习实验题必练晶体与晶胞.docx
《届高考化学二轮复习实验题必练晶体与晶胞.docx》由会员分享,可在线阅读,更多相关《届高考化学二轮复习实验题必练晶体与晶胞.docx(31页珍藏版)》请在冰豆网上搜索。
届高考化学二轮复习实验题必练晶体与晶胞
2020届高考化学二轮复习实验题必练-晶体与晶胞
1.
人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化碳、聚乙烯、二氧化硅等17种“分子”改变过人类的世界.
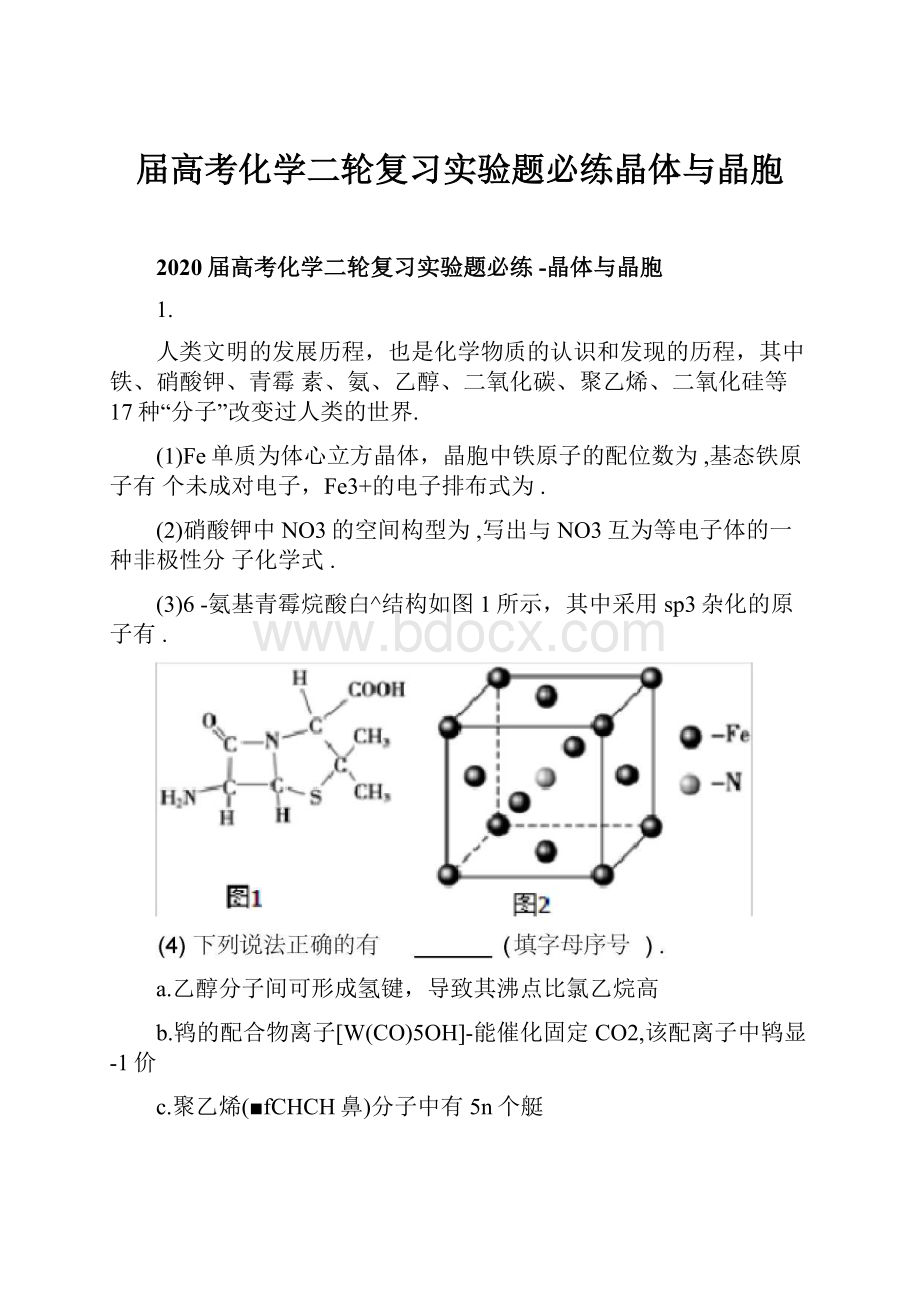
(1)Fe单质为体心立方晶体,晶胞中铁原子的配位数为,基态铁原子有个未成对电子,Fe3+的电子排布式为.
(2)硝酸钾中NO3的空间构型为,写出与NO3互为等电子体的一种非极性分子化学式.
(3)6-氨基青霉烷酸白^结构如图1所示,其中采用sp3杂化的原子有.
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.鸨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中鸨显-1价
c.聚乙烯(■fCHCH鼻)分子中有5n个艇
d.由下表中数据可确定在反应Si(s)+O2(g)=SiO2(s)中,每生成60gSiO2放出的能
量为(2c-a-b)kJ
化学键
Si-Si
O=
O
Si-O
键能(kJ?
mol-1)
a
b
c
(5)铁和氨气在640c可发生置换反应,产物之一的晶胞结构如图2所示,写出该反
应的化学方程式,若两个最近的Fe原子间的距离为scm,则该晶体的密度是g?
cm-3.
2.
有机反应中常用馍作催化剂.某化工厂收集的馍催化剂中含Ni64.0%>Al24.3%、
Fe1.4%,其余为SiO2和有机物.这些含馍废催化剂经乙醇洗涤后可按如图1工艺流
程回收馍:
已知:
部分阳离子以氢氧化物形式完全沉淀时的pH如下:
请回答下列问题:
沉淀物
Al(OH)3
Fe(OH)3
Fe(OH)2
Ni(OH)2
pH
5.2
3.2
9.7
9.2
(1)滤液A中存在的阴离子主要是.
(2)硫酸浸取滤渣a后,所得滤液B中可能含有的金属离子是
⑶滤液B中加入H2c2的目的是操彳X的名称是.
(4)含馍金属氢化物MH-Ni燃料电池是一种绿色环保电池,广泛应用于电动汽车,其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液.它
充电
的充、放电反应为:
xNi(OH)2+M?
MHx+xNiOOH;电池充电过程中阳极的电放电
极反应式为,放电时负极的电极反应式为.
(5)一种储氢合金M是由金属例(La)与馍形成的合金,其晶胞结构如图所示,晶胞中心有一个Ni原子,其他Ni原子,都在晶胞面上,该晶体的化学式为.
(6)上述回收馍的过程中,使用akg含馍废催化剂,调pH:
时bkgNi(OH)2,回收过程中,第①〜②步操作馍的损失巨为5%,第④〜⑥步骤的损失率为3%,则最终得到硫酸望晶体(M=281kg/mol)的质量为kg(填计算式).
3.六鼠合铁(出)酸钾K3[Fe(CN)6]俗称赤血盐,在医药工业、业及钢铁工业均有重要作用,请回答下列问题:
(1)赤血盐属于晶体,其中心离子价电子排布式为
(2)K3[Fe(CN)6]中四种组成元素的第一电离能由大到小的排序是,存在的作用力有(填选项序号).
a离子键b.金属4Hc.配位键d.极性共价键e.非极性共价键f.分子间作用力
(3)类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氟酸(H-S-C=N)和异硫氟酸(H-N=C=S),这两种酸中沸点较高的是.
(4)六氟合铁(出)酸钾常温下很稳定,经灼烧可完全分解,产生剧毒的氧化钾和鼠.
化学方程式:
2K3[Fe(CN)6]—6KCN+2FeC2+2N2+(CN)2
①产物鼠(CH)2中含有的避和赧数目比为.
②(CH)2中C原子的杂化轨道类型为,请写出一个与(CH)2具有相同空间构型和原子数的分子:
.
③若KCN的晶胞结构如图所示,则KCN晶体中距离K+最近的K+的数目为,若该晶体的密度为pg?
cm-3,图示中K+与K+的核间距a=cm.
4.请在下面三道化学题中任选一题作答,若选择多题作答,则按第一题计分。
一、【化学——选彳2:
化学与技术】
海洋是一座巨大的宝藏,海洋化学工业把海水淡化和化工生产结合起来,既可解决
淡水资源缺乏的问题,又可充分利用海洋资源,被称为“蓝色化工”。
(1)下列有关海水综合利用的说法中正确是—
A.只需通过物理变化,可从海水中得到钾单质
B.海水通过蒸发可得到淡水,通过蒸储可得到粗盐
C.从海水中可制取澳及其化工产品
D.利用潮汐发电是将化学能转化为电能
(2)常用的海水淡化方法有—法、—法、电渗析法等。
(3)如图是电渗析法淡化海水的原理图。
其中,电极A接直流电源的正极,电极B接直流电源的负极。
反应后B室中得到淡水。
电税nue电
②从某港口采集的海水样品,经分析含有大量的,以及少量的、So若用上述装置
对该港口的海水进行淡化,当淡化工作完成后,A、B、C三室中所得溶液(或液体)
的pH分别为pHa、pHb、pHc。
则其大小顺序为。
③请写出用电渗析法对采自该港口的海水进行淡化处理时所发生的化学反应方程
(4)利用海水精制制得的氯化钠可用于生产纯碱。
其生产流程简要表示如图:
I循环II必-心」
沉淀池中发生的化学反应方程式为,整个生产过程中参与循环的物质有(写化学式)。
二、【化学——选彳3:
物质结构和性质】
CO2是燃烧和代谢的最终产物,也是造成温室效应的废气,但在科学家的眼里,没
有废弃的物质。
C02作为一种资源,开发和利用的前景十务诱人。
(1)在440c和800大气压条件下,二氧化碳和金属钠反应,可将C02还原成金刚石,同时生成一种盐,该反应的化学反应方程式为,该反应中的三种含碳物质里碳原子的杂化方式分别是—杂化、―杂化、—杂化(先写化学式,再写相应的杂化类型),C的立体构型是—。
(2)从结构上讲,O=C=O和H2C=C=CH2是等电子体,它启示人们可以利用C02制取碳酸酯类物质如CH30COOCH3,1mol该物质的分子中含有的键的数目为,制取该物质的另一物质易溶于水的主要原因是。
(3)固体C02俗称干冰,干冰可用于人工降雨的原因是;干冰为面心立方晶体,若其晶胞边长为anm,列式表示该晶体的密度gcm-3(只列出表达式,不必化简)。
(4)金刚石的晶胞如图(均为同种原子),则其中C原子的配位数是—,空间利用率为。
三、【化学——选彳5:
有机化学基础】
人已知某有机物的相对分子质量为58,根据下列条件回答。
①若该有机物为烧,则该煌的分子式为。
②若该有机物为含氧衍生物,分子中既无-CH3,又无-OH,但能与新制的氢氧化
铜碱性悬浊液反应生成红色沉淀,则该有机物的结构简式为。
③若该有机物仍为含氧衍生物,但分子中有-OH,不能与滨水发生加成反应,则
该有机物的结构简式为
(1)A的结构简式可能为。
(2)反应①、③的反应类型分别、。
(3)反应⑥的化学方程式为。
(4)写出用B为原料在一定条件下生成F合成高分子材料的化学方程式—。
(5)这种香料具有多种同分异构体,其中某些同分异构体有下列特征:
①其水溶液遇FeCl3溶液呈现紫色;
②分子中只有苯环(没有其他环),且苯环上的一澳代物只有两种;
③分子中不可能产生顺反异构。
写出所有符合上述条件的同分异构体的结构简式。
5.铁元素不仅可以与SCZ、CN-等离子形成配合物,还可以与CO、NO等分子以及许多有机试剂形成配合物.回答下列问题:
(1)基态铁原子有个未成对电子;
(2)CN-有毒,含CN-的工业废水必须处理,用TiO2作光催化剂可将废水中的CN-转化为OCN-,并最终氧化为N2、CO2
①C、N、O三种元素的第一电离能由大到小的顺序是;
②1molFe(CN)3-中含有艇的数目为;
③铁与CO形成的配合物Fe(CO)3的熔点为-20.5C,沸点为103c,易溶于CCI4,据此可以判断Fe(CO)3晶体属于(填晶体类型)
(3)乙二胺四乙酸能和Fe2+形成稳定的水溶性配合物乙二胺四乙酸铁钠,原理如图1:
①乙二胺四乙酸中碳原子的杂化轨道类型是;
②乙二胺(H2NCH2CH2NH2)和三甲胺[N(CH3)2]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是;
(4)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构
堆砌而成,小立方体如图2所示,则该合金的化学式为,已知小立方体边长为acm,此铁铝合金的密度为g?
cm-3.
6.已知A、B、C、D和E都是元素周期表中前20号的元素,它们的原子序数依次增
大.A与其他4种元素既不在同一周期也不在同一主族.B原子的L层有1对成对
电子且其单质是空气的主要成分.C原子的L层p轨道中有5个电子;D是周期表中1--18列中的第14列元素;D元素原子次外层电子数与最外层电子数之比为2:
1.E跟C可形成离子化合物,其晶胞结构如下图.请回答:
(1)A与D形成的最简单化合物的分子式是,该分子的立体构型是
.该分子属于(填“极性”或“非极性”)分子
(2)C与D形成的化合物晶体类型是.B单质分子中含个罐
个赧
⑶从上图中可以看出,E跟C形成的化合物的化学式为若设该晶胞的边长为acm,则该离子化合物晶体的密度是(只要求列出算式).
(4)电负性(用X表示)也是元素的一种重要性质,下表给出8种元素的电负性数值:
TOft
Na
Mg
Al
Si
P
S
Cl
K
电负性
7.四川含有丰富的矿产资源,钮矿、硫铁矿、铜矿等七种矿产储量位居全国前列.回
答下列问题:
(1)倒在元素周期表中的位置为,V3+的价电子排布图为.
(2)钮的某种氧化物的晶胞结构如图1所示,其晶体的化学式为
⑶V2O5常用作SO2转化为SO3的催化剂.SO2分子中键角120。
填“>”、
“<”或“=");SO3的三聚体环状结构如图2所示,该结构中S-O键长有两类,
一类键长约140Pm,另一类键长约为160Pm,较短的键为(填图2中字母),该分子中含有个瓢.
也可以得到偏钮酸钠,其阴离子呈如图3所示的无限链状结构,则偏钮酸钠的化学
式为(5)硫能形成很多种含氧酸,如H2SO3、H2SC4.硫的某种含氧酸分子式为H2&O7,属于二元酸,已知其结构中所有原子都达到稳定结构,且不存在非极性键,试写出其结构式(配位键须注明).
(6)利用铜萃取剂M,通过如下反应实现铜离子的富集:
M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取.M水溶性小的主要原因是.
8.
钻是人体必需的微量元素,含钻化合物作为颜料,具有悠久的历史,在机械制造、磁性材料等领域也具有广泛的应用,请回答下列问题:
(1)Co基态原子的电子排布式为;
(2)酬:
菁钻近年来在光电材料、非线性光学材料、光动力学中的光敏剂、催化剂等
方面得到了广泛的应用,其结构如图1所示,中心离子为钻离子.
①酗:
菁钻中三种非金属原子的电负性有大到小的顺序为,(用相应的元素
符号作答);碳原子的杂化轨道类型为;
②与钻离子通过配位键结合的氮原子的编号是;
⑶CoCl2中结晶水数目不同呈现不同的颜色.
s,325.3K止匕八363K»止匕393K»
CoCl2?
6H2。
(粉红)?
CoCl2?
2H2。
(系红)?
CoCl2?
H2O(股系)?
CoCl2(股
色)
CoCl2可添加到硅胶(一种干燥剂,烘干后可再生反复使用)中制成变色硅胶.简述
硅胶中添加CoCl2的作用:
;
(4)用KCN处理含Co2+的盐溶液,有红色的Co(CN)2析出,将它溶于过量的KCN
溶液后,可生成紫色的[Co(CN6]4-,该配离子具有强还原性,在加热时能与水反应生成淡黄色[Co(CN)6]3-,写出该反应的离子方程式:
;
且最近的钻原子有个;筑波材料科学国家实验室一个科研小组发现了在
5K下呈现超导性的晶体,该晶体具有CoQ的层状结构(如图2所示,小球表示Co原子,大球表示O原子).下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是.
答案和解析
1.【答案】
(1)8;4;1s22s22p63s23p63d5;
(2)平面正三角形;SO3等;
(3)C、N、O、S;
?
640?
?
?
?
?
?
(4)a;
(5)8Fe+2NH3^^2Fe4N+3H2;2s3NA
【解析】解:
(1)Fe单质为体心立方晶体,体心的Fe原子与晶胞顶点8个Fe原子相邻,
故配位数为8;Fe原子核外电子排布式为1s22s22p63s23p63d64s2,3d能级中有4个电子单独占据1个轨道,含有4个单电子,失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+的电子排布式为1s22s22P63s23P63d5,
故答案为:
8;4;1s22s22p63s23p63d5;
(2)NO3中N原子孤电子对数=5+1-2X3=0,价层电子对数为3+0=3,空间构型为平
面正三角形,
原子数相等、价电子总数也相等的微粒互为等电子体,分子中正负电荷正向重合的分子
为非极性分子,与NO3互为等电子体的一种非极性分子有SO3等,
故答案为:
平面正三角形;SO3等;
(3)维和孤电子^•数和是4的原子就采取sp3杂化,根据物质结构可知,采用sp3杂化的原子有C、N、O、S,
故答案为:
C、N、O、S;
(4)a.乙醇分子间可形成氢键,氯乙烷中不含氢键,氢键的存在导致乙醇的沸点升高,所
以乙醇的沸点比氯乙烷高,故正确;
b.根据化合物中化合价的代数和为0知,鸨的配合物离子[W(CO)5OH]-中鸨显0价,故
错误;
c.聚乙烯([CH±—CH」」)分子中有(6n-1)个剧,故错误;
d.二氧化硅晶体中Si原子与周围4个O原子形成Si-O四面体结构,1molSiO2含有4molSi-O,Si晶体中Si原子与周围4个Si原子形成Si-Si,每个键为2个Si原子共用,故1mol硅含有2molSi-Si键,60gsi。
2的物质的量为1mol,由表中数据知反应Si(s)+O2(g)=SiO2(s)中,每生成60gSiO2放出的能量为(4c-2a-b)kJ,故错误.故选:
a;
一,,一…一.11一
(5)晶胞中Fe原子数目为8X8+6X2=4,N原子数目为1,故该厂物化学式为Fe4N,
还生成氢气,反应方程式为:
8Fe+2NH3?
6等?
2?
?
e4N+3H2,
晶胞面对角线上3个Fe原子相邻,则晶胞棱长为2scmx£=&scm,晶胞质量为
■rg,则晶体密度为56NA+14g+(V2scm)3=募Ig?
cm-3,AA2sNA
一”…、,?
?
?
?
?
?
?
?
?
?
故答案为:
8Fe+2NH3—7-?
2Fe4N+3H
⑴Fe单质为体心立方晶体,体心的Fe原子与晶胞顶点8个Fe原子相邻;Fe原子核外
电子排布式为1s22s22p63s23p63d64s2,失去4s能级2个电子、3d能级1个电子形成Fe3+;
(2)NO3中N原子孤电子对数=丝与二=0,价层电子对数为3+0=3;原子数相等、
价电子总数也相等的微粒互为等电子体,分子中正负电荷正向重合的分子为非极性分子;
⑶价层电子对数是4的原子采用sp3杂化;
(4)a.分子间氢键导致物质熔沸点升高;
b.鸨的配合物离子[W(CO)5OH]-中W为。
价;
c.聚乙烯({CE(—CH]:
:
)分子中有(6n-1)个剧;
d.二氧化硅晶体中Si原子与周围4个。
原子形成Si-O四面体结构,1molSiO2含有4molSi-O,Si晶体中Si原子与周围4个Si原子形成Si-Si,每个键为2个Si原子共用,故1mol硅含有2molSi-Si键;
11
(5)晶胞中Fe原子数目为8X8+6x-=4,N原子数目为1,故该产物化学式为Fe4N,还生成氢气;
晶胞面对角线上3个Fe原子相邻,则晶胞棱长为2scmx2?
=v2scm,结合晶胞中原子
数目表示出晶胞质量,再根据p=V计算晶体密度.
本题考查物质结构和性质,设核外电子排布、杂化方式与空间构型判断、等电子体、化学键、配合物、氢键、反应热计算、晶胞结构与计算等,需要学生具备扎实的基础,注意识记常见晶胞计算,掌握均摊法进行晶胞有关计算.
2
281
NisLa;而x
.【答案】AlO2、SiO2-、OH-;Fe3+、Fe2+、Ni2+;将Fe2+氧化为Fe3+、有利于分离;蒸发结晶;Ni(OH)2+OH--e-=NiOOH+H2O;MHx+xOH--xe-=M++XH2O;
(64%aX95%+59b)x97%93
【解析】解:
Al与SiO2和碱液反应分别生成偏铝酸钠和硅酸钠留在溶液A中,其余为
滤渣进入滤渣a,滤渣a中加入硫酸,金属Fe变为亚铁离子,Ni变为馍离子,加入双氧水的目的是把亚铁离子氧化为铁离子,以便与调节pH使其生成沉淀除去,即溶液C
中含有铁离子、银离子等,调节pH=6,得到沉淀为氢氧化铁,得到溶液为含有银离子的溶液,然后继续调节pH值,蒸发结晶即可得到目标产物,
(1)依据分析可知,滤?
AA中存在的阴离子主要是AIO2、Si02-、OH-,故答案为:
川。
2、SiO2-、OH-;
(2)依据分析可知滤液B中可能含有的金属离子是:
Fe3+、Fe2+、Ni2+,故答案为:
Fe3+、Fe2+、Ni2+;
(3)加入双氧水的目的是:
将Fe2+氧化为Fe3+、有利于分离,操作X为蒸发结晶,故答案为:
将Fe2+氧化为Fe3+、有利于分离;蒸发结晶;
(4)阳极失去电子,发生氧化反应,是充电过程,故阳极电极反应方程式为:
Ni(OH)2+
OH--e-=NiOOH+"O;放电为原电池,负极失去电子,发生氧化反应,电极反应方程式为:
MHx+xOH--xe-=M++XH2O,故答案为:
Ni(OH)2+OH--e-=NiOOH+H2O;MHx+xOH--xe-=M++xH2。
;
(5)该合金的晶胞如图所示,晶胞中心有一个馍原子,其他8个馍原子都在晶胞面上,
1
例原子都在晶胞顶点,所以晶胞实际含有的馍原子为1+8*3=5,晶胞实际含有的例
1
原子为8x-=1,所以晶体的化学式Ni5La,
故答案为:
Ni5La;
(6)依据题意:
调pH=6时bkgNi(OH)2,回收过程中,第①〜②步操作馍的损失率为5%,第④〜⑥步骤的损失率为3%,故此计算式为:
281X(64%aX95%+||b)X97%,
故答案为:
281X(64%aX95%+59b)X97%.5993
Al与SiO2和碱液反应分别生成偏铝酸钠和硅酸钠留在溶液A中,其余为滤渣进入滤渣a,
滤渣a中加入硫酸,金属Fe变为亚铁离子,Ni变为馍离子,加入双氧水的目的是把亚铁离子氧化为铁离子,以便与调节pH使其生成沉淀除去,即溶液C中含有铁离子、银
离子等,调节pH=6,得到沉淀为氢氧化铁,得到溶液为含有银离子的溶液,然后继续调节pH值,蒸发结晶即可得到目标产物,据此解答各小题即可;电解池中阳极失去电子,发生氧化反应,为充电过程,原电池中负极失去电子,发生氧化反应;依据分摊法计算晶胞中原子个数即可;依据产率计算最后一个空.
本题主要考查的是流程,难度较大,设计原电池与电解池原理、晶胞计算、氧化还原反应等,注意总结.
3.【答案】离子;3d5;N>C>Fe>K;acd;异硫氟酸(或H-N=C=S);3:
4;sp;
“cv2260
C2H2;12;了X3』
【解析】解:
(1)根据K3[Fe(CN)6]的组成可知该化合物为离子化合物,则该化合物为离子晶体,中心离子是Fe3+,Fe的原子核外电子数为26,原子核外电子排布式为1s22s22p63s23p63d64s2,失去3个电子生成三价铁离子,则Fe3+的价电子排布式为3d5,故答案为:
离子;3d5;
(2)同周期自左而右元素的第一电离能呈增大趋势,则第一电离能Fe>K,va族np能级容纳3个电子,为半充满稳定状态,能量较低,第一电离能高于同周期相邻元素,则
N>C,金属元素第一电离能较小,非金属元素第一电离能较大,则K3[Fe(CN)6]中四种
组成元素的第一电能由大到小的排序是N>C>Fe>K;K3[Fe(CN)6]是配位化合物,也
是离子化合物,则该化合物中一定存在配位键、离子键,C、N之间存在极性共价键,
所以存在的作用力有a、c、d,故答案为:
N>C>Fe>K;acd;
(3)异硫氧酸中H-N键极性强,分子间存在氢键,而硫鼠酸分子间只存在分子间作用力,所以异硫氟酸的沸点高于硫氧酸,
故答案为:
异硫氟酸(或H-N=C=S);
(4)①产物(CN)2中的结构式为N三C-C三N,<有3条,兀键有4条,则避和城数目之比为3:
4,故答案为:
3:
4;
②产物(CN)2中的结构式为N三C-C三N,中心原子C无孤对电子,则价层电子对数为
2,杂化类型为sp杂化,空间构型为直线形,
与他空间构型、原子数相同的分子是C2H2(H-C三C-H),
故答案为:
sp;C2H2;
③从图中可知,以面心上的K+为例,同层顶点的4个K+距离面心上的K+最近,中间层
p?
v,
还有4个,外层也有4个,共12个;晶胞中K+有8X:
+6X:
=4,CN-有12X1+1=4,824
K+与K+的核间距a,则晶胞的棱长为v2a,晶胞的体积V=(J2a)3,晶胞的质量m
故答案为:
12;白3晋
(1)根据K3[Fe(CN)6]的组成可知该化合物为离子化合物,则该化合物为离子晶体,中心离子是Fe3+,Fe3+的价电子排布式为3d5;
(2)同周期自左而右元素的第一电离能呈增大趋势,金属元素第一电离能较小,非金属
元素第一电离能较大;K3[Fe(CN)6]是配位化合物,也是离子化合物,则该化合物中一
定存在配位键、离子键,C、N之间存在极性共价键;
(3)异硫氧酸中H-N键极性强,分子间存在氢键,沸点较高;
(4)①产物(CN)2中的结构式为N三C-C三N,<有3条,兀键有4条;
②产物(CN)2中的结构式为N三C-C三N,中心原子C无孤对电子,则价层电子对数为
2,杂化类型为sp杂化,空间构型为直线形;
③从图中可知,以面心上的K+为例,同层顶点的4jK+距离面心上的K+最近,中间层
还有4个,外层也有4个,共12个;用均摊法计算晶胞中K+有8X:
+6X。
=4,CN