常见气体的制备与收集.docx
《常见气体的制备与收集.docx》由会员分享,可在线阅读,更多相关《常见气体的制备与收集.docx(25页珍藏版)》请在冰豆网上搜索。
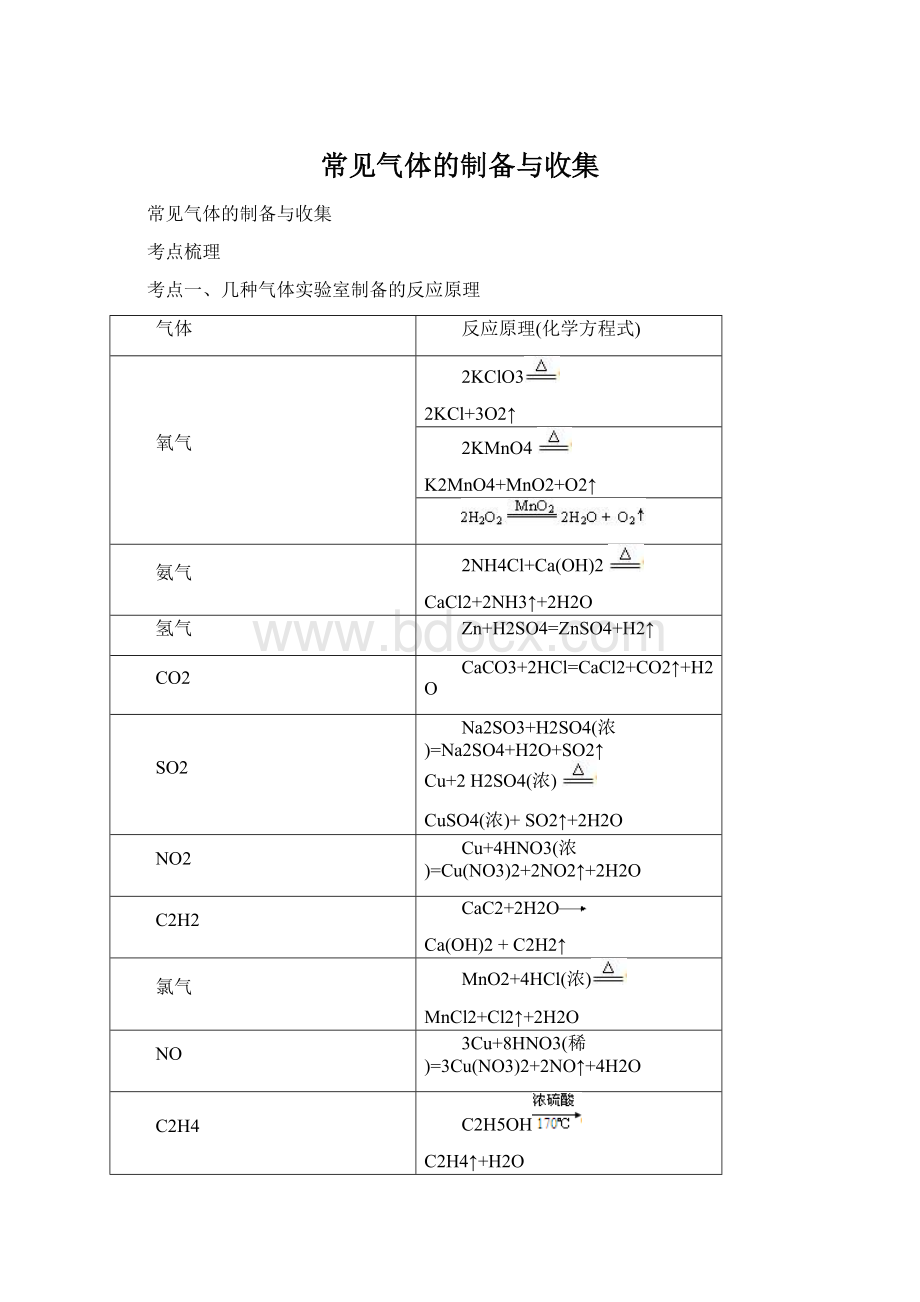
常见气体的制备与收集
常见气体的制备与收集
考点梳理
考点一、几种气体实验室制备的反应原理
气体
反应原理(化学方程式)
氧气
2KClO3
2KCl+3O2↑
2KMnO4
K2MnO4+MnO2+O2↑
氨气
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
氢气
Zn+H2SO4=ZnSO4+H2↑
CO2
CaCO3+2HCl=CaCl2+CO2↑+H2O
SO2
Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑
Cu+2H2SO4(浓)
CuSO4(浓)+SO2↑+2H2O
NO2
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
C2H2
CaC2+2H2O
Ca(OH)2 +C2H2↑
氯气
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
NO
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
C2H4
C2H5OH
C2H4↑+H2O
考点二、气体的发生装置
1.设计原则:
根据反应原理、反应物状态和反应所需条件等因素来选择反应装置。
2.装置基本类型:
装置类型
固体反应物(加热)
固液反应物(不加热)
固液反应物(加热)
装置示意图
主要仪器
酒精灯、试管
启普发生器
酒精灯、烧瓶、分液漏斗
典型气体
O2、NH3、CH4等
H2、CO2、H2S等。
Cl2
操作要点
⑴试管口应稍向下倾斜,以防止产生的水蒸气在管口冷凝后倒流而引起试管破裂;
⑵铁夹应夹在距试管口l/3处;
⑶胶塞上的导管伸入试管里面不能太长,否则会妨碍气体的导出。
⑴在用简易装置时,如用长颈漏斗,长颈漏斗的下口应伸入液面以下,否则起不到液封的作用;
⑵加入的液体反应物(如酸)要适当;
⑶块状固体与液体的混合物在常温下反应制备气体可用启普发生器制备。
⑷制C2H2:
⑴先把固体药品加入烧瓶,然后加入液体药品;
⑵要正确使用分液漏斗。
⑶制C2H4:
考点三、气体的收集方法和装置
根据气体的密度、溶解性、稳定性可将气体的收集方法分为三种。
1、收集方法:
(1)排水集气法
凡难溶于水或微溶于水,又不与水反应的气体都可用排水法收集;
(2)向上排空气法
凡是气体的相对分子质量大于空气的平均相对分子质量的可用此法;
(3)向下排空气法
若气体的相对分子质量小于空气的平均相对分子质量,则用向下排空气法。
2、收集装置:
(1)图甲可收集O2、H2、N2、Cl2(饱和NaCl溶液)、NO、CO2(饱和NaHCO3溶液)、CO等。
(2)图乙可收集Cl2 、NO2、CO2、SO2等。
(3)图丙可收集H2、NH3、CH4等。
(4)图丁从A进气相当于图乙,从B进气相当于图丙。
考点四、气体的干燥净化装置
1、气体干燥净化装置:
气体的净化、干燥装置一般常用的有洗气瓶、干燥管、U形管和双通加热管几种。
液态干燥剂
固态干燥剂
固体,加热
装置
常见干燥剂
浓硫酸(酸性、强氧化性)
无水氯化钙(中性)
碱石灰(碱性)
除杂试剂Cu、CuO、Mg等
可干燥的气体
H2、Cl2、O2、SO2、N2、CO2、CO、CH4
H2、Cl2、O2、SO2、N2、CO2、CO、CH4
H2、O2、N2、CO、CH4、NH3
可除去H2、O2、N2、CO
不可干燥的气体
HBr、NH3、HI
NH3
Cl2、SO2、CO2、NO2等
(1)洗气瓶中一般装入液体除杂试剂。
除杂试剂应通过化学反应将杂质吸收或将杂质气体转化为所制取的气体。
常见除杂试剂有:
①强碱溶液:
如NaOH溶液可吸收CO2、SO2、H2S、Cl2、NO2等呈酸性的气体。
②饱和的酸式盐溶液,可将杂质气体吸收转化,如:
饱和NaHCO3溶液能除去CO2中混有的HCl、SO2等强酸性气体。
饱和NaHSO3溶液能除去SO2中混有的HCl、SO3等气体。
饱和NaHS溶液能除去H2S中混有的HCl气体。
③浓H2SO4:
利用它的吸水性,可除去H2、SO2、HCl、CO、NO2、CH4等气体中混有的水蒸气。
但由于浓H2SO4有强氧化性,不能用来干燥具有强还原性气体,如H2S、HBr、HI等。
④酸性KMnO4溶液:
利用它的强氧化性,可以除去具有还原性的气体,如除去混在CO2气体中的SO2、H2S等。
(2)干燥管、U形管一般装入固体的干燥剂。
常见的固体干燥剂有:
①酸性干燥剂,用来干燥酸性气体。
如P2O5、硅胶等。
②碱性干燥剂,用来干燥碱性气体。
如CaO、碱石灰、固体NaOH等。
③中性干燥剂,既能干燥碱性气体又能干燥酸性气体。
如CaCl2(但CaCl2不能干燥NH3,因易形成CaCl2·8NH3氨合物)。
(3)双通加热管一般装入固体除杂剂,除杂试剂和混合气体中的某一组分反应。
例如:
Cu和混合气体中O2反应而将O2除去。
另外还常用固体的无水CuSO4装入干燥管中,通过颜色变化检验水蒸气的存在(但不能用CuSO4作干燥剂,因CuSO4吸水率低)。
用Na2O2固体也可将CO2、H2O(气)转化为O2。
2、尾气处理装置:
尾气处理与净化、干燥的原理和装置是一样的。
(1)图甲装置中若装NaOH可吸收Cl2、SO2、NO2、CO2等酸性气体。
若装Na2SO3可吸收Cl2、SO2、NO2等。
(2)图乙和图丙装置中若装碱石灰可吸收Cl2、SO2、NO2、CO2等酸性气体,同时他们还是一个双吸收装置,应用于制取易潮解的物质,如,制无水AlCl3时,正好可吸收多余的Cl2,反应结束后冷却过程中又可吸收回流的空气以防止潮解。
(3)尾气处理还可以用下列装置:
甲 乙 丙
A.甲装置吸收极易溶于水的气体如HCl、NH3等。
B.乙装置吸收溶解度较小的气体如Cl2等。
C.丙装置除去可燃的有毒气体如CO等。
D.无需要吸收直接排放的气体有O2、N2、H2、CO2、CXHY,其中H2和CXHY必须排放到室外。
3、防倒吸完全装置:
4.测量气体的体积:
利用气体的不溶于某些液体的性质(如H2难溶于水,Cl2难溶于饱和食盐水)可用排液法粗略测量气体的体积。
其多种量气装置见下图。
实验操作水平的高低决定了测量误差的大小。
为减少量气误差,应注意:
装置(A),反应后应恢复到室温再读数,实验前集气瓶应充满水。
气体体积即量筒中水的体积,
装置(B):
读数时应上下移动乙管,使甲、乙两管液面相平。
读取反应前后甲管中液面体积读数的差值即为气体体积.
装置(C):
测量收集到气体体积,应先使气体冷却至室温,再慢慢将量筒下移,使量筒内外液面高度相同,再读取读数.
装置(D):
实验中水面要没过漏斗颈,量筒中装满水,反应在漏斗中进行,生成
气体的体积即为量筒内气体的体积。
装置(E):
用于测量混合气体中被吸收(或不被吸收)的体积分数.读数时球形容器和量气管液面相平,量气管内增加的水的体积等于不被反应管吸收的气体的体积.
考点五、气体制备实验的基本过程
1、气体制备实验一般分为以下六个环节:
制气→安全装置→除杂→干燥→反应→尾气处理
2、气体制备实验操作的一般步骤:
(1)组装(从下到上、从左到右)
(2)检验气密性
(3)加入药品
(4)排尽装置内的空气
(5)验纯
(6)性质实验或反应
(7)拆除装置
典型例题
类型一、实验室制取气体的原理
1、下列实验装置图正确的是
答案与解析举一反三
【思路点拨】A项中制乙烯的温度计应插入液面以下以测溶液的温度;C项中没有除杂装置;D项收集乙酸乙酯时导管不能插入液面以下。
【答案】B
【解析】A选项:
实验室制备乙烯控制乙醇的分解温度是关键,乙醇在圆底烧瓶中,温度计的水银球必须置于反应混合液的液面以下测乙醇的分解温度;C选项:
实验室制备氯气是在加热条件下反应的,该装置没有热源,由于反应在加热条件下进行,盐酸的挥发性导致一部分氯化氢气体随着氯气挥发出来,同时伴有少量的水蒸气的产生,所以在收集装置前应该连有两个洗气瓶,一个装有饱和食盐水除去氯气中的氯化氢气体,一个装有浓硫酸除去氯气中的水蒸气,而该装置中没有热源和除杂装置;D选项:
随着乙酸乙酯挥发出来的有乙醇和乙酸,其中乙醇极易溶于水,而乙酸又能和碳酸钠溶液反应,导管插入液面就会产生倒吸,使反应得不到乙酸乙酯。
答案B.
【点评】本题考查了:
①了解化学实验常用仪器的主要用途和使用方法,②能绘制和识别典型实验仪器的装置图,③掌握常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。
认真注意课本中的每个演示实验和学生实验。
变式1】右图是一套实验室制气装置,用于发生、干燥和收集气体。
下列各组物质
中能利用这套装置进行实验的是
A.铜屑和浓硝酸 B.二氧化锰和浓HCl
C.电石和水 D.碳酸钙和稀硫酸
答案与解析
【答案】A
【变式2】右图是制取和收集某气体的实验装置,该装置可用于
A.用浓盐酸和二氧化锰反应制取Cl2
B.用过氧化钠固体和水反应制取O2
C.用浓硝酸与铜反应制取NO2
D.用浓氨水和生石灰反应制取NH3
答案与解析
【答案】B
2、拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
气体
a
b
c
d
C2H4
乙醇
浓H2SO4
NaOH溶液
浓H2SO4
Cl2
浓盐酸
MnO2
NaOH溶液
浓H2SO4
NH3
饱和NH4Cl溶液
消石灰
H2O
固体NaOH
NO
稀HNO3
铜屑
H2O
P2O5
⑴上述方法中可以得到干燥、纯净的气体是______________。
⑵指出不能用上述方法制取的气体,并说明理由(可以不填满)
①气体______________,理由是______________。
②气体______________,理由是______________。
③气体______________,理由是______________。
④气体______________,理由是______________。
答案与解析举一反三
【思路点拨】从气体的发生、净化和干燥等方面综合考虑。
【答案】
⑴NO
⑵①C2H4 装置中没有温度计,无法控制反应温度
②Cl2 反应生成的Cl2被c中的NaOH溶液吸收了
③NH3 反应生成的NH3被c中的H2O吸收了
【解析】
若制取乙稀,由于装置中没有温度计,无法控制反应温度,实验无法进行。
后面的除杂试剂NaOH溶液(用于吸收CO2和SO2)和干燥剂浓H2SO4的选用都是正确的。
若用该装置制取氯气是可以的,用浓H2SO4对氯气进行干燥也是可以的。
但要除去氯气中混有的HCl气体,c中应选用饱和食盐水。
我们熟悉的制取氨气的装置是以NH4Cl固体和消石灰作反应物的固体加热制气装置,用本题中装置和题给反应物也能制取氨气(a中也可以加入浓氨水),但c中的水能吸收氨气且能发生倒吸。
若c中不加入任何物质倒是可以的。
若用该装置制取NO气体,制得的气体中可能混有NO2气体,c中用水能将NO2转化为NO,d中的P2O5起干燥NO的作用。
我们熟悉的干燥装置一般由两种:
本题中d装置和干燥管(或U型管),d装置中一般装液体干燥剂如浓硫酸,干燥管(或U型管)中装入固体干燥剂。
这里d装置中装入固体干燥剂是一种非常规方法。
【总结升华】本题考查制取气体实验中根据已有装置选择反应物、除杂试剂和干燥剂的能力,其中有常规方法和非常规方法。
【变式1】实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4=ZnSO4+H2↑
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置______________(填代号)和制备并收集干燥、纯净Cl2的装置________(填代号)。
可选用制备气体的装置:
答案与解析
【答案】e,d
3、下列反应适用于实验室制氢气的是( )
①锌与稀硫酸反应 ②甲烷热分解 ③电解稀硫酸 ④赤热的炭与水蒸气反应
A.只有① B.①②
C.①③ D.①②④
答案与解析举一反三
【思路点拨】实验室里制备气体要操作简单,容易分离,经济实惠,切实可行。
【答案】C
【解析】甲烷在高温下才能分解成H2和C,实验室里很难办到。
赤热的炭和水蒸气反应生成CO和H2,既难反应,又难分离,难以在实验室里实现。
可用锌和稀硫酸反应、电解稀硫酸(即电解水,但反应比电解纯水快)的方法制取氢气。
【总结升华】工业制法重在考虑原料来源丰富、生产成本低。
方法④适用于工业制法,赤热的炭与水蒸气反应生成CO和H2,CO和H2O在催化剂条件下继续反应生成CO2和H2,除掉混合气中的CO2后即得到H2。
【变式1】下列反应适用于实验室制备氧气的是( )
①高锰酸钾热分解 2KMnO4
K2MnO4+MnO2+O2↑
②硝酸铵热分解 2NH4NO3
4H2O+2N2↑+O2↑
③过氧化氢催化分解 2H2O2
2H2O+O2↑
④二氧化氮热分解 2NO2
2NO+O2
A.只有① B.①和②
C.①和③ D.①③④
答案与解析
【答案】C
【变式2】如图是实验室常见的气体制取、干燥和收集装置。
若用过氧化氢和催化剂二氧化锰制取干燥的氧气,则合理的装置组合为( )
A.①⑤⑧ B.③④⑦
C.②⑤⑥ D.②④⑧
答案与解析
【答案】C
【解析】用H2O2制O2的反应原理为:
,由反应物的状态和反应条件可选②作为制取装置。
干燥O2可选用④或⑤装置,要收集干燥的O2只能用⑥装置,故合理的装置组合为②⑤⑥。
【变式3】可用右图装置制取(必要时可加热)、净化、收集的气体
是
A.铜和稀硝酸制一氧化氮
B.氯化钠与浓硫酸制氯化氢
C.锌和稀硫酸制氢气
D.硫化亚铁与稀硫酸制硫化氢
答案与解析
【答案】B
类型二、气体的净化和干燥
4、制备下列气体过程中,净化除杂的有关操作(括号内是杂质)其中正确的是( )
A、CO2(CO)——气体通过灼热的CuO
B、C2H4(SO2)——气体通过盛有溴水的洗气瓶
C、NO(NO2)——通过水洗干燥后,用向下排空气法收集
D、NH3(H2O)——浓H2SO4
答案与解析举一反三
【思路点拨】C2H4 和SO2与溴水均发生反应;浓H2SO4 与NH3反应。
【答案】A
【解析】溴水会吸收C2H4,B不正确;NO会与O2 反应,C不正确;浓H2 SO4 吸收NH3,D不正确。
【总结升华】除杂时,除杂试剂一般不能与被提纯物质反应。
【变式1】既能用浓H2SO4干燥,又可用CaO干燥的气体有( )
①H2 ②O2 ③N2 ④SO2 ⑤H2S ⑥CH4 ⑦NH3 ⑧CO2
A.①②③⑥ B.①②③⑧
C.④⑤⑥ D.④⑤
答案与解析
【答案】A
【解析】能用浓H2SO4干燥的有:
①②③④⑥⑧,能用CaO干燥的有:
①②③⑥。
【变式2】为制备干燥、纯净的CO2,将大理石和盐酸反应生成的气体先后通过装有下列物质的两个吸收装置,两个装置中应依次装入( )
①饱和NaHCO3溶液;无水CaCl2固体
②饱和NaHCO3溶液;浓硫酸
③浓硫酸;饱和NaHCO3溶液
④饱和Na2CO3溶液;稀硫酸
A.①② B.③④ C.①③ D.②④
答案与解析
【答案】A
【变式3】为下列各组气体选择合适的除杂试剂(括号内为杂质气体)
(1)含有HCl杂质的气体
①CO2(HCl):
_______________________________________________________________;
②SO2(HCl):
_______________________________________________________________
③Cl2(HCl):
________________________________________________________________
(2)中性气体中含有酸性杂质气体
①O2(Cl2):
__________________________________________________________________;
②CO(CO2):
________________________________________________________________
③NO(NO2):
________________________________________________________________;
(3)酸性气体中含有其他酸性杂质气体
CO2(SO2):
__________________________________________________________________;
(4)含有O2杂质的气体
①CO2(O2):
________________________________________________________________;
②N2(O2):
_________________________________________________________________。
(5)HCl(Cl2):
_______________________________________________________________。
答案与解析
【答案】
(1)①饱和NaHCO3溶液 ②饱和NaHSO3溶液 ③饱和食盐水
(2)①NaOH溶液 ②NaOH溶液 ③H2O
(3)饱和NaHCO3溶液或酸性高锰酸钾溶液
(4)①灼热Cu ②灼热Cu
(5)CCl4
类型三、气体的收集
5、利用如右图所示的装置收集以下8种气体:
①H2;②Cl2;③O2;④HCl;⑤NH3;⑥NO;⑦SO2;⑧NO2
(1)若烧瓶是干燥的,则由B口进气,可收集的气体有_____,若由A口进气,可收集的气体有_____。
(2)若在烧瓶内充满水,可收集的气体有________,气体应由________口进入。
(3)若烧瓶中装入适量浓硫酸,可以用它来干燥的气体有________,气体应由________口进入。
答案与解析举一反三
【思路点拨】相对分子质量大于29(空气的平均相对分子质量)的,密度比空气大。
密度比空气大的气体才能用向上排空气法收集。
【答案】
(1)②③④⑦⑧ ①⑤
(2)①③⑥ A (3)①②③④⑥⑦⑧ B
【解析】
(1)从B口进气是收集密度比空气大的气体,若从A口进气则收集密度比空气小的气体,用排空气法收集的气体必须与O2不反应,且密度与空气密度相差较大。
(2)若用排水法收集,则气体必须不溶于水,应从A口进。
(3)若用浓H2SO4干燥气体,必须从B口进。
【总结升华】对同一个装置,从不同的角度去审视可能有不同的作用。
加强
思维的灵活性和开放性训练是思维训练的重要方面,是打破思维定式的有效方式。
【变式1】用如图所示装置进行下列实验,能达到实验目的的是( )
A.瓶中盛适量浓H2SO4,从A口进气来干燥NH3
B.从B口进气,用排空气法收集CO2
C.瓶中盛满水,从B口进气,用排水法收集NO2
D.瓶中装满水,A口连接导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积
【答案】D
【变式2】下列各组气体在常温下能共存且能用向上排空气法收集的是
A.NO和O2 B.HCl和NH3
C.H2和CO D.SO2和CO2
答案与解析
【答案】D
变式3】实验室常见的几种气体发生装置如图A、B、C所示:
(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是________________;检查C装置气密性的操作方法是_______________________________________________________________。
(2)气体的性质是选择气体收集方法的主要依据。
下列气体的性质与收集方法无关的是________(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤是否与氧气反应
下图是某学生设计收集气体的几种装置,其中不可行的是________。
(3)若用A装置与D装置相连制取收集X气体,则X可能是下列气体中的________;
①CO2 ②NO ③Cl2 ④H2
其中在D装置中连接小烧杯的目的是_______________________________________
________________________________________________________________________。
答案与解析
【答案】
(1)浓氨水和氧化钙(或碱石灰、固体氢氧化钠等)将导管通入水槽中,用手捂或酒精灯微热圆底烧瓶底部,如果导管口处有气泡产生,松开手或停止加热后,在导管里形成一段水柱,说明C装置气密性良好
(2)②④ bc (3)③吸收尾气,防止污染空气
【解析】
(1)采用B装置制取氨气时应选用消石灰和氯化铵固体;C装置适用于固体与液体不需要加热的反应,故应选用浓氨水和氧化钙(或碱石灰、固体氢氧化钠等)。
检查C装置气密性的操作是将导管通入水槽中,用手捂或用酒精灯微热圆底烧瓶底部,如果导管口处有气泡产生,松开手或停止加热后,在导管里形成一段水柱,则说明C装置气密性良好
(2)选择气体收集方