高考化学钠及其化合物的综合题试题含答案解析.docx
《高考化学钠及其化合物的综合题试题含答案解析.docx》由会员分享,可在线阅读,更多相关《高考化学钠及其化合物的综合题试题含答案解析.docx(33页珍藏版)》请在冰豆网上搜索。
高考化学钠及其化合物的综合题试题含答案解析
高考化学钠及其化合物的综合题试题含答案解析
一、高中化学钠及其化合物
1.化学兴趣小组制取Na2O2,并测定制得的Na2O2样品的纯度。
I.制取Na2O2。
查阅资料:
①钠与空气在453~473K之间可生成Na2O,迅速提高温度到573~673K之间可生成Na2O2。
②4Na+3CO2
2Na2CO3+C。
③加热后,Na不与N2反应。
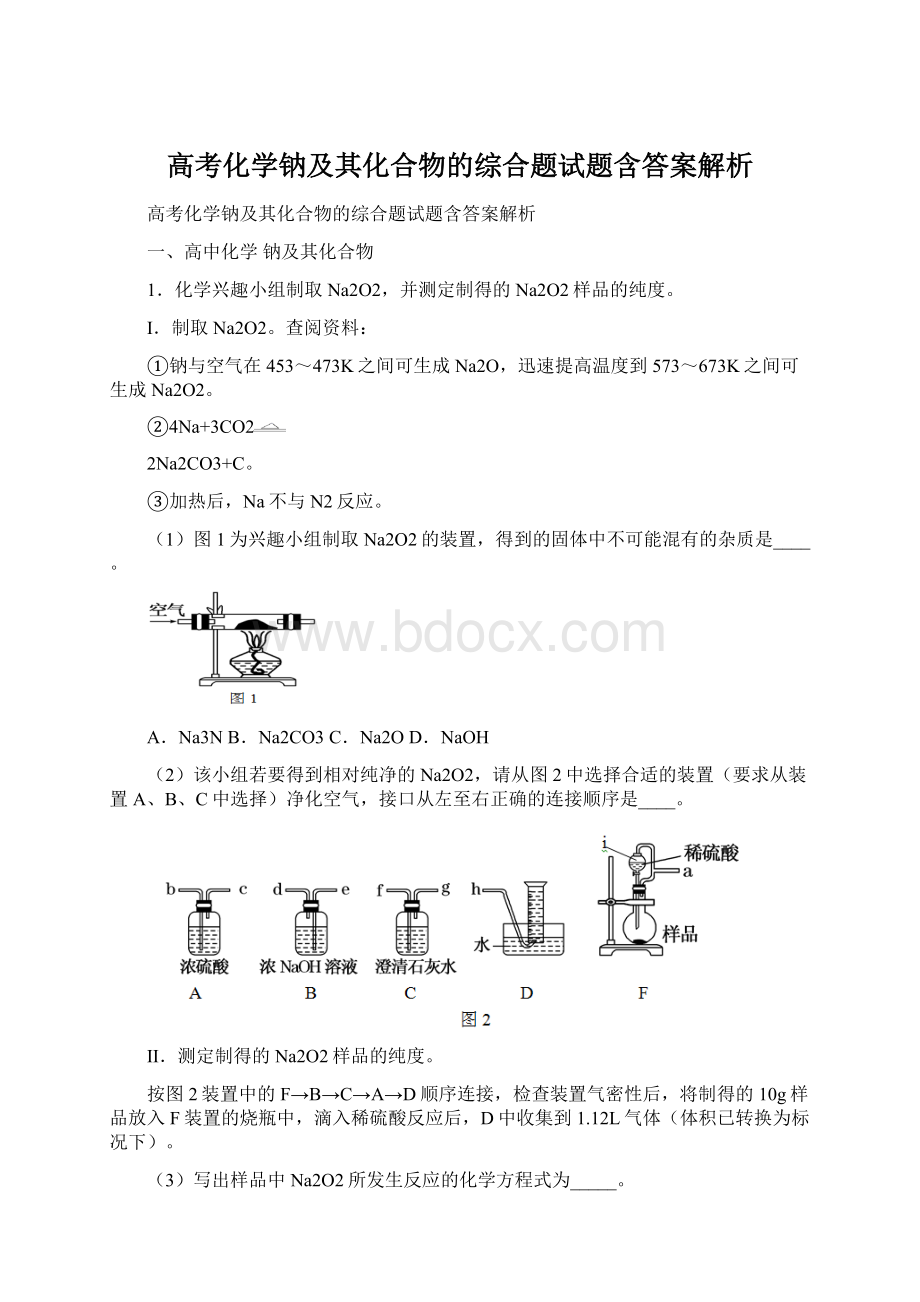
(1)图1为兴趣小组制取Na2O2的装置,得到的固体中不可能混有的杂质是____。
A.Na3NB.Na2CO3C.Na2OD.NaOH
(2)该小组若要得到相对纯净的Na2O2,请从图2中选择合适的装置(要求从装置A、B、C中选择)净化空气,接口从左至右正确的连接顺序是____。
II.测定制得的Na2O2样品的纯度。
按图2装置中的F→B→C→A→D顺序连接,检查装置气密性后,将制得的10g样品放入F装置的烧瓶中,滴入稀硫酸反应后,D中收集到1.12L气体(体积已转换为标况下)。
(3)写出样品中Na2O2所发生反应的化学方程式为_____。
(4)B中反应的化学方程式为____,C装置的作用是____。
(5)装置F中仪器i的名称为____;仪器i和烧瓶用一根导管连接,目的是使稀硫酸能顺利流下,也可减少实验产生误差,若没有该导管将导致测定的结果____(填“偏大”“偏小”或“无影响”)。
(6)该实验测得样品中Na2O2纯度为_____。
【答案】Aedbc2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑2NaOH+CO2=H2O+Na2CO3检验CO2是否除尽分液漏斗偏大78.0%
【解析】
【分析】
(1)①钠与氧气反应可以得到氧化钠、过氧化钠,二者均与二氧化碳反应得到碳酸钠,与水反应会得到氢氧化钠,由信息可知钠与氮气不反应;
(2)若要得到相对纯净的过氧化钠,应将空气通过盛有浓氢氧化钠溶液的洗气瓶除去二氧化碳,再通过盛有浓硫酸的洗气瓶除去水蒸气;
(3)过氧化钠与稀硫酸反应生成硫酸钠、氧气和水;
(4)该实验设计的原理是烧瓶中过氧化钠与硫酸反应生成硫酸钠、氧气与水,用浓氢氧化钠溶液吸收氧气中可能混有二氧化碳,用澄清石灰水检验二氧化碳是否除尽,用排水法收集氧气,根据氧气体积可以计算过氧化钠的质量,进而计算样品中过氧化钠的质量分数;
(5)分液漏斗和烧瓶用导管连接可以平衡气压,使稀硫酸顺利流下,还可以抵消滴加硫酸排出空气的体积,若没有该导管,排出的空气按生成氧气的体积计算;
(6)依据标况下氧气的体积和反应方程式计算过氧化钠的质量,由题给数据计算过氧化钠的纯度。
【详解】
(1)①钠与氧气反应可以得到氧化钠、过氧化钠,二者均与二氧化碳反应得到碳酸钠,与水反应会得到氢氧化钠,由信息可知钠与氮气不反应,则Na2O2中可能含有的杂质为Na2CO3、Na2O、NaOH,不可能含有Na3N,故答案为:
A;
(2)空气中含有的二氧化碳和水会与过氧化钠的反应,使得制得的过氧化钠含有杂质,若要得到相对纯净的过氧化钠,应将空气通过盛有浓氢氧化钠溶液的洗气瓶除去二氧化碳,再通过盛有浓硫酸的洗气瓶除去水蒸气,则净化空气的装置接口从左至右的连接顺序是edbc,故答案为:
edbc;
(3)过氧化钠与稀硫酸反应生成硫酸钠、氧气和水,反应的化学方程式为2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑,故答案为:
2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑;
(4)该实验设计的原理是烧瓶中过氧化钠与硫酸反应生成硫酸钠、氧气与水,用浓氢氧化钠溶液吸收氧气中可能混有二氧化碳,用澄清石灰水检验二氧化碳是否除尽,用排水法收集氧气,根据氧气体积可以计算过氧化钠的质量,进而计算样品中过氧化钠的质量分数,二氧化碳与浓氢氧化钠溶液反应的化学方程式为2NaOH+CO2=H2O+Na2CO3,故答案为:
2NaOH+CO2=H2O+Na2CO3;检验CO2是否除尽;
(5)装置F中仪器i的名称为分液漏斗,分液漏斗和烧瓶用导管连接可以平衡气压,使稀硫酸顺利流下,还可以抵消滴加硫酸排出空气的体积,若没有该导管,排出的空气按生成氧气的体积计算,导致测定氧气体积偏大,则测定Na2O2样品的纯度偏大,故答案为:
分液漏斗;偏大;
(6)过氧化钠与稀硫酸反应的化学方程式为2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑,标况下1.12L氧气的物质的量为
=0.05mol,由方程式可知过氧化钠的质量为0.05mol×2×78g/mol=7.8g,则过氧化钠的纯度为
×100%=78.0%,故答案为:
78.0%。
【点睛】
分液漏斗和烧瓶用导管连接可以平衡气压,使稀硫酸顺利流下,还可以抵消滴加硫酸排出空气的体积,若没有该导管,排出的空气按生成氧气的体积计算是分析的难点,也是解答的易错点。
2.过氧化钠是一种淡黄色固体,有漂白性,能与水、酸性氧化物和酸反应。
(1)一定条件下,m克的H2、CO的混合气体在足量的氧气中充分燃烧,产物与过量的过氧化钠完全反应,过氧化钠固体增重___克。
(2)常温下,将14.0克的Na2O和Na2O2的混合物放入水中,得到400mLpH=14的溶液,则产生的气体标准状况下体积为___L。
(3)在200mLAl2(SO4)3和MgSO4的混合液中,加入一定量的Na2O2充分反应,至沉淀质量不再减少时,测得沉淀质量为5.8克。
此时生成标准状况下气体体积为5.6L。
则原混合液中c(SO42-)=___mol/L。
(4)取17.88gNaHCO3和Na2O2的固体混合物,在密闭容器中加热到250℃,经充分反应后排出气体,冷却后称得固体质量为15.92g。
请列式计算:
①求原混合物中Na2O2的质量B___;
②若要将反应后的固体反应完,需要1mol/L盐酸的体积为多少毫升___?
【答案】m1.1227.8g200mL≤V≤320mL
【解析】
【分析】
(1)利用差量法,根据化学方程式分析:
CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应;2CO+O2
2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应2CO2+2Na2O2=2Na2CO3+O2,质量增重△m为2Na2CO3﹣2Na2O2=2CO,可知,反应后固体质量增加量为CO的质量;2H2+O2
2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m为2H2O﹣O2=2H2,可知,反应后固体增加的质量为氢气质量;
(2)氧化钠、过氧化钠与水反应后的溶质为氢氧化钠,根据n=
计算出氢氧化钠的物质的量,再根据质量守恒、钠原子守恒列式计算出氧化钠、过氧化钠的物质的量,最后根据c=
计算出氢氧根离子的物质的量、根据过氧化钠与水的反应方程式计算出生成的标况下氧气的体积;
(3)生成标准状况下气体体积为5.6L,物质的量为:
=0.25mol,所以过氧化钠的物质的量为0.5mol,所以氢氧化钠的物质的量为:
0.5mol×2=1mol,沉淀质量为5.8克,即氢氧化镁的质量为5.8克,所以氢氧化镁的物质的量为:
=0.1mol,生成氢氧化镁消耗氢氧根离子的物质的量为0.1×2=0.2mol,则铝离子转化为偏铝酸根离子消耗氢氧根的物质的量为0.8,所以铝离子的物质的量为0.2mol,所以溶液中硫酸根离子的物质的量为:
0.3+0.1=0.4mol,则c=
=2mol/L;
(4)①结合发生的反应2Na2O2+4NaHCO3=4Na2CO3+2H2O↑+O2↑和2Na2O2+2NaHCO3=2Na2CO3+2NaOH+O2↑计算;
②反应后固体为0.08mol的NaOH和0.12mol的Na2CO3,再结合反应原理计算。
【详解】
(1)CO和H2的混合气体燃烧的方程式:
2CO+O2
2CO2,2H2+O2
2H2O,与Na2O2反应的方程式:
2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2,通过方程式可以看出,固体质量的增加量就是原混合气体的质量为mg;
(2)设14.0g混合物中含有氧化钠xmol,含有过氧化钠ymol,则①62x+78y=14,最后得到的溶质为NaOH,得到400mLpH=14的溶液,氢氧化钠的物质的量为:
0.4×1=0.4mol,根据钠原子守恒可得:
②2x+2y=0.4,联合①②解得:
x=0.1、y=0.1,所以0.1mol的过氧化钠生成0.05mol的氧气,标况下生成的氧气的体积为:
V(O2)=22.4L/mol×0.05mol=1.12L;
(3)生成标准状况下气体体积为5.6L,物质的量为:
=0.25mol,所以过氧化钠的物质的量为0.5mol,所以氢氧化钠的物质的量为:
0.5mol×2=1mol,沉淀质量为5.8克,即氢氧化镁的质量为5.8克,所以氢氧化镁的物质的量为:
=0.1mol,生成氢氧化镁消耗氢氧根离子的物质的量为0.1×2=0.2mol,则铝离子转化为偏铝酸根离子消耗氢氧根的物质的量为0.8,所以铝离子的物质的量为0.2mol,所以溶液中硫酸根离子的物质的量为:
0.3+0.1=0.4mol,则c=
=2mol/L,故答案为:
2;
(4)①设Na2O2和NaHCO3的物质的量分别为x,y;
15.41<15.92<16.11说明两个反应都发生,所以:
78x+84y=17.88、106y+(2x﹣y)×40=15.92,解之得:
x=0.1mol、y=0.12mol,故m(Na2O2)=7.8g;
②反应后固体为0.08mol的NaOH和0.12mol的Na2CO3,当反应后溶质为NaCl、NaHCO3时,则需盐酸体积为200mL;当反应后溶质只有NaCl时,则需盐酸体积为320mL,故盐酸体积为200mL≤V≤320mL。
【点睛】
本题考查有关物质的量的计算、混合物的计算,注意掌握有关物质的量的计算方法,明确质量守恒定律、极值法在化学计算中的应用,试题有利于提高学生的化学计算能力。
3.现有下列物质:
①KCl②CH4③NH4NO3④I2⑤Na2O2⑥HClO4⑦N2⑧CO⑨SO2⑩金刚石⑪CH3CH2OH⑫MgO⑬MgCl2⑭KOH⑮HCl⑯Al2O3
请回答下列问题。
(1)两性氧化物是___(填序号),其电子式为___。
(2)最简单的有机化合物是___(填序号),用电子式表示其形成过程:
___。
(3)属于共价化合物的是___(填序号),含有共价键的离子化合物是___(填序号)。
(4)由两种元素组成,且含有离子键和共价键的化合物为___(填序号),这两种元素的单质反应生成该化合物的化学方程式为___。
【答案】⑯
②
②⑥⑧⑨⑪⑮③⑤⑭⑤2Na+O2
Na2O2
【解析】
【分析】
(1)两性氧化物指的是能与碱和酸反应生成盐和水的氧化物;
(2)最简单的有机化合物是CH4,甲烷为共价化合物;
(3)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物为离子化合物,离子化合物中可能含有共价键,只含共价键的化合物为共价化合物;
(4)由两种元素组成,且离子键、共价键都含有的是Na2O2。
【详解】
(1)两性氧化物指的是能与碱和酸反应生成盐和水的氧化物,这里只有Al2O3,Al2O3是离子化合物,其电子式为:
,故答案为:
⑯;
;
(2)最简单的有机化合物是CH4,甲烷为共价化合物,用电子式表示其形成过程为:
,故答案为:
②;
;
(3)只含共价键的化合物为共价化合物,CH4、HClO4、CO、SO2、CH3CH2OH、HCl中只含共价键,属于共价化合物;含有共价键的离子化合物有:
NH4NO3、Na2O2、KOH,故答案为:
②⑥⑧⑨⑪⑮;③⑤⑭ ;
(4)由两种元素组成,且离子键、共价键都含有的是Na2O2,钠和氧气反应生成过氧化钠的化学方程式:
2Na+O2
Na2O2,故答案为:
⑤;2Na+O2
Na2O2。
【点睛】
一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,含有离子键的化合物为离子化合物,离子化合物中可能含有共价键,只含共价键的化合物为共价化合物。
4.(Ⅰ)现有一包固体粉末,其中可能含有如下五种物质:
、
、
、
、
。
已知
难溶于水,
溶液呈蓝色。
现进行如下实验:
①溶于水得无色溶液;②向溶液中加入
溶液生成白色沉淀,再加盐酸时沉淀消失。
根据上述实验现象推断:
(1)一定不存在的物质是(填写化学式)_________________________;
(2)一定存在的物质是(填写化学式)_________________________;
(3)可能存在的物质是(填写化学式)_________________________;
(4)检验可能存在的物质所用试剂名称为:
_________________________;
(Ⅱ)(5)钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
钠钾合金可在核反应堆中用作热交换液。
钠钾合金溶于
水生成
氢气。
确定该钠-钾合金的组成(用
的形式表示):
__________;如果所得溶液的体积仍为
,则
溶液的物质的量浓度为___________________。
【答案】CaCO3、Na2SO4、CuSO4Na2CO3NaCl稀硝酸、硝酸银溶液NaK20.2mol/L
【解析】
【分析】
(Ⅰ)由①溶于水得无色溶液,可知一定不含CuSO4、CaCO3;由②向溶液中加入BaCl2溶液生成白色沉淀,再加盐酸时沉淀消失,可知白色沉淀为碳酸钡,则一定含Na2CO3,不含Na2SO4,不能确定是否含NaCl,以此来解答;(II)根据发生反应:
2Na+2H2O=2NaOH+H2↑、2K+2H2O=2KOH+H2↑,根据氢气体积、金属质量列方程计算Na、K物质的量;根据
计算可得。
【详解】
由①溶于水得无色溶液,可知一定不含CuSO4、CaCO3;由②向溶液中加入BaCl2溶液生成白色沉淀,再加盐酸时沉淀消失,可知白色沉淀为碳酸钡,则一定含Na2CO3,不含Na2SO4,不能确定是否含NaCl;
(1)一定不存在的物质是CaCO3、Na2SO4、CuSO4,故答案为:
CaCO3、Na2SO4、CuSO4;
(2)一定存在的物质是Na2CO3,故答案为:
Na2CO3;
(3)可能存在的物质是NaCl,故答案为:
NaCl:
(4)由氯离子的检验方法可知,检验可能存在的物质所用试剂为稀硝酸、硝酸银溶液,故答案为:
稀硝酸、硝酸银溶液。
(5)设钠、钾的物质的量分别为amol、bmol,则
0.5a+0.5b=0.15,23a+39b=10.1,计算可得:
a=0.10,b=0.20,n(Na):
n(K)=1:
2,该钠-钾合金化学式为NaK2,c(NaOH)=
,故答案为:
NaK2;0.2mol/L。
5.如图为碳元素的价类二维图,结合图中的物质部分转化关系,完成下列问题:
(1)下列说法正确的是__________
a.要实现反应①一定要与氧化剂作用
b.要实现反应②一定要与还原剂作用
c.在一定条件下木炭与浓硝酸能实现反应①转化
d.反应⑤属于非氧化还原反应
(2)下列有关碳及其化合物类别及性质说法不正确的是__________
a.CO不属于酸性氧化物,具有还原性
b.CO2属于酸性氧化物,可以与碱反应生成碳酸盐
c.NaHCO3属于弱酸的酸式盐,既能与硫酸反应又能与NaOH反应
d.金刚石和石墨互为同素异形体,其物理性质和化学性质均相同
(3)高炉炼铁的过程是将铁矿石(Fe2O3)还原成金属铁的过程,实现了反应③的转化,请写出其反应的化学方程式,并用“双线桥”表示电子的得失情况______________________________。
(4)化学活动课上,两组同学分别用如图所示甲、乙两装置探究“Na2CO3、NaHCO3与稀盐酸的反应”。
按下表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。
请回答:
①两组反应开始时,装置___________(填“甲”或“乙”)中的气球体积先变大,该装置中反应的离子方程式是______________________。
②当试管中不再有气体生成时,两组实验出现不同现象。
试剂用量
实验现象
分析原因
第A组
0.84gNaHCO3
1.06gNa2CO3
6ml4mol·L-1盐酸
甲中气球与乙中气球的
体积相等
甲、乙盐酸均过量
n(NaHCO3)=n(Na2CO3)
V(CO2)甲=V(CO2)乙
第B组
1.2gNaHCO3
1.2gNa2CO3
6ml2mol·L-1盐酸
甲中气球比乙中气球的体积大
片刻后,乙中气球又缩小,甲中气球的体积基本不变
按上表第A组原因分析方法,分析第B组实验甲中气球为比乙中气球体积大的原因__________。
用离子方程式表示第B组乙中气球又缩小的原因:
______________。
【答案】ACD
甲H++HCO3-=CO2↑+H2O甲、乙盐酸均不足,消耗的n(NaHCO3)﹥n(Na2CO3),V(CO2)甲﹥V(CO2)乙CO32-+CO2+H2O=2HCO3-
【解析】
【分析】
(1)根据氧化还原反应的有关规律判断;
(2)a.CO不属于酸性氧化物,C元素化合价为+2价,具有还原性,故a正确;
b.CO2属于酸性氧化物,可以与碱反应生成碳酸盐,故b正确;
c.NaHCO3属于弱酸的酸式盐,既能与硫酸反应生成二氧化碳和水,又能与NaOH反应生成碳酸钠,故c正确;
d.金刚石和石墨互为同素异形体,其化学性质相似,物理性质有很大差异,故d错误;
(3)Fe2O3在高温下可以被CO还原成Fe单质,Fe元素由+3价下降到0价,得到3个电子;
(4)①碳酸氢钠和盐酸反应的速率更快;
②按上表第A组原因分析方法,分析第B组实验中反应物之间的数量关系,二氧化碳可以溶于碳酸钠溶液中。
【详解】
(1)a.①C
CO2,C化合价升高作为还原剂,需要加入氧化剂才能实现,故a正确;
b.①C
CO,C化合价升高作为还原剂,需要加入氧化剂才能实现,故b错误;
c.木炭与浓硝酸在加热的条件下可以生成二氧化碳,可以实现反应①转化,故c正确;
d.反应⑤中C化合价变化,属于氧化还原反应,故d错误;
正确答案是ac;
(2)a.CO不属于酸性氧化物,C元素化合价为+2价,具有还原性,故a正确;
b.CO2属于酸性氧化物,可以与碱反应生成碳酸盐,故b正确;
c.NaHCO3属于弱酸的酸式盐,既能与硫酸反应生成二氧化碳和水,又能与NaOH反应生成碳酸钠,故c正确;
d.金刚石和石墨互为同素异形体,其化学性质相似,物理性质有很大差异,故d错误;
题目要求选错的,故选d;
(3)Fe2O3在高温下可以被CO还原成Fe单质,Fe元素由+3价下降到0价,得到3个电子,用“双线桥”表示电子的得失情况为:
(4)①碳酸钠和盐酸的反应可以分成两步:
第一步Na2CO3+HCl=NaHCO3+NaCl,第二步 NaHCO3+HCl=NaCl+H2O+CO2
,而碳酸氢钠只进行第二步反应,所以更快一些,故装置甲中的气球体积先变大,甲中发生的离子方程式是:
H++HCO3-=CO2↑+H2O;
②根据化学方程式计算可知A组中NaHCO3和Na2CO3都已完全反应。
B组中,n(Na2CO3)=
=0.011mol,n(NaHCO3)=
=0.014mol,n(HCl)=0.012mol,根据反应NaHCO3 +HCl=NaCl+CO2↑+H2O和Na2CO3+2HCl=2NaCl+CO2↑+H2O可知,Na2CO3、NaHCO3都过量,NaHCO3产生的CO2较Na2CO3的多。
因为气体收集于气球中,乙中CO2又与过量的Na2CO3溶液反应,故甲中气球比乙中气球的体积大片刻后,乙中气球又缩小,甲中气球的体积基本不变,分析原因为:
甲、乙盐酸均不足,消耗的n(NaHCO3)﹥n(Na2CO3),V(CO2)甲﹥V(CO2)乙;CO2与过量的Na2CO3溶液反应为:
CO32-+CO2+H2O=2HCO3-。
6.纯碱是重要的化工原料,在医药、冶金、化工、食品等领域被广泛使用。
某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如下:
(1)工业生产纯碱的第一步是除去饱和食盐水的中SO42-、Ca2+离子,依次加入的试剂及其用量是______________、_______________、过滤、_______________。
(2)已知:
几种盐的溶解度
NaCl
NH4HCO3
NaHCO3
NH4Cl
溶解度(20°C,100gH2O时)
36.0
21.7
9.6
37.2
①写出装置I中反应的化学方程式_____________________________________。
②写出装置II中发生反应的化学方程式________________________________。
(3)该流程中可循环利用的物质是__________________。
(4)若制出的纯碱中只含有杂质NaCl。
①检验用该纯碱配制的溶液中含有Cl―的方法是_________________________。
②向m克纯碱样品中加入足量CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为bg,则该纯碱的纯度(质量分数)为__________(用m、b来表示)。
【答案】过量BaCl2溶液过量Na2CO3溶液适量(过量)稀盐酸NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl2NaHCO3
Na2CO3+H2O+CO2↑CO2取少量纯碱样品,加入足量的稀硝酸,再加入硝酸银溶液,若生成白色沉淀,则说明含有氯离子。
×100%
【解析】
【分析】
(1)工业上除去SO42-用含有Ba2+的可溶性盐、除去Ca2+用含有CO32-的可溶性盐;
(2)①NaCl、CO2、NH3、H2O发生反应生成NaHCO3和NH4Cl;
②受热条件下,碳酸氢钠分解生成碳酸钠、二氧化碳和水;
(3)装置II中得到二氧化碳,装置I中需要二氧化碳;
(4)①Cl-的检验常用硝酸酸化的硝酸银溶液,生成不溶于稀硝酸的AgCl沉淀;
②向m克纯碱样品中加入足量CaCl2溶液反应生成碳酸钙,则最后得到的bg为碳酸钙的质量,根据碳原子守恒由碳酸钙的物质的量可得到碳酸钠的物质的量,在求算出理论上碳酸钠的质量,进而求算纯碱的纯度。
【详解】
(1)除去饱和食盐水的中SO42-要用BaCl2溶液,除去饱和食盐水的中Ca2+要用Na2CO3溶液,并且除杂时试剂应该过量,最后用稀盐酸调节pH=7,
故答案为:
足量BaCl2溶液、足量Na2CO3溶液、适量稀盐酸;
(2)①先向食盐水中通入NH3使溶液呈碱性,CO2、NH3和H2O反应生成NH4HCO3,由于溶解度小NaHCO3,所以NaCl和NH4HCO3反应生成NaHCO3和NH4Cl,即
NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl,
故答案为:
NaCl+CO2+NH3+H2