最新初中科学竞赛辅导《酸碱盐》经典计算20题.docx
《最新初中科学竞赛辅导《酸碱盐》经典计算20题.docx》由会员分享,可在线阅读,更多相关《最新初中科学竞赛辅导《酸碱盐》经典计算20题.docx(17页珍藏版)》请在冰豆网上搜索。
最新初中科学竞赛辅导《酸碱盐》经典计算20题
初中科学难题辅导《酸碱盐》经典计算20题
1、普通黄铜仅由铜和锌组成,广泛用于制造板材、管材等,也用于铸造机械零件。
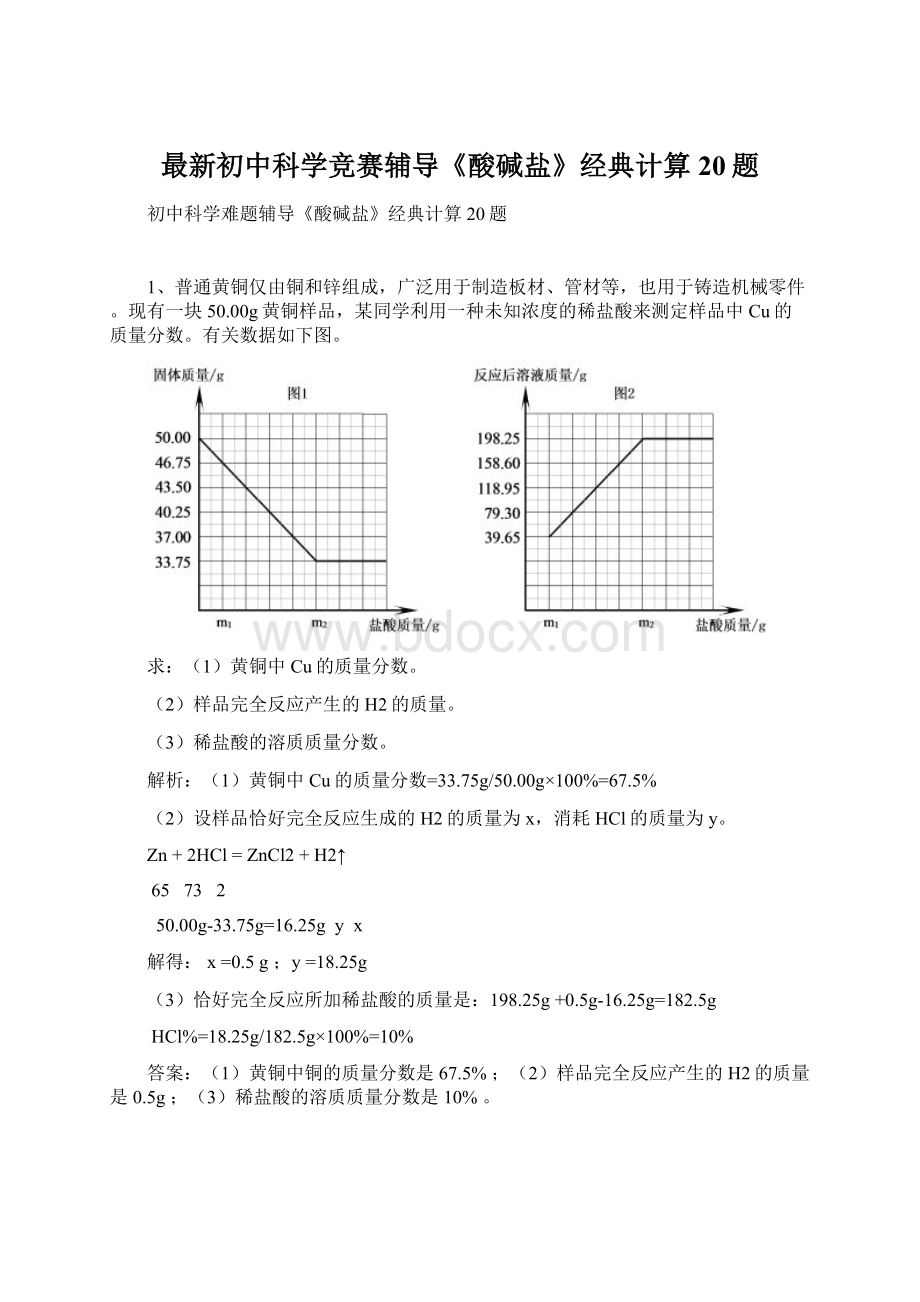
现有一块50.00g黄铜样品,某同学利用一种未知浓度的稀盐酸来测定样品中Cu的质量分数。
有关数据如下图。
求:
(1)黄铜中Cu的质量分数。
(2)样品完全反应产生的H2的质量。
(3)稀盐酸的溶质质量分数。
解析:
(1)黄铜中Cu的质量分数=33.75g/50.00g×100%=67.5%
(2)设样品恰好完全反应生成的H2的质量为x,消耗HCl的质量为y。
Zn+2HCl=ZnCl2+H2↑
65732
50.00g-33.75g=16.25gyx
解得:
x=0.5g;y=18.25g
(3)恰好完全反应所加稀盐酸的质量是:
198.25g+0.5g-16.25g=182.5g
HCl%=18.25g/182.5g×100%=10%
答案:
(1)黄铜中铜的质量分数是67.5%;
(2)样品完全反应产生的H2的质量是0.5g;(3)稀盐酸的溶质质量分数是10%。
2、取一定量含有杂质的某金属R的样品,投入到73g质量分数为20%的盐酸中,金属与盐酸恰好完全反应(杂质不参加反应也不溶于水),测得所得金属氯化物中氯元素的质量分数质量分数为74.4%。
计算:
(1)样品中含金属R的质量?
(2)所得溶液中溶质的质量分数?
解析:
73g质量分数为20%的盐酸中HCl的质量=73×20%=14.6g
其中含Cl=14.6×35.5/(35.5+1)=14.2g
含H=14.6-14.2=0.4g
设样品中金属R的质量为m
依题意有14.2/(14.2+m)=74.7%
解得:
m=4.8g
所得溶液中溶质的质量分数=(4.8+14.2)/(4.8+73-0.4)×100%=24.5%
3.某学生在课外活动中用一定量的二价金属R和稀硫酸反应来制取氢气,所做的五次实验结果记录如下表(假设每次实验所产生的氢气全部被收集,气体体积在相同条件下测定)。
实验编号
R的质量/g
稀硫酸的体积/mL
生成H2的体积/L
1
1.5
50.0
1.47
2
2.0
50.0
1.96
3
2.2
50.0
2.16
4
2.5
50.0
2.16
5
3.0
50.0
2.16
根据上述实验结果回答下列问题:
(1)上述实验中,金属一定过量的组的编号是,稀硫酸一定过量的组的编号是。
(2)若在当时实验条件下,H2的密度为0.085g/L,则反应所用金属R的相对原子质量是多少?
(3)若所使用的稀硫酸密度为1.12g/cm3,则反应所用的硫酸溶液中溶质的质量分数是多少?
解析:
(1)根据数据和酸的量不变,酸过量时,金属质量和氢气的量成正比,酸不足时,氢气的量不变,则金属一定过量的是实验4和5,酸一定过量的是实验1和2;
(2)设金属的相对原子质量为X,则:
R+H2SO4═RSO4+H2↑
X 2
1.5 0.085×1.47
X/1.5=2/(0.085×1.47)
解得:
X═24
(3)设硫酸的质量分数为y,则
R+H2SO4═RSO4+H2↑
98 2
50×1.12×y 0.085×2.16
98/2=(50×1.12y)/(0.085×2.16)
解得y≈16%
答案:
(1)4和5;1和2;
(2)所用金属R的相对原子质量是24;(3)反应所用的硫酸溶液中溶质的质量分数是16%。
4、向49克稀硫酸中加入50克20.8%的氯化钡溶液,充分反应后,硫酸有剩余。
滤出沉淀,向滤液中加入32克25%的氢氧化钠溶液后,测得溶液正好呈中性,求硫酸的质量分数。
解析:
(1)常规解法:
H2SO4+BaCl2=BaSO4↓+2HCl
由氯化钡的质量10.4g,可求得硫酸的质量是4.9g,生成的HCl质量为3.65g;
HCl+NaOH=NaCl+H2O
由HCl质量为3.65g可算出与之反应的NaOH质量为4克;
H2SO4+2NaOH=Na2SO4+2H2O
由氢氧化钠的质量8g-4g,可算出与之反应的硫酸质量是4.9g
所以,硫酸的总质量是9.8g
质量分数=9.8/49×100%=20%
(2)捷径解法
H2SO4~2NaOH
9880
x32×25%g
解得x=9.8g
H2SO4=9.8/49×100%=20%
5、现有一种Na2CO3和NaHCO3的混合物,某同学为测定其含量,取一定量的该样品溶于水,逐滴加入稀盐酸并不断振荡,首先发生反应:
Na2CO3+HCl=NaHCO3+NaCl,然后才发生反应:
NaHCO3+HCl=NaCl+CO2↑+H2O。
已知:
该温度下CO2密度为1.98g/L,实验测得产生
的CO2的与加入稀盐酸的数据如右图。
(1)当加入g盐酸时,才开始产生CO2;图中V=mL。
(2)请计算:
①所加入盐酸中HCl的质量分数为多少?
②原样品中Na2CO3和NaHCO3的质量各是多少?
解析:
(1)查图可知,当加入5g盐酸时,才开始产生CO2;图中V=444mL。
(2)①444mLCO2的质量为:
444mL×1.98g/L=0.88g
设产生0.88gCO2时,消耗HCl的质量为xg
NaHCO3+HCl=NaCl+CO2↑+H2O
36.544
x0.88g
解得:
x=0.73g
HCl%=0.73÷(15-5)×100%=7.3%(方法可有多种)
②设加入5g盐酸时,有ygNa2CO3转化为zgNaHCO3。
Na2CO3+HCl=====NaHCO3+NaCl
10636.584
y5g×7.3%z
解得:
y=1.06g.;z=0.84g.
556mLCO2的质量为:
[556mL÷(1000mL)]×1.98g/L=1.10g
设放出556mLCO2时反应的NaHCO3质量为m。
则:
NaHCO3+HCl=NaCl+CO2↑+H2O
8444
m1.10g
解得:
m=2.10g
则原样品中NaHCO3的质量为:
2.1g-0.84g=1.26g
答案:
(1)5444
(2)①盐酸中HCl的质量分数为7.3%;②原样品中有Na2CO31.06g.、NaHCO31.26g。
6.有一置于水中用特殊材料制成的密闭容器,气体分子可以通过该容器的器壁,而液体和固体则不能通过。
容器质量为1g,体积为0.04L。
容器内盛有32.5g质量分数为40%的稀硫酸,如果向其中加入锌粒,要想保持容器在水中不沉底,则锌粒的质量最大不能超过多少?
解析:
要使容器在水中不下沉,容器和它内部的物质产生的重力最大不能超过水对容器的浮力F,即:
[m(容器)+m(硫酸)+m(锌粒)-m(氢气)]g=F
设加入的锌粒的质量为x,由:
Zn+H2SO4==ZnSO4+H2↑
652
x2x/65
生成氢气的质量为x/32.5克
则有:
[32.5×10-3kg+1×10-3kg+x-(x/32.5)]×9.8N/kg
=0.04×10-3m3×1000kg/m3×9.8N/kg
x=6.5×10-3kg=6.5g
答案:
加入锌粒的质量最大不能超过6.5g。
7.某学校科学兴趣小组为了探究实验室中久置的NaOH的变质程度,具体如下:
【研究方案】先称取13.3g的NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入质量分数为14.6%的稀盐酸,根据生成CO2的质量测定Na2CO3的质量。
从而进一步确定样品中NaOH的变质程度。
(变质程度是指已变质的NaOH在原NaOH 中的质量分数)
【解决问题】实验测得加入稀盐酸的质量与产生CO2气体的质量关系如图所示。
此NaOH 的变质程度(用质量分数表示)是多少?
。
【继续探究】求实验过程中与NaOH反应所用的盐酸的质量是多少?
【发现问题】根据“与NaOH反应所用的盐酸的质量”,对照图像,你发现了什么问题(不必回答具体原因):
。
解析:
[解决问题]由反应产生2.2克CO2可算出Na2CO3的质量为5.3克;进一步可算出变质的NaOH质量为4.0克;
故NaOH的变质程度为4.0/(13.3-5.3+4.0)×100%=33.3%
[深入探究]m(NaOH)=13.3g-5.3g=8g
NaOH+HCl=NaCl+H2O
40 36.5
8g m(HCl)’
m(HCl)’=8g×36.5/40=7.3g
m[HCl(溶液)]=7.3g/14.6%=50.0g
[发现问题]NaOH被中和后,滴加盐酸,为什么没有立即产生CO2气体(其他合理答案也可)。
8.某化学兴趣小组在做Fe和CuS04溶液反应实验时,发现生成Cu的同时有气泡产生。
为了进一步研究做了如下实验:
①取8.5gFe粉放入一定量的CuS04溶液中,反应完成后,滤出固体,洗涤、干燥后称量,固体质量为9.2g。
②将9.2g固体与一定质量分数的稀盐酸充分反应,消耗盐酸50.0g,根据实验绘制反应产生氢气的质量与反应时间的关系图(见右图)。
求:
(1)稀盐酸的质量分数,与稀盐酸反应的Fe的质量。
(2)与CuS04反应的Fe的质量。
(3)与CuS04反应的Fe的质量及与盐酸反应的Fe
的质量之和_______8.5g(选填“>”、“<”、“=”)。
对此结果作出你的解释。
解析:
(1)设9.2g固体中Fe的质量为x,盐酸的质量分数为w。
Fe+2HCI=FeCl2+H2
56732
x50.0g×w0.10g
56:
2=x:
0.10g
解得:
x=2.8g
73:
2=50.0g×w:
0.10g
解得:
w=7.3%
(2)设与CuS04反应的Fe的质量为y
Fe+CuS04=FeS04+Cu
5664
y(9.2-2.8)g
56:
64=y:
(9.2-2.8)g
解得y=5.6g
(3)2.8g+5.6g=8.4g<8.5g
因为有少量Fe与CuS04溶液中的酸性物质发生了反应。
答案:
(1)稀盐酸的质量分数为7.3%,与稀盐酸反应的Fe的质量2.8g;
(2)与CuS04反应的Fe的质量为5.6g。
(3)与CuS04反应的Fe的质量及与盐酸反应的Fe的质量之和<8.5g,其原因是有少量Fe与CuS04溶液中的酸性物质发生了反应。
9、为了测定某氢氧化钠固体是否含有碳酸钠(不含其他杂质),现用纯氢氧化钠与其进行对比实验如下:
①称取纯氢氧化钠和待测氢氧化钠各mg分别配成25.0g溶液,均滴加酚酞试液2~3滴。
②把12.0%的盐酸逐滴加入实验①配成的两种溶液中,当酚酞试液刚好由红色变为无色(溶液呈中性)时,纯氢氧化钠配成的溶液消耗盐酸n1g,待测氢氧化钠配成的溶液消耗盐酸n2g。
(1)若m=2.73g,n1=n2=20.8g,则待测氢氧化钠配成的溶液中NaOH的质量分数是多少?
(2)若m=2.73g,n1=20.8g,n2=19.7g,则待测氢氧化钠配成的溶液中NaOH的质量分数是多少?
解析:
(1)因为n1=n2,所以无杂质。
待测氢氧化钠配成溶液中氢氧化钠质量分数为2.73/25.0×100%=10.92%;
(2)由纯氢氧化钠与盐酸的反应,设反应消耗的HCl为xg;
NaOH+HCl=NaCl+H2O
4036.5
2.73x
40/2.73=36.5/x
解得:
x=2.49g
所以滴定所用盐酸的质量分数为2.49/20.8×100%=11.97%
由带杂质的氢氧化钠的反应,设2.73g待测氢氧化钠中含纯NaOHyg,则含Na2CO3(2.73-y)g;
Na2CO3+2HCl=Na2CO3+H2O+CO2↑
10673
2.73-y
可求出Na2CO3消耗的HCl为73(2.73-y)/106
NaOH+HCl=NaCl+H2O
4036.5
y
可求NaOH消耗的HCl为36.5y/40;
所以一共消耗的HCl为73(2.73-y)/106+36.5y/40=19.7×11.97%
解得y=2.5
所以氢氧化钠溶液的质量分数为2.5/25=10%
10.将一些氧化铜粉末加入到100克14%的硫酸溶液中,微热至氧化铜全部溶解。
再向该蓝色溶液中加入铁粉16.8克,充分反应过滤,仍得到干燥后的固体物质16.8克。
求:
(l)原加入的氧化铜质量是多少充?
(2)最后得到的溶液的质量分数是多少?
解析:
(1)设参加反应的铁的总质量为X
Fe—H2SO4
5698
X100×14%
解得X=8克
设与硫酸铜发生置换反应的铁的质量为m,与过量硫酸反应的铁的质量为n
Fe+CuSO4=FeSO4+Cn△m
56648
m
因n=
得
因m+n=8所以:
设氧化铜的质量为y
Fe—CuSO4—CnO
5680
7y
解得y=10克
(2)设FeSO4质量为Z
H2SO4——FeSO4
98152
100×14%gZ
解得Z=21.71克
设1克铁与硫酸反应生成H2的质量V
Fe ~ H2
562
1V
解得V=0.036克
所以硫酸亚铁溶液的溶质质量分数为:
11、现有16gFe2O3和CuO的混合物,进行如下实验;把混合物全部加入到100g足量的硫酸溶液中,完全溶解。
然后滴加150g16%的氢氧化钠溶液,沉淀质量不再改变。
试计算所用硫酸溶液溶质的质量分数。
解析:
设100g硫酸溶液中H2SO4的质量为x,由Na+和SO42-之间的关系得:
H2SO4 ~ 2NaOH
9880
x150g×16%
x=(98×150×16%)g/80=29.4g
H2SO4%=29.4g/100g×100%=29.4%
答案:
所用硫酸溶液溶质的质量分数为29.4%。
12、社会实践活动中,课外兴趣小组对某钢铁厂的铁矿石样品和钢样进行实验、分析、计算,
了解了该钢铁厂生产原料、产品的相关信息。
下面请你根据他们的实验帮助计算回答:
取该厂的某钢样粉末28.36g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到3g白色沉淀。
(1)计算此钢样粉末中铁和碳的质量之比。
(2)再取三份不同质量的钢样粉末分别加到50 g质量分数相同的硫酸中,充分反应后,测得的实验数据如下表所示:
(标准状况下,2gH2的体积为22.4 L)
实验序号
Ⅰ
Ⅱ
Ⅲ
加入钢样粉末的质量/g
2.836
5.672
8.508
生成气体的体积(标准状况)/L
1.12
2.24
2.80
请根据表中数据计算硫酸中H2SO4的质量分数。
(3)若在实验Ⅱ中继续加入mg钢样粉末,计算反应结束后剩余的固体质量为多少?
(用含m的代数式表示)
解析:
(1)利用C的与O2反应生成CO2,使澄清石灰水变成CaCO3沉淀,故可以通过质量比求出C的质量为0.36g,所以Fe的质量为28.36-0.36=28g,故铁和碳的质量之比为28:
0.36=700:
9;
(2)中的三组钢样粉末中的铁和碳的质量之比均为700:
9,注意观察质量5.672刚好是2.836的两倍,8.508刚好是2.836的三倍,但气体数据中2.240是1.120的两倍,而2.800少于1.120的3倍,因此III组中是钢样过量,硫酸全部反应完毕,因此我们必须选择第III组中的气体数据进行运算,所以氢气的质量为2.800*2/22.4=0.25g,继而不难求出的质量分数为24.50%;
(3)由
(2)的计算可以得知II组中的5.672g钢样中的Fe已全部反应,而硫酸有剩余。
如继续加入mg钢样粉末,有可能使钢样粉末过量,因此答案就可以分为两种范围,不难计算m=1.418g时候,两者刚好完全反应,而当m>1.418g时,硫酸已经反应完,固体不再和酸反应了。
答案:
(1)700︰9 ;
(2)24.50%; (3)当m>1.418g,剩余固体的质量为:
(m-1.328)g
当m≤1.418g,剩余固体的质量为:
(5.672+m)×9/709g。
13、A、B两块纯铜片,插在CuSO4稀溶液中,铜片通过导线、变阻器和开关分别与直流电源的两极相连.调节变阻器滑片位置,使电流强度为0.21安.通电1小时后,测得铜片A的质量增加了0.25克,则A铜片应与直流电源的负
极相连;据此计算64克铜中有多少个铜原子?
(一个电子电量是1.6×10-19库仑)
解析:
负极增重,因为铜离子在负极得到电子变成铜,沉积在电极上了;1小时内,电路中流过的电量Q=It=0.21A×3600s=756C.一个铜离子带两个单位正电荷,也就是说它在负极沉积的时候会得到2个电子,所以,一共将有铜离子N=Q/2e=756C÷[2×1.6×10-19]C=2.3625×1021.
铜原子质量M=0.25g/N,所以,64g铜里含有铜原子的数目为:
n=64/0.25×2.3625×1021=6.05×1023个。
14、常温下,在20g盐酸和硫酸混合液中,逐滴加入17.1%的氢氧化钡溶液。
当碱液滴加至20g,硫酸钡沉淀达到最大值;当碱液加至60g时,溶液PH=7求:
(1)原混合液中硫酸的质量分数。
(2)当pH=7时溶液中溶质的质量。
解析:
(1)设原混合物中硫酸的质量为x
H2SO4+Ba(OH)2=BaS04↓+2H2O
98171
x20gx17.1%
98:
171=x:
20gxl7.1%
x=1.96g
原混合液中硫酸的质量分数为1.96/20gx100%=9.8%
(2).设pH=7时,溶液中溶质BaCl2的质量为y
2HCl+Ba(OH)2=BaCl2+2H2O
171208
(60g-20g)×17.1%y
171:
208=(60g-20g)×17.1%:
y
y=8.32g
答案:
原混合液中硫酸的质量分数为9.8%;当pH=7时溶液中的溶质BaCl2为8.32g。
15、某固体物质由MgSO4和NaOH组成,取24.0g该固体混合物溶于水后,向所得的混合物中逐滴加入质量分数为15%的硫酸溶液(密度为1.1g•mL-1),加入的稀H2SO4的体积x(单位:
mL)与所得沉淀质量y(单位;g)有如图所示的关系,求该固体混合物中NaOH、MgSO4的质量各为多少克?
解析:
①由图示数据可知,与氢氧化镁沉淀反应的硫酸溶液的体积为:
89mL-29.7mL=59.3mL
则H2SO4质量为:
59.3mL×1.1g/mL×15%≈9.8g,
设参与反应的沉淀氢氧化镁的质量为x,
Mg(OH)2+H2SO4═MgSO4+2H2O
58 98
x 9.8g
∴58:
98=x:
9.8g,
解之得:
x=9.8g×58/98=5.8g;
②设参与反应的MgSO4的质量为y,
MgSO4+2NaOH=Na2SO4+Mg(OH)2↓,
120 58
y 5.8g
∴120:
58=y:
5.8g
80:
58=z:
5.8g
解之得:
y=5.8g×120/58=12g;
所以氢氧化钠的质量为24g-12g=12g
答案:
该固体中MgSO4的质量为12g;NaOH的质量为12g。
16、已知钠与水反应的化学方程式为:
2Na+2H2O=2NaOH+H2↑。
质量均为m g的钠、镁、锌三种金属分别与25g质量分数为19.6%的稀硫酸反应。
(1)由于金属的量不确定,产生的氢气的质量大小有多种可能(不考虑镁与水的反应),如镁、锌产生氢气的质量相同且都小于钠产生的氢气质量的情况表示为Na>Mg=Zn.请按以上表示,写出所有可能情况;
(2)试确定,当产生的氢气的质量大小为Na>Mg=Zn时,m的取值范围;
(3)m=4.6时,Zn与酸反应产生H2的质量与金属质量(m)的关系如下图。
请在图中再画出钠和镁二种金属分别与酸反应产生H2的质量与金属质量(m)的关系图线。
(在图线上用元素符号注明)
解析:
(1)共有4种可能:
①酸过量(酸与镁恰好完全反应)时,产生的氢气质量的情况为:
Mg>Na>Zn;
②钠、镁、锌均过量(或锌恰好完全反应)时,过量的钠可以水反应而产生的氢气质量最多,镁、锌产生的氢气质量因受酸的限制而相等:
Na>Mg=Zn;
③钠、镁均过量而锌不足时,产生的氢气质量的情况为:
Na>Mg>Zn;
④镁过量、钠恰好与酸完全反应,而锌不足时:
Na=Mg>Zn。
(2)由上面的分析可知:
当产生的氢气的质量大小为Na>Mg=Zn时,钠、镁、锌均应过量(或锌恰好完全反应),因此m的大小只取决于锌的质量。
设:
25 g质量分数为19.6%的稀硫酸与锌恰好完全反应消耗锌的质量为χ;
Zn+H2SO4═ZnSO4+H2↑
65 98
χ 25 g×19.6%
65:
98=χ:
(25 g×19.6% )
解得:
χ=3.25g 故:
m≥3.25
(3)m=4.6时,m>3.25.因此钠、镁、锌均过量,钠在酸消耗完后还可以与水反应,产生氢气的量由钠决定:
2Na+H2SO4 =Na2SO4 +H2↑ 2Na+2H2O=2NaOH+H2↑,
设:
钠产生的氢气质量为y
2Na~H2
46 2
4.6g y
46:
2=4.6g:
y
解得:
y=0.2g
镁、锌产生的氢气质量因受酸的限制而相等,由上图可知:
均为0.1g.
设:
25 g质量分数为19.6%的稀硫酸与镁恰好完全反应消耗镁的质量为z
Mg+H2SO4═ZnSO4+H2↑
24 98
Z 25 g×19.6%
24:
98=z:
(25 g×19.6% )
解得:
z=1.2 g
钠和镁两种金属分别与酸反应产生H2的质量与金属质量
(m)的关系图如右所示。
17.如图,在一根长100cm,粗细均匀的木棒左端挂有50g砝码,右端挂有内盛40g稀硫酸的小桶(小桶质量为10g),以A点为支点时,木棒平衡。
向小桶内加入一定质量的碳酸钠固体,恰好完全反应后,木棒失衡。
如果将支点移动1.5cm,木棒再次平衡。
(1)移动支点后,支点A距离a点的距离是cm;
(2)加入碳酸钠的质量是多少?
(3)原硫酸溶液中溶质的质量分数时多少?
解析:
(1)将碳酸钠固体加入到右边的小桶里,反应后右端质量增大,要继续平衡,支点应当向右移动1.5cm,所以支点A距离a点的距离是51.5cm;