重庆药品交易所基本药物产品申报操作手册及产品申报常见问题解答.docx
《重庆药品交易所基本药物产品申报操作手册及产品申报常见问题解答.docx》由会员分享,可在线阅读,更多相关《重庆药品交易所基本药物产品申报操作手册及产品申报常见问题解答.docx(13页珍藏版)》请在冰豆网上搜索。
重庆药品交易所基本药物产品申报操作手册及产品申报常见问题解答
重庆药品交易所
基本药物产品申报操作手册
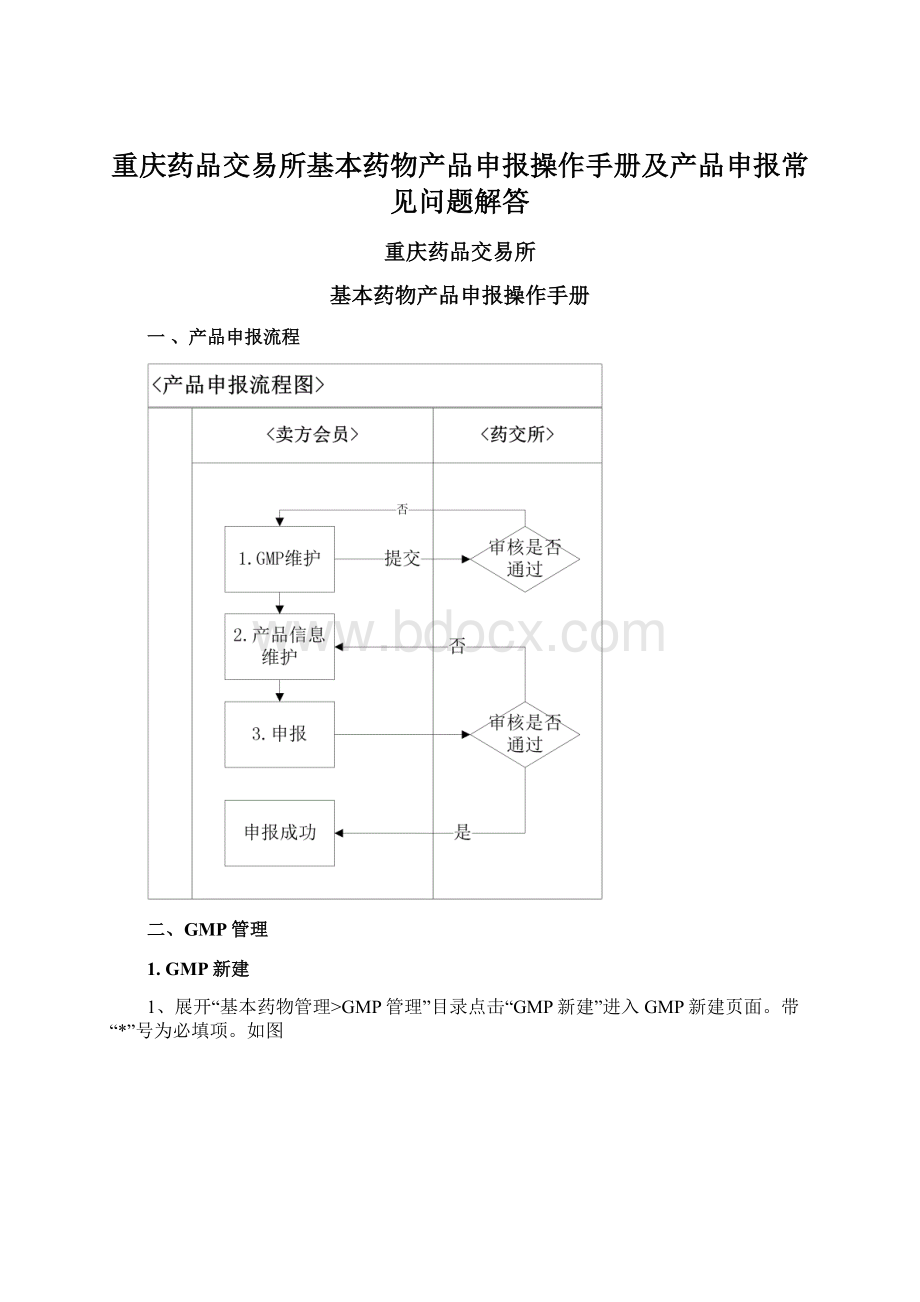
一、产品申报流程
二、GMP管理
1.GMP新建
1、展开“基本药物管理>GMP管理”目录点击“GMP新建”进入GMP新建页面。
带“*”号为必填项。
如图
2、会员名称由系统带出不需要输入。
3、点击“保存”按钮系统保存新增的GMP数据但不会申报,需要在GMP列表中找到相应的数据手工点击“申报”按钮。
4、点击“提交审核”按钮系统保存新增的GMP数据并提交审核。
5、点击“返回列表”是由GMP新建页面跳转到GMP列表页面。
2.GMP列表
1、展开“基本药物管理>GMP管理”目录点击“GMP列表”进入GMP列表页面。
如图
2、展开“基本药物管理>GMP管理”目录点击“GMP新建”进入GMP新建页面。
录入相关信息,点击保存或直接提交审核。
如图
3、根据GMP状态查询相匹配的GMP信息,输入查询条件点击“查询”按钮。
该页面也可直接点击新建GMP证书。
三、产品管理
1.各字段维护说明
序号
字段名
说明
1
药品通用名
在系统中查询查询
2
剂型
由选择的“药品通用名”带出
3
规格
由选择的“药品通用名”带出
4
使用单位
选择对应的使用单位。
例:
头孢克肟片50mg*6片/盒使用单位选“片”
5
商品名
注册批件及说明书中有则填,没有则不填该项
6
转换系数
整数例:
头孢克肟片50mg*6片/盒,转换系数为“6”
7
包装规格
自动显示.例:
50mg*6片
8
包装单位
例:
头孢克肟片50mg*6片/盒包装单位选“盒”
9
药品包材
选择
10
大包装
例:
6片/盒,100盒/箱
11
生产企业
系统自动生成,并可进行修改。
12
药品本位码
必填,50字内,填写由国家药监局编制的该药品本位码。
14位数字,
13
是否委托生产
选“是”时需要维护具体的委托生产企业
14
药品质量类别
选择对应的质量类别
15
药品质量类别附件
根据提示是否上传,上传文件格式及大小(JPG,200K;PDF,2M)
16
注册批件
上传文件格式及大小(JPG,200K;PDF,2M)
17
药品批准文号
填写
18
药品批准文号有效期
选择
19
GMP认证编码
选填,生产企业须选择对应的GMP编码,进口总代理可不选择此项。
20
GMP认证范围
系统自动生成
21
GMP认证日期
系统自动生成
22
GMP认证有效期截止日
系统自动生成
23
企业名称
系统自动生成
会员类型
系统自动生成
33
药品标准
上传国家食品药品监督管理局国家药品标准的扫描件。
上传文件格式及大小(JPG,200K;PDF,2M)
是否国家基药
系统自动生成
是否地方增补基药
系统自动生成
34
是否国家医保
基本药物默认为是,由卖方会员进行选择。
35
国家医保类型
是国家医保的选择:
甲类、乙类、民族药。
36
国家医保编号
是国家医保的需填写国家医保编号。
37
是否地方医保
目前默认为重庆医保
38
地方医保区域
可选择,默认重庆,
40
定价类型
必选
41
物价文件
上传文件格式及大小(JPG,200K;PDF,2M)
42
零售价
数字,卖方会员按物价文件上的价格填写。
43
零售价单位
必选,填写物价文件上的定价单位
44
药品说明书电子版
上传电子版本上传文件格式及大小(doc,2M)
45
药品说明书附件
说明书扫描件。
上传文件格式及大小(JPG,200K;PDF,2M)
46
是否OTC
根据说明书选择“是”,“否”
47
外包装
附件,上传申报药品外包装的彩色照片;可含附带具体使用药品,请将项上传为JPG图片200K将展现给买方会员。
48
是否需要冷藏
必选,默认为否。
49
药品有效期
整数,说明书上效期。
单位为:
个月
50
日均用药量
平均日用量=(最小日用量+最大日用量)/2
52
是否已加入药品电子监管网
系统自动带出
53
备注
2.基药录入
1、展开“基本药物管理>产品管理”目录点击“基药录入”进入基药录入页面。
如图:
2、药品通用名填写,点击“搜索”按钮。
3、点击“搜索”铵钮如下图,可分别录入各种查询条件,用鼠标点击所需数据条;如果没有所报药品对应信息,选择“其它”,进行申报。
4、选择相应包材,若无请选择其它,并在弹出的提示框注明包材。
如图
5、药品质量类别的选择,请选择相应类别。
如图:
6、药品质量类别附件上传。
如图
7、药品批准文号有效期,单点文框弹出日期控件。
如图
8、单击选中具体的日期。
如图:
9、按相关要求填写或选择完整后,点击保存。
基础药物信息正确录入示范
10、“产品录入”完成保存后,点击“申报”即产品申报完成。
3.基药列表
1、展开“基本药物管理>产品管理”目录点击“基药列表”进入基药列表页面。
处于申报状态时,可以点击“撤消申报”后重新编辑、保存、申报等系列操作。
如图
注:
只有申报后药交所才能进行审核。
2、可根据各查询相条件匹配的信息,输入查询条件点击“查询”按钮。
3、产品批量申报,可以选择多条状态为“创建”时做批量申报操作。
如图
4、如果审核未通过,会出现“审核失败”,同时再点击“更正”进行修改。
如图
5、点击“更正”后,在“审核结果”处会有未通过的审核意见,按照意见进行修改。
如图
6、“审核成功”后,即出现下图列表。
该产品资质审核通过。
四、申报过程中的常见问题
1.在申报时查询不到需要申报的药品基础信息,如何处理?
如查询不到基础信息,请在基础信息选择“其它”进行申报,其他项需要按申报药品的要求进行维护,并在备注中说明查找不到的通用名、剂型、规格。
2.产品申报时上传的图片的进度条无显示?
见下图:
点击浏览选择对应的图片,鼠标指向本次上传时会员可以查看将要上传的文件,点击“保存”后才上传。
3.产品申报时为什么上传不了,没有浏览按钮?
请用IE8.0版本。
4.截止2011年12月16日24:
00在交易所非基本药物已申报挂牌且已审核通过的基本药物范围品种,不需要在基本药物产品申报系统中重复维护产品申报信息,相关产品信息2012年1月5日后可直接在基本药物产品申报系统中查询。
哪些状态为审核通过?
哪些状态为未通过?
在非基本药物系统中审核通过不需要重复维护所包含产品状态为:
已上市、已拒绝价格、审核入市价通过、已确认价格、申请下市、价格受限、已制定入市价、复审通过。
在非基本药物系统中审核未通过需要重新维护的具体产品状态为:
已创建、已申报、再次申报、初审通过、初审拒绝、复审拒绝、已下市。
5.已经取得交易所会员资格并已办理了CA的会员,可以同时进行会员资料变更及产品申报;没有取得会员资格的,需先进行会员资格申报,通过审核并办理CA后,方可进行产品申报。
6.交易所非基本药物系统与基本药物交易系统CA通用,当在基本药物交易系统CA不能识别时,请点直接点击提示上面的“点击下载”下载新的驱动,点击安装;安装时,程序会先卸载以前的驱动,请选择“是”,卸载完成,重新启动电脑,再点击安装程序,安装完成即可。
7.原重庆市药品集中采购平台所挂网的2009年招标结果(国家307)的产品,参加重庆药品交易所基本药物交易,需按时间节点要求在重庆药品交易所基本药物系统申报产品。