实验九酵母蔗糖酶最后.docx
《实验九酵母蔗糖酶最后.docx》由会员分享,可在线阅读,更多相关《实验九酵母蔗糖酶最后.docx(25页珍藏版)》请在冰豆网上搜索。
实验九酵母蔗糖酶最后
实验九酵母蔗糖酶的提取及其性质的研究
本实验为学生提供一个较全面的实践机会,学习如何提取纯化、分析鉴定一种酶,并对这种酶的性质,尤其是动力学性质作初步的研究。
自1860年Bertholet从酒酵母SacchacomycesCerevisiae中发现了蔗糖酶以来,它已被广泛地进行了研究。
蔗糖酶(invertase)(—D—呋喃果糖苷果糖水解酶)(fructofuranosidefructohydrolase)(EC.3.2.1.26)特异地催化非还原糖中的—呋喃果糖苷键水解,具有相对专一性。
不仅能催化蔗糖水解生成葡萄糖和果糖,也能催化棉子糖水解,生成密二糖和果糖。
本实验提取啤酒酵母中的蔗糖酶。
该酶以两种形式存在于酵母细胞膜的外侧和内侧,在细胞膜外细胞壁中的称之为外蔗糖酶(externalyeastinvertase),其活力占蔗糖酶活力的大部分,是含有50%糖成分的糖蛋白。
在细胞膜内侧细胞质中的称之为内蔗糖酶(internalyeastinvertase),含有少量的糖。
两种酶的蛋白质部分均为双亚基,二聚体,两种形式的酶的氨基酸组成不同,外酶每个亚基比内酶多两个氨基酸,Ser和Met,它们的分子量也不同,外酶约为27万(或22万,与酵母的来源有关),内酶约为13.5万。
尽管这两种酶在组成上有较大的差别,但其底物专一性和动力学性质仍十分相似,因此,本实验未区分内酶与外酶,而且由于内酶含量很少,极难提取,本实验提取纯化的主要是外酶。
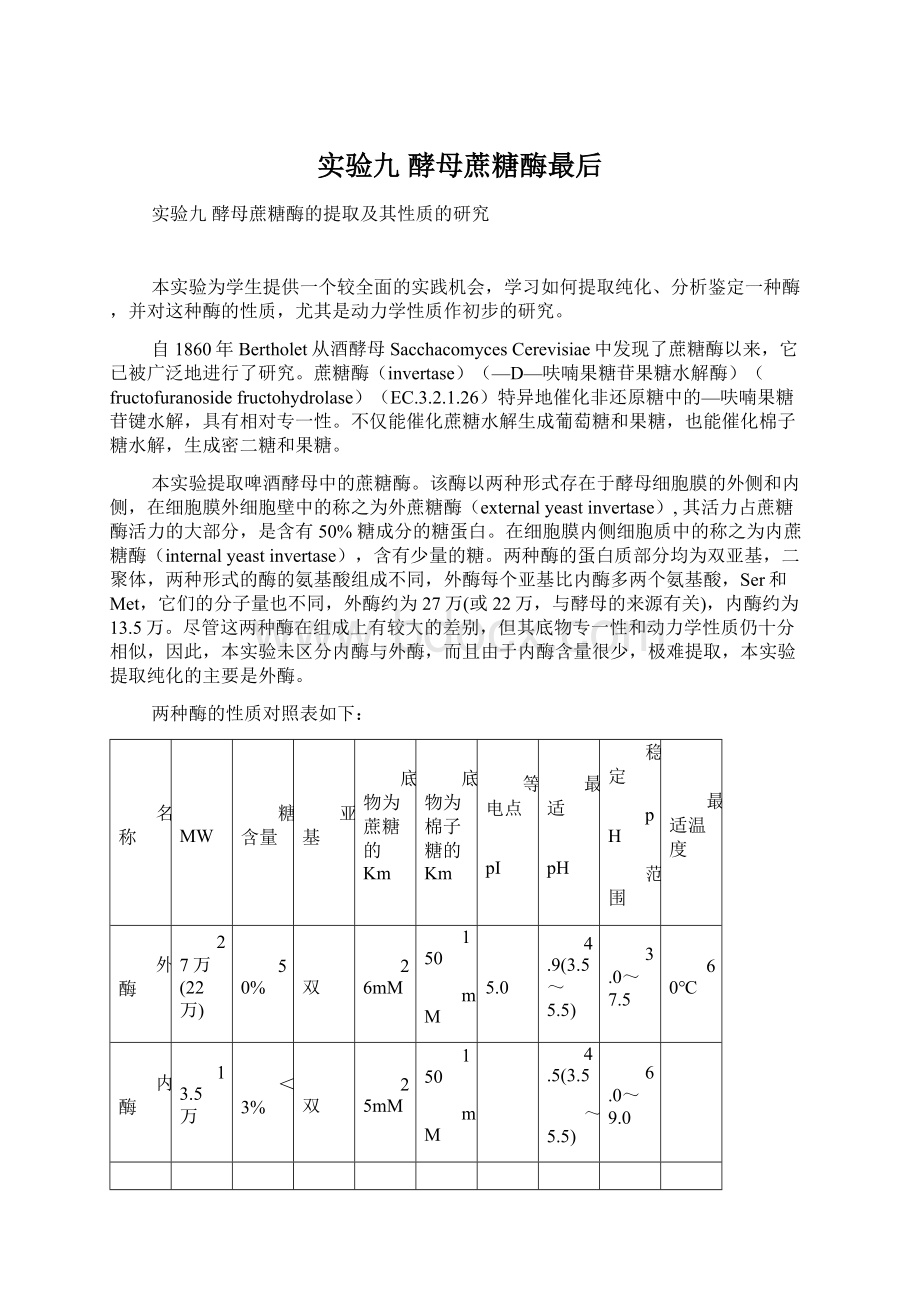
两种酶的性质对照表如下:
名称
MW
糖含量
亚基
底物为蔗糖的Km
底物为棉子糖的Km
等电点
pI
最适
pH
稳定
pH
范围
最适温度
外酶
27万(22万)
50%
双
26mM
150
mM
5.0
4.9(3.5~5.5)
3.0~7.5
60℃
内酶
13.5万
<3%
双
25mM
150
mM
4.5(3.5
~5.5)
6.0~9.0
实验中,用测定生成还原糖(葡萄糖和果糖)的量来测定蔗糖水解的速度,在给定的实验条件下,每分钟水解底物的量定为蔗糖酶的活力单位。
比活力为每毫克蛋白质的活力单位数。
本实验共有九个分实验:
一、蔗糖酶的提取与部分纯化
二、离子交换柱层析纯化蔗糖酶
三、蔗糖酶各级分活性及蛋白质含量的测定
四、反应时间对产物形成的影响
五、pH对酶活性的影响和最适pH的测定
六、温度对酶活性的影响和反应活化能的测定
七、底物浓度对催化反应速度的影响及米氏常数Km和最大反应速度Vmax的测定
八、尿素(脲)抑制蔗糖酶的实验
九、棉子糖和果糖抑制蔗糖酶的实验
(一)蔗糖酶的提取与部分纯化
一、实验目的:
学习酶的纯化方法,并为动力学实验提供一定量的蔗糖酶。
二、试剂:
1.啤酒酵母
2.二氧化硅
3.甲苯(使用前预冷到0℃以下)
4.去离子水(使用前冷至4℃左右)
5.冰块、食盐
6.1N乙酸
7.95%乙醇
三、仪器:
1.研钵1个
2.离心管3个
3.滴管3个
4.量筒50ml1个
5.水浴锅1个
6.恒温水浴
7.烧杯100ml2个
8.广泛pH试纸
9.高速冷冻离心机
四、操作步骤:
1.提取
(1)准备一个冰浴,将研钵稳妥放入冰浴中。
(2)称取5g干啤酒酵母和20g湿啤酒酵母,称20mg蜗牛酶及适量(约10g)二氧化硅,放入研钵中。
二氧化硅要予先研细。
(3)量取预冷的甲苯30ml缓慢加入酵母中,边加边研磨成糊状,约需60分钟。
研磨时用显微镜检查研磨的效果,至酵母细胞大部分研碎。
(4)缓慢加入预冷的40ml去离子水,每次加2ml左右,边加边研磨,至少用30分钟。
以便将蔗糖酶充分转入水相。
(5)将混合物转入两个离心管中,平衡后,用高速冷离心机离心,4℃,10000rpm,10min。
如果中间白色的脂肪层厚,说明研磨效果良好。
用滴管吸出上层有机相。
(6)用滴管小心地取出脂肪层下面的水相,转入另一个清洁的离心管中,4℃,10000rpm,离心10min。
(7)将清液转入量筒,量出体积,留出1.5ml测定酶活力及蛋白含量。
剩余部分转入清洁离心管中。
(8)用广泛pH试纸检查清液pH,用1N乙酸将pH调至5.0,称为“粗级分I”。
2.热处理
(1)予先将恒温水浴调到50℃,将盛有粗级分I的离心管稳妥地放入水浴中,50℃下保温30分钟,在保温过程中不断轻摇离心管。
(2)取出离心管,于冰浴中迅速冷却,用4℃,10000rpm,离心10min。
(3)将上清液转入量筒,量出体积,留出1.5ml测定酶活力及蛋白质含量(称为“热级分II”)。
3.乙醇沉淀
将热级分II转入小烧杯中,放入冰盐浴(没有水的碎冰撒入少量食盐),逐滴加入等体积预冷至-20℃的95%乙醇,同时轻轻搅拌,共需30分钟,再在冰盐浴中放置10分钟,以沉淀完全。
于4℃,10000rpm,离心10min,倾去上清,并滴干,沉淀保存于离心管中,盖上盖子或薄膜封口,然后将其放入冰箱中冷冻保存(称为“醇级分Ⅲ”)。
废弃上清液之前,要用尿糖试纸检查其酶活性(于下一个实验一起做)。
(二)离子交换柱层析纯化蔗糖酶
一、试剂
1.DEAE纤维素:
DE-231.5克
2.0.5NNaOH100ml
3.0.5NHCL50ml
4.0.02mol/LpH7.3Tris-HCl缓冲液250ml
5.0.02mol/LpH7.3(含0.2mol/L浓度NaCl)的Tris-HCl缓冲液50ml
二、仪器
1.层析柱
2.部分收集器
3.磁力搅拌器及搅拌子
4.50ml小烧杯2个
5.玻璃砂漏斗
6.真空泵与抽滤瓶
7.精密pH试纸或pH计
8.三通管
9.止水夹
10.吸耳球
11.塑料紫外比色杯
12.电导率仪
13.尿糖试纸
14.点滴板
三、操作步骤
1.离子交换剂的处理:
称取1.5克DEAE纤维素(DE-23)干粉,加入0.5mol/LNaOH溶液(约50ml),轻轻搅拌,浸泡至少0.5小时(不超过1小时),用玻璃砂漏斗抽滤,并用去离子水洗至近中性,抽干后,放入小烧杯中,加50ml0.5mol/LHCl,搅匀,浸泡0.5小时,同上,用去离子水洗至近中性,再用0.5mol/LNaOH重复处理一次,用去离子水洗至近中性后,抽干备用。
(因DEAE纤维素昂贵,用后务必回收)。
实际操作时,通常纤维素是已浸泡过回收的,按“碱→酸”的顺序洗即可,因为酸洗后较容易用水洗至中性。
碱洗时因过滤困难,可以先浮选除去细颗粒,抽干后用0.5mol/LNaOH-0.5mol/LNaCl溶液处理,然后水洗至中性。
2.装柱与平衡:
先将层析柱垂直装好,在烧杯内用0.02mol/LpH7.3Tris-HCl缓冲液洗纤维素几次,用滴管吸取烧杯底部大颗粒的纤维素装柱,然后用此缓冲液洗柱至流出液的电导率与缓冲液相同或接近时即可上样。
3.上样与洗脱:
上样前先准备好梯度洗脱液,本实验采用20ml0.02MpH7.3的Tris-HCl缓冲液和20ml含0.2M浓度NaCl的0.02mol/LpH7.3的Tris-HCl缓冲液,进行线性梯度洗脱。
取两个相同直径的50ml小烧杯,一个装20ml含NaCl的高离子强度溶液,另一个装入20ml低离子强度溶液,放在磁力搅拌器上,在低离子强度溶液的烧杯内放入一个小搅拌子(在细塑料管内放入一小段铁丝,两端用酒精灯加热封口),将此烧杯置于搅拌器旋转磁铁的上方。
将玻璃三通插入两个烧杯中,上端接一段乳胶管,夹上止水夹,用吸耳球小心地将溶液吸入三通(轻轻松一下止水夹),立即夹紧乳胶管,使两烧杯溶液形成连通,注意两个烧杯要放妥善,切勿使一杯高、一杯低。
用5ml0.02mol/LpH7.3的Tris-HCl缓冲液充分溶解醇级分Ⅲ,(注意玻璃搅棒头必须烧园、搅拌溶解时不可将离心管划伤),若溶液混浊,则用小试管,4000rpm离心除去不溶物。
取1.5ml上清液(即醇级分Ⅲ样品,留待下一个实验测酶活力及蛋白含量),将剩余的3.5ml清液小心地加到层析柱上,不要扰动柱床,注意要从上样开始使用部分收集器收集,每管2.5~3.0ml/10min。
上样后用缓冲液洗两次,然后再用约20ml缓冲液洗去柱中未吸附的蛋白质,至A280降到0.1以下,夹住层析柱出口,将恒流泵入口的细塑料导管放入不含NaCl的低离子强度溶液的小烧杯中,用胶布固定塑料管,接好层析柱,打开磁力搅拌器,放开层析柱出口,开始梯度洗脱,连续收集洗脱液,两个小烧杯中的洗脱液用尽后,为洗脱充分,也可将所配制的剩余30ml高离子强度洗脱液倒入小烧杯继续洗脱,控制流速2.5~3.0ml/10min。
测定每管洗脱液的A280光吸收值和电导率。
(使用DJS-10电导电极)
测定不含NaCl的0.02mol/LpH7.3Tris-HCl缓冲液和含0.2mol/L浓度NaCl的0.02mol/LpH7.3Tris-HCl缓冲液的电导率,用电导率与NaCl浓度作图,利用此图将每管所测电导率换算成NaCl浓度,并利用此曲线估计出蔗糖酶活性峰洗出时的NaCl浓度。
4.各管洗脱液酶活力的定性测定
在点滴板上每一孔内,加一滴0.2mol/LpH4.9的乙酸缓冲液,一滴0.5mol/L蔗糖和一滴洗脱液,反应5分钟,在每一孔内同时插入一小条尿糖试纸,10~20min后观察试纸颜色的变化。
用“+”号的数目,表示颜色的深浅,即各管酶活力的大小。
合并活性最高的2~3管,量出总体积,并将其分成10份,分别倒入10个小试管,用保鲜膜封口,冰冻保存,使用时取出一管。
此即“柱级分IV”。
注意:
从上样开始收集,可能有两个活性峰,梯度洗脱开始前的第一个峰是未吸附物,本实验取用梯度洗脱开始后洗下来的活性峰。
在同一张图上画出所有管的酶活力,NaCl浓度(可用电导率代替)和光吸收值A280的曲线和洗脱梯度线。
(三)蔗糖酶各级分活性及蛋白质含量的测定
一、实验目的
掌握蔗糖酶活性测定方法,了解各级分酶的纯化情况。
二、原理
为了评价酶的纯化步骤和方法,必须测定各级分酶活性和比活。
测定蔗糖酶活性的方法有许多种,如费林试剂法、Nelson’s试剂法、水杨酸试剂法等,本实验先使用费林试剂法,以后测米氏常数Km和最大反应速度Vmax时再用Nelson’s试剂法。
费林试剂法灵敏度较高,但数据波动较大,因为反应后溶液的颜色随时间会有变化,因此加样和测定光吸收值时最好能计时。
其原理是在酸性条件下,蔗糖酶催化蔗糖水解,生成一分子葡萄糖和一分子果糖。
这些具有还原性的糖与碱性铜试剂混合加热后被氧化,二价铜被还原成棕红色氧化亚铜沉淀,氧化亚铜与磷钼酸作用,生成兰色溶液,其兰色深度与还原糖的量成正比,于650nm测定光吸收值。
三、试剂
1.碱性铜试剂(用毕回收)
称10g无水NaCO3,加入100ml去离子水溶解,另称1.88g酒石酸,用100ml去离子水溶解,混合二溶液,再加入1.13克结晶CuSO4,溶解后定容到250ml。
2.磷钼酸试剂(用毕回收)
在烧杯内加入钼酸17.5g,钨酸钠2.5g,10%NaOH100ml,去离子水100ml,混合后煮沸约30min(小心不要蒸干),驱去钼酸中存在的氨,直到无氨味为止,冷却后加85%磷酸63ml,混合并稀释到250ml。
3.0.25%苯甲酸200ml,配葡萄糖用,防止时间长溶液长菌,也可以用去离子水代替。
4.葡萄糖标准溶液:
(1)贮液:
精确称取无水葡萄糖(应在105℃恒重过)0.1802克,以0.25%苯甲酸溶液溶解后,定容到100ml容量瓶中(浓度10mmol/L)。
(2)操作溶液:
用移液管取贮液10ml,置于50ml容量瓶中,以用0.25%苯甲酸或去离子水稀释至刻度(浓度为2mmol/L)。
5.0.2mol/L蔗糖溶液50ml,分装于小试管中冰冻保存,因蔗糖极易水解,用时取出一管化冻后摇匀。
6.0.2mol/L乙酸缓冲液,pH4.9,200ml。
7.牛血清清蛋白标准蛋白质溶液(浓度范围:
200~500g/ml,精确配制50ml)。
8.考马斯亮兰G-250染料试剂,100mg考马斯亮兰G-250全溶于50ml95%乙醇后,加入120ml85%磷酸,用去离子水稀释到1L(公用)。
四、仪器
1.试管20支,试管架1个
2.秒表1块,或用手表。
3.移液管:
0.1、0.2、2.0、5.0ml
4.塑料可见比色杯(杯上和器皿染色后可用少量95%的乙醇荡洗)
5.水浴锅
6.电炉
7.保鲜膜
8.橡皮筋
五、各级分蛋白质含量的测定
采用考马斯亮兰染料法(Bradford法)的微量法测定蛋白质含量,参见实验-“蛋白质含量的测定法”(因Tris会干扰Lowry法的测定)。
标准蛋白的取样量为0.1、0.2、0.3、0.4、0.5、0.6、0.8、1.0ml,用去离子水补足到1.0ml。
各级分先要仔细寻找和试测出合适的稀释倍数,并详细记录稀释倍数的计算(使用移液管和量筒稀释)。
下列稀释倍数仅供参考:
粗级分I:
10~50倍
热级分II:
10~50倍
醇级分III:
10~50倍
柱级分IV:
不稀释
确定了稀释倍数后,每个级分取3个不同体积的样进行测定,然后取平均值,计算出各级分蛋白质浓度。
六、级分I、II、III蔗糖酶活性测定
用0.02mol/LpH4.9乙酸缓冲液(也可以用pH5~6的去离子水代替)稀释各级分酶液,试测出测酶活合适的稀释倍数:
I:
1000~10000倍
II:
1000~10000倍
III:
1000~10000倍
以上稀释倍数仅供参考。
按“表1”的顺序在试管中加入各试剂,进行测定,为简化操作可取消保鲜膜封口,沸水浴加热改为用90~95℃水浴加热8~10min。
七、柱级分IV酶活力的测定
1.酶活力的测定参照“表1”设计一个表格,反应混合物仍为1ml。
2.第1管仍为蔗糖对照,9、10管为葡萄糖的空白与标准,与“表1”中的11、12管相同。
3.2~7管加入柱级分IV(取样前先试测出合适的稀释倍数),分别为0.02ml、0.05ml、0.1ml、0.2ml、0.4ml和0.6ml,然后各加0.2ml乙酸缓冲液(0.2mol/LpH4.9),每管用去离子水补充到0.8ml。
4.1~7管各加入0.2ml0.2mol/L的蔗糖,每管由加入蔗糖开始计时,室温下准确反应10min,立即加入1ml碱性铜试剂中止反应,然后按“表1”中的步骤进行测定。
5.第8管为0时间对照,与第7管相同,只是在加入0.2ml蔗糖之前,先加入碱性铜试剂,防止酶解作用。
此管只用于观察,不进行计算。
6.计算柱级分IV的酶活力:
Units/ml原始溶液。
7.以每分钟生成的还原糖的moles数为纵座标,以试管中1ml反应混合物中的酶浓度(mg蛋白/ml)为横座标,画出反应速度与酶浓度的关系曲线。
表1级分Ⅰ、Ⅱ、Ⅲ的酶活力测定
各管名称→
对照
粗级分Ⅰ
热级分Ⅱ
醇级分Ⅲ
葡萄糖
管数→
1
234
567
8910
1112
酶液(ml)
0.00.050.200.500.050.200.500.050.200.50//
H2O(ml)
0.60.550.400.100.050.200.100.550.400.101.00.8
乙酸缓冲液
(0.2mol/LpH4.9)
0.20.20.20.20.20.20.20.20.20.2//
葡萄糖2mmol/L
///////////0.2
蔗糖0.2mol/L
0.20.20.20.20.20.20.20.20.20.2//
加入蔗糖,立即摇匀开始计时,室温准确反应10min后,立即加碱性铜试剂中止反应。
碱性铜试剂
1.01.01.01.01.01.01.01.01.01.01.01.0
用保鲜膜封口,扎眼,沸水浴加热8min,立即用自来水冷却。
磷钼酸试剂
1.01.01.01.01.01.01.01.01.01.01.01.0
H2O
5.05.05.05.05.05.05.05.05.05.05.05.0
A650nm
E’=μmol/min·ml
平均E’
μmol/min·ml
Units/ml原始组分
稀释后酶液的活力(按还原糖计算):
式中:
A650──第2~10管所测A650
A’650──第12管所测A650
0.2──第12管葡萄糖取样量
2──标准葡萄糖浓度2mmol/L=2μmol/ml
10──反应10min
B──每管加入酶液ml数
原始酶液的酶活力E=(平均E’/2)×稀释倍数(Units/ml原始组分)
八、计算各级分的比活力,纯化倍数及回收率,并将数据列于下表:
为了测定和计算下面纯化表中的各项数据,对各个级分都必须取样,每取一次样,对于下一级分来说会损失一部分量,因而要对下一个级分的体积进行校正,以使回收率的计算不致受到不利的影响。
酶的纯化表如下:
级分
记录体积
(ml)
校正体积
(ml)
蛋白质
(mg/ml)
总蛋白(mg)
Units/ml
总
Units
比活
Units/mg
纯化倍数
回收率%
Ⅰ
1.0
100
Ⅱ
Ⅲ
Ⅳ
[注]:
一个酶活力单位Units,是在给定的实验条件下,每分钟能催化1mole蔗糖水解所需的酶量,而水解1mole蔗糖则生成2moles还原糖,计算时请注意。
下面是对假定的各级分记录体积进行校正计算的方法和结果:
级分
记录体积
ml
核正体积计算
取样体积
ml
校正后体积
ml
Ⅰ
15
15
1.5
15.00
Ⅱ
13.5
13.5×(15/13.5)
1.5
15.00
Ⅲ
5
5×(15/13.5)×(13.5/12)
1.5
6.25
Ⅳ
6
6×(15/13.5)×(13.5/12)×(5/3.5)
──
10.71
(四)反应时间对产物形成的影响
酶的动力学性质分析,是酶学研究的重要方面。
下面将通过一系列实验,研究pH、温度和不同的抑制剂对蔗糖酶活性的影响,测定蔗糖酶的最适pH、最适温度、蔗糖酶催化反应的活化能,测定米氏常数Km、最大反应速度Vmax和各种抑制剂常数KI,由此掌握酶动力学性质分析的一般实验方法。
本实验是以蔗糖为底物,测定蔗糖酶与底物反应的时间进程曲线,即在酶反应的最适条件下,每间隔一定的时间测定产物的生成量,然后以酶反应时间为横座标,产物生成量为纵座标,画出酶反应的时间进程曲线,由该曲线可以看出,曲线的起始部分在某一段时间范围内呈直线,其斜率代表酶反应的初速度。
随着反应时间的延长,曲线斜率不断减小,说明反应速度逐渐降低,这可能是因为底物浓度降低和产物浓度增高而使逆反应加强等原因所致,因此测定准确的酶活力,必须在进程曲线的初速度时间范围内进行,测定这一曲线和初速度的时间范围,是酶动力学性质分析中的组成部分和实验基础。
实验方法见“表2”:
1.准备12支试管,按“表2”进行测定。
用反应时间为0的第一管作空白对照,此试管要先加碱性铜试剂后加酶。
第10支试管是校正蔗糖的酸水解。
用第11管作为对照,测定第12管葡萄糖标准的光吸收值,用以计算第2~9各测定管所生成还原糖的“moles”数。
2.“表2”中底物蔗糖的量为每管0.25moles,全部反应后可产生0.5moles的还原糖,所有的蔗糖和酶浓度应使底物在20min内基本反应完。
3.画出生成的还原糖的moles数(即产物浓度moles/ml)与反应时间的关系曲线,即反应的时间进程曲线,求出反应的初速度。
表2反应时间对产物浓度的影响
管数→
123456789101112
2.5mmol/L蔗糖
0.10.10.10.10.10.10.10.10.10.1//
乙酸缓冲液
0.20.20.20.20.20.20.20.20.20.2//
H2O
0.40.40.40.40.40.40.40.40.40.71.00.8
葡萄糖2mmol/L
///////////0.2
碱性铜试剂
1.0///////////
由加酶开始计时
蔗糖酶(~1:
5)
0.30.30.30.30.30.30.30.30.3///
反应时间min
0134812203040
反应到时后立即向“2~12”管加入1ml碱性铜试剂中止反应
碱性铜试剂
/1.01.01.01.01.01.01.01.01.01.01.0
盖薄膜,扎孔,沸水浴上煮8min后速冷
磷钼酸试剂
1.01.01.01.01.01.01.01.01.01.01.01.0
H2O
5.05.05.05.05.05.05.05.05.05.05.05.0
测定A650
生成还原糖的
moles数
(五)pH对蔗糖酶活动性的影响
酶的生物学特性之一是它对酸碱度的敏感性,这表现在酶的活性和稳定性易受环境pH的影响。
pH对酶的活性的影响极为显著,通常各种酶只在一定的pH范围内才表现出活性,同一种酶在不同的pH值下所表现的活性不同,其表现活性最高时的pH值称为酶的最适pH。
各种酶在特定条件下都有它各自的最适pH。
在进行酶学研究时一般都要制作一条pH与酶活性的关系曲线,即保持其它条件恒定,在不同pH条件下测定酶促反应速度,以pH值为横座标,反应速度为纵座标作图。
由此曲线,不仅可以了解反应速度随pH值变化的情况,而且可以求得酶的最适PH。
酶溶液pH值之所以会影响酶的活性,很可能是因为它改变了酶活性部位有关基团的解离状态,而酶只有处于一种特殊的解离形式时才具有活性,例如:
H+H+
EH2++EHE-
pKa1(有活性)pKa2
酶的活