清华0300540324张磊楠.docx
《清华0300540324张磊楠.docx》由会员分享,可在线阅读,更多相关《清华0300540324张磊楠.docx(12页珍藏版)》请在冰豆网上搜索。
清华0300540324张磊楠
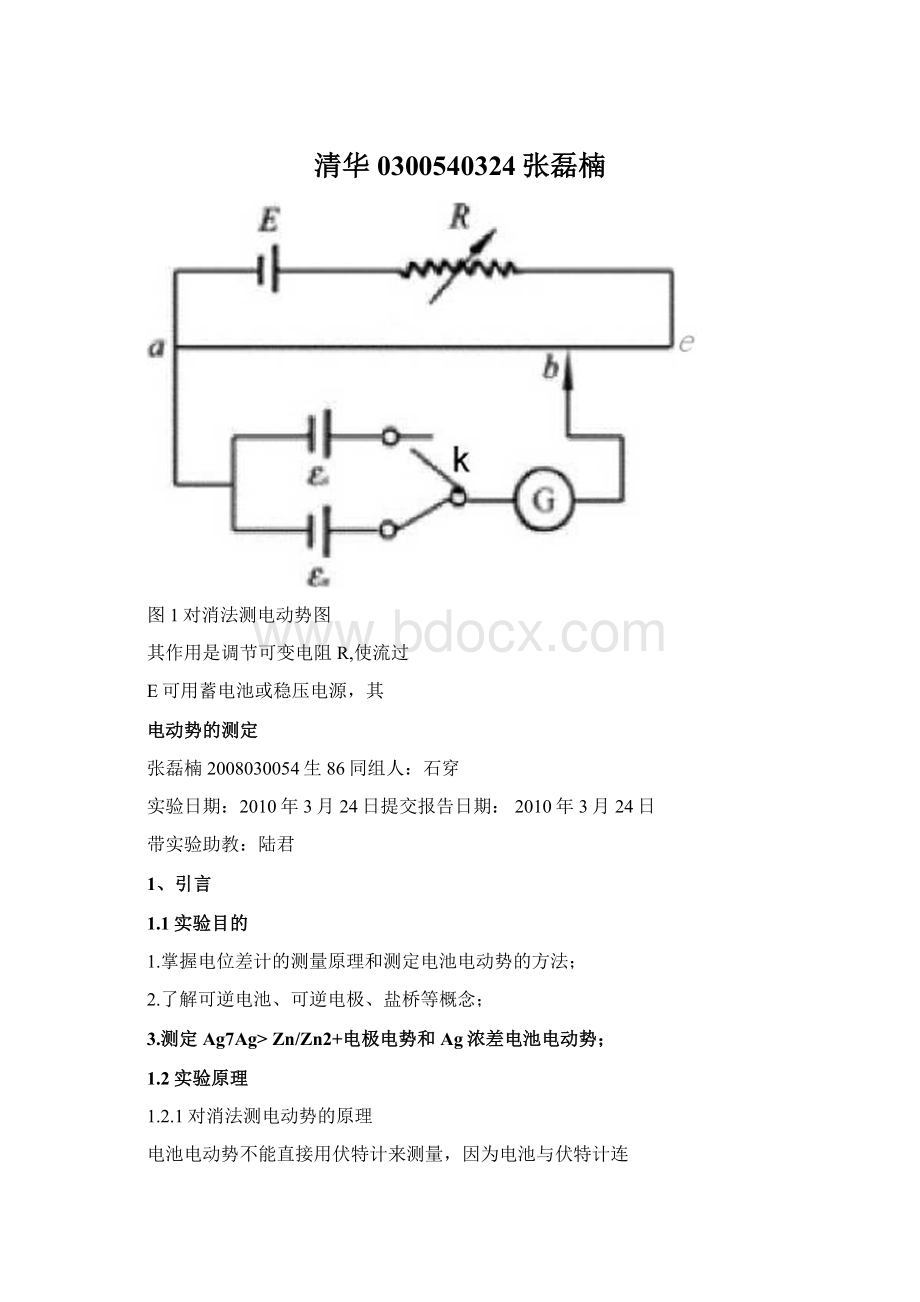
图1对消法测电动势图
其作用是调节可变电阻R,使流过
E可用蓄电池或稳压电源,其
电动势的测定
张磊楠2008030054生86同组人:
石穿
实验日期:
2010年3月24日提交报告日期:
2010年3月24日
带实验助教:
陆君
1、引言
1.1实验目的
1.掌握电位差计的测量原理和测定电池电动势的方法;
2.了解可逆电池、可逆电极、盐桥等概念;
3.测定Ag7Ag>Zn/Zn2+电极电势和Ag浓差电池电动势;
1.2实验原理
1.2.1对消法测电动势的原理
电池电动势不能直接用伏特计来测量,因为电池与伏特计连
接后有电流通过,就会在电极上发生电极极化,结果使电极偏离
平衡状态。
另外,电池本身有内阻,所以伏特计所量得的仅是不
可逆电池的端电压。
测量电池电动势只能在无电流通过电池的情
况下进行,因此需用对消法(又叫补偿法)来测定电动势。
对消法的原理是在待测电池上并联一个大小相等、方向相反
的外加电势差,这样待测电池中没有电流通过,外加电势差的大
小即等于待测电池的电动势。
对消法测电动势常用的仪器为电位
差计,其简单原理如图1所示。
电位差计由三个回路组成:
工作
电流回路、标准回路和测量凹路。
工作电流回路
ac为均匀滑线电阻,通过可变电阻R与工作电源E构成回路,
回路的电流成为某一定值。
这样ac上有一定的电位降低产生,工作电源
输出电压必须大于待测电池的电动势。
标准回路
S为电动势精确己知的标准电池,b是可在ac上移动的接触点,k是双向开关,kb间有一灵敏度
很髙的检流计G当k扳向S一方时,abiGS回路的作用是校准工作回路以标定ac上的电位降。
如标准
电池S的电动势为1.01865伏,则先将b点移动到ac上标记1.01865伏的h处,迅速调节R直至G中
无电流通过。
这时S的电动势与abi之间的电位降大小相等、方向相反而对消。
测量回路
当双向开关K换向X的一方时,用ab2GX回路根据校正好的ac±的电位降来测量未知电池的电动
势。
在保证校准工作电流不变的情况下,在ac±迅速移动到b2点,使G中无电流通过,这时X的电动
势与ab2间的电位的电位降大小相等,方向相反而对消,于是b2点所标记的电位降为X的电动势。
由
于使用过程中电流的电压会有所变化,要求每次测量前均重新校准工作回路的电流。
1.2.2电极电势的测定原理
电池是由2个半电池组成的。
电池电动势是两电极的代数和。
当电势都以还原电势表示时,
ZnZn
以丹尼尔电池为例:
负极反应:
2+2+
(ai)||Cu(a2)Cu
ZniZn2*+2e
RT
护二护日(Zn2+/Zn)-一In
-2Fa(Zn2+)
一笄.金
(即氢气为
15ml
KN0
甞
电极电势的绝对值至今还无法测定,而是以某一电极的电极电势作为零,然后将其
在电化学中,
它的电极与它组成电池,规定该电池的电动势为该被测电极的电极电势。
通常将标准氢电极
101325Pa下的理想气体、溶液中a(H*)为1)的电极电势规定为零。
由于氢电极制备及使用不方便等缺
点,一般常用另外一些制备工艺简单、易于复制、电势稳定的电极作为参比电极来代替氢电极。
常用
的有甘汞电极和氯化银电极等,这些电极与标准氢电极比较而得到的电势己精确测定。
本实验要求制
备锌电极、银电极,然后用饱和甘汞电极作参比电极,测量这两个电极的电极电势、测量银浓差电池
的电动势。
2、实验操作
2.1仪器与试剂
2.1.1实验仪器
数字UJ33D电位差计;半电池管3个;标准饱和甘汞电极1只、锌电极1只,银电极2只;小烧杯5个;单插口半电池管架3个,导线若干;
2.1・2实验试剂
0.1000mol/LZnSO4、0.1000mol/LAgCI,0.1000mol/LKC1、饱和KC1溶液(盐桥)、饱和溶液(盐桥)、饱和硝酸亚汞溶液。
2.2操作步骤
2.2.1电极的制备
⑴锌电极
用抛光砂纸将锌电极表面打磨光滑,然后用自来水冲洗,用滤纸擦干,再浸入饱和硝酸亚汞溶液
(注意:
汞盐
中3-5S,取出后用滤纸擦拭锌电极,使锌电极表面有一层均匀的汞齐,再用蒸饰水洗净
有毒,用过的滤纸应投入指定的容器中,容器中应有水淹没滤纸,切勿随便乱丢⑵银电极
把两根银电极用抛光砂纸轻轻擦亮,再用蒸懈水洗净擦干。
把处理好的两根0.005V方可在浓差电池中使用,
液中,测量其间的电动势值。
两根电极间的电位差小于否则,需重
Ag电极浸入AgNO溶
新处理电极或重新挑选电极。
2.2.2Zn|ZnSO4(0.1000mol/L)半电池的制作及相关电动势测定
(1)半电池的制作:
将电极插入半电池管中,塞紧橡胶塞;用洗耳球从支管处将池管少许,洗0.1000mol/LZnSOi溶液慢慢吸入半电涤两次后,吸入适量溶液,立即把支管处橡皮管夹紧。
然后取出半电池,检查确认管内无气泡且溶液不从管内流出。
(2)ZnZnS0i(0.1000mol/L)|饱和甘汞电极电池电动势的测定:
在一个15ml小烧杯中加入适量饱和KC1溶液(盐桥),把半电池管的玻璃管口以及饱和甘汞电极
插入KC1溶液中,用导线将这两个电极分别与电位差计的负极和正极相连。
如图2,然后读电位差值。
thi
(1)半电池的制作:
插入KN0溶液中,用导线将这两个电极分别与电位差计的正极和负极相连,然后读电位差值。
2.2.4Ag|Ag+(b)KCI(0.1000半电池的制作及相关电动势测定
mol/L)
在15ml小烧杯中加入0.1000mol/LKC1溶液,再加入一滴0.1000mol/LAgNO溶液,搅拌均匀,
使其呈白色混浊溶液。
将此溶液吸入插有银电极的半电池管内,将支管处夹紧,检查有无漏气或气泡。
⑵银浓差电池AgAg+(b)KC1(0.1000mol/L)|AgNO3(0.1000mol/L)|Ag电动势测定:
在一个15ml小烧杯中加入适量饱和KN0溶液(盐桥),把两个半电池管的玻璃管口插入KNO溶
液中,用导线将这两个电极分别与电位差计的正极和负极相连,然后读电位差值
225根据不同温度的电池的电动势值,计算不同温度下的各热力学函数。
2.2.6实验操作注意事项:
(1)半电池管和小烧杯必须清洗干净,实验前先检查半电池管是否漏气;
⑵制作半电池以及将半电池插入盐桥时,注意不要进入气泡;
(3)AgNO废液必须倒入回收瓶中;
⑷汞盐有毒,用过的滤纸应投入指定的容器中,容器中应有水淹没滤纸,切勿随便乱丢。
3、结果与讨论
3.
1实验原始数据
饱和甘汞电极|AgN03(0.1000mol/kg_1)|Ag
+-1
ArIAr(b)KCl(0.1000mol/kR)IArNO3(0.1000mol/kR)IAr444-1
表2.不同温度下Zn|ZnS04(0.1000mol/kg-l)|饱和甘汞电极电势
温度/C
20
25
30
35
40
45
50
电动势/mV
1059.0
1056.9
1054.0
1051.2
1048.4
1045.8
1042.7
3.2实验数据处理
⑴计算室温下饱和甘汞电极的电极电势
饱和甘汞电极的电极电势用温度校正可以表示为:
0/V=0.2412-6.61T10'*(t/C~25)•/t=18.0C二(273.15+18.0)二291.15k
e.4
二0291.15k=0.2412-6.61X10_(18-25)=0.2458V
(2)Zn/Zn、AgVAg的电极电势
Zn+/Zn的电极电势的实验值为:
0szj/zn二0°29i.iok-E实zn=0.2458-1.0609二-0.8151V
同样,Ag+/Ag的电极电势的实验值经计算为:
s+e
0Ag/Ag二0291.i5k+E实Ag二0.2458+0.4901=0.7359V
⑶从附表中查出25C下锌电极和银电极的标准电极电势及其温度系数以及活度系数,
由此计算室温下锌、银的电极电势,并与2的实验值进行比较,求出相对误差。
查教材附表,得25C下锌电极和银电极的标准电极电势及其温度系数以及活度系数结果如表
表3.25C下锌电极和银电极的标准电极电势及其温度系数以及活度系数
标准电极电势/V
温度系数(V/K)
活度系数(mol/kg)
锌电极
—0.7628
9.1X10_3
0.150
银电极
0.7991
-1.0X10_3
0.734
锌离子活度azn2+=Y士*b=0.150*0.1=0.015mol/kg
银离子活度aAg'二Y±*b二0.72*0.1=0.072mol/kg
根据能斯特方程,室温(18C)下
2+e2+e
0Zn/Zn=0—RT/zFXln(l/a%)+△TX(d0/dT)zn
-5.1
二-0.7628+(18-25)X9.1X10-8.314X291.15XInO.015/(2X96485.31)二一0.8161V
+e+e
0Ag/Ag=0—RT/zFXln(l/aAg)+ATX(d0/dT)Ag
-3-1
二0.7991+(18-25)X(T.OX10)-8.314X291.15XInO.072/96485.31
二0.7401V
(4)AgCI溶度积的计算:
实验中所测得的银浓差电池电动势値为
a(Ag0.lOOOmol
04441V,而由a=丫2有:
b
-i
-kg)二0.72X
臣屯a(Ag''°-1OOOm01川式坯」代入上述各值有:
F
a(Ag-,b)
0.4441=8.314X291.15X[ln(0.072/a(Ag;b))]/96485.31,
解之得:
a.(Ag;b)r1.67X10-9;
由式Ksp二a(Ag,b)”尘(Cl一),在稀薄水溶液中用c代替b,
则AgCl的溶度积为:
Ksp二1.67X10_9X0.768X0.1000=1.28X1O'10
而298.15K时AgCl溶度积的理论值为1.56X1O-10,则实验值与理论值的偏差为:
E=(1.28-1.561/1.56)X100%=17.95%
相对误差很大。
但如果我们反过来通过AgCl溶度积的理论值,算出本实验条件下银浓差电
池的电动势的理论值:
-10
8.314X291.15X[ln(O.072/(1.56X10/0.768*0.1))]/96485.31=0.4361V,
它与实验值0.4441V的偏差为:
E'二(0.4441-0.43611/0.4361)X100%=1.83%
这个偏差比前一个较小。
可见计算过程中的对数运算一步起到了一个“放大镜”的作用,造成了最后结果出现很大的偏差。
(5)根据不同温度的电池的电动势值,计算不同温度下的各热力学函数。
不同温度下Zm甘汞电极电动势
1062
1060
1058
1056
1054
1052
1050
1048
1046
1044
图3电阻温度系数
1042
表4不同温度下ZnZnS04(0.1000mol/kg-饱和甘汞电极热力学函数值
温度/c
摩尔吉布斯函数/KJ
摩尔生成熔/KJ
摩尔爛/KJ
20
-102.178
-2096.337
-52.777
25
-101.975
-2092.277
-52.777
30
-101.696
-2086.697
-52.777
35
-101.425
-2081.277
-52.777
40
-101.155
-2075.877
-52.777
45
-100.904
-2070.857
-52.777
50
-100.605
-2064.877
-52.777
3.3分析与讨论
误差的产生可能有以下儿个方面:
电极没有完全磨亮,还有一些氧化,电极不纯净。
电极管上的吸液乳胶管未被夹紧(或老化)使电极管漏液来固定银(或锌)棒的胶塞与电极管接触不严密,使电极管漏液标准浓度的溶液浓度存放较久有所改变,并不是盐桥被污染,我们在使用盐桥的时候,就忘记了把盐桥清洗干净再放到烧杯里,有可能有所0.lmol/L
污染
新制的锌汞齐表面被氧化,锌汞齐制好后没有尽快地放入硫酸锌溶液中(我们确实没有很快
把锌汞齐放进去)
饱和甘汞电极电势数据不稳,实验前数小时未将饱和甘汞电极浸泡到饱和氯化钾溶液制作半电池时,电极没过液体的部分不可过小,影响示数温度的测量。
上午室温并不恒定,我们在实验中间测量的温度,应该是不同时候的温度不同
温差有一度左右,所以对测得的电动势值有所影响
(10)使用恒温水浴时没有等到温度完全恒定再读数,使得读数有一些偏差。
4、参考文献
《基础物理化学实验》.高等教育出版社,清华大学,贺徳华,麻英,张连庆
5、思考题
(1)对消法测定电池电动势的原理是什么
答:
对消法的原理是在待测电池上并联一个大小相等、方向相反的外加电动势,这样待测电池中没有电流流过,外加电势差的大小即等于待测电池的电动势。
2)盐桥的选择原则和作用是什么
答:
选择盐桥中电解质的要求是:
高浓度(通常是饱和溶液);电解质正、负离子的迁移速率接近相等;不与电池中的溶液发生反应。
通常选作盐桥电解质的是KCINH4N03和KNQ。
对于双液电池电动势的测定需用盐桥消除液体接界电
势。
3)在测量过程中,若检流计光点总是往一个方向偏转,可能是什么原因?
答:
可能有以下儿个原因:
①测量前未做电位差计的标定。
由于工作电池电压的不稳定,将导致工作电流的变化,所以在测量过
程中要经常对工作电流进行核对,即每次测量操作的前、后都应进行电位差计的标定操作,
按照标定
-测量一标定的步骤进行。
②在测量过程中,若发现检流计光点总是偏向一侧,找不到平衡点,这表明没有达到补偿,
其原因可
能是被测电动势高于电位差计的限量;工作电池的电压过低;线路接触不良或导线有断路;
被测电池、
工作电池或标准电池极性接反。
4)标准电池的构造以及使用时应注意什么
答:
测定电动势时所用的标准电池是电动势已知的可逆电池,并且其数值保持长期稳定不变。
目前最常用的是韦斯顿(Weston)标准电池,其电极反应是:
负极:
Cd(汞齐)7Cf+2e
正极:
Hg2S04(s)+2e72Hg(I)+S042-
电池反应:
Cd(汞齐)+Hg2SQ(s)一Cd2++SQ2-+2Hg
(1)
电池反应是可逆的,并且电势很稳定。
标准电池在搬动和使用时,不要使其倾斜和倒置,要放置平稳。
接线时正接正、负接负,两极不允许短路放电。