推荐高三一轮复习金属及其化合物知识点总结.docx
《推荐高三一轮复习金属及其化合物知识点总结.docx》由会员分享,可在线阅读,更多相关《推荐高三一轮复习金属及其化合物知识点总结.docx(17页珍藏版)》请在冰豆网上搜索。
推荐高三一轮复习金属及其化合物知识点总结
高三化学总复习――金属及其化合物知识点总结5.18
一.金属的通性
1.位置:
金属元素位于周期表的左下角,最外层电子数大部分少于4个。
2.物理通性:
大部分有延展性、金属光泽,都有导热导电性等。
3.化学性质:
易失电子,被氧化,金属表现还原性。
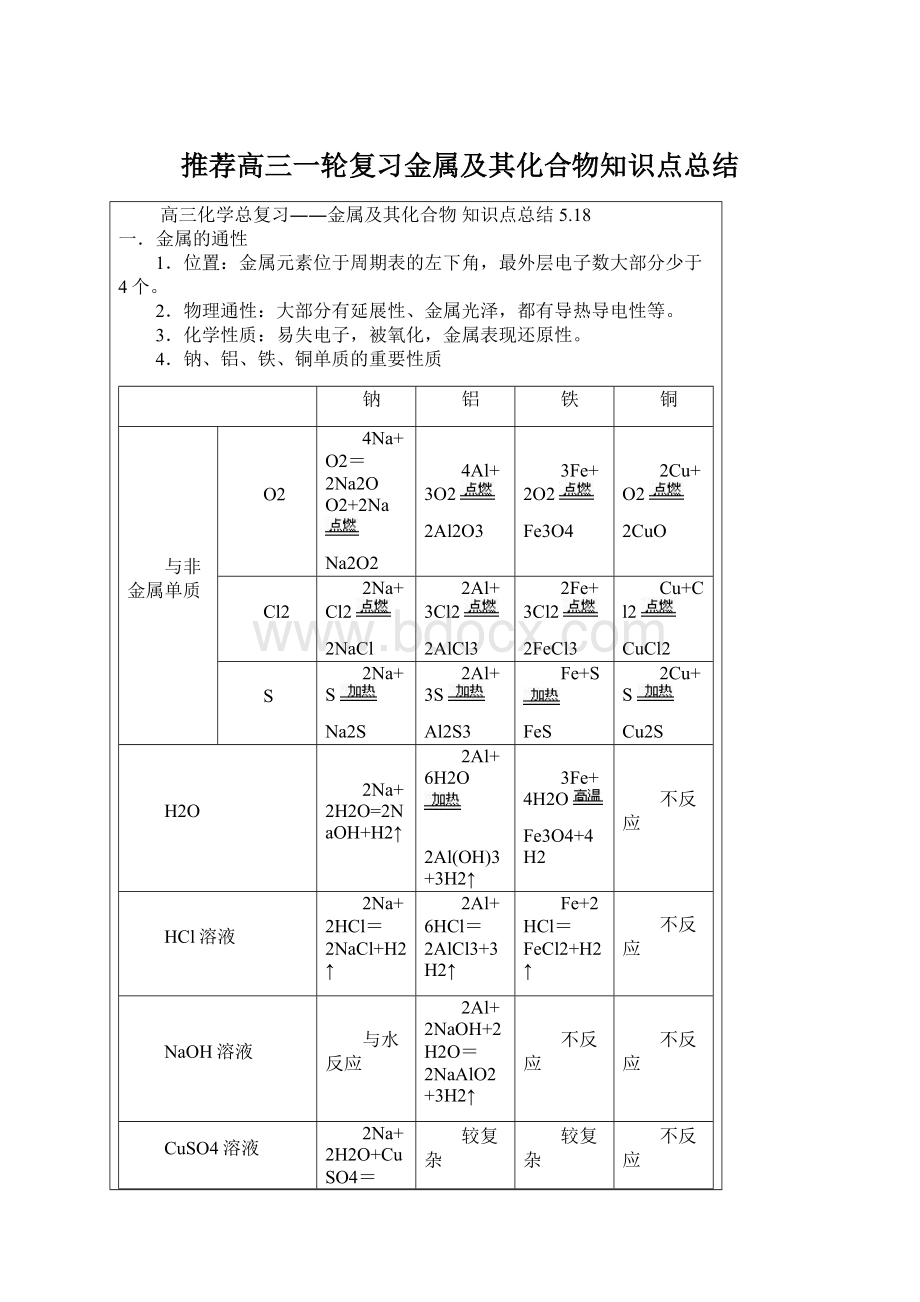
4.钠、铝、铁、铜单质的重要性质
钠
铝
铁
铜
与非金属单质
O2
4Na+O2=2Na2O
O2+2Na
Na2O2
4Al+3O2
2Al2O3
3Fe+2O2
Fe3O4
2Cu+O2
2CuO
Cl2
2Na+Cl2
2NaCl
2Al+3Cl2
2AlCl3
2Fe+3Cl2
2FeCl3
Cu+Cl2
CuCl2
S
2Na+S
Na2S
2Al+3S
Al2S3
Fe+S
FeS
2Cu+S
Cu2S
H2O
2Na+2H2O=2NaOH+H2↑
2Al+6H2O
2Al(OH)3+3H2↑
3Fe+4H2O
Fe3O4+4H2
不反应
HCl溶液
2Na+2HCl=2NaCl+H2↑
2Al+6HCl=2AlCl3+3H2↑
Fe+2HCl=FeCl2+H2↑
不反应
NaOH溶液
与水反应
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
不反应
不反应
CuSO4溶液
2Na+2H2O+CuSO4=Na2SO4+Cu(OH)2↓+H2↑
较复杂
较复杂
不反应
制备
2NaCl
2Na+Cl2↑
2Al2O3
4Al+3O2↑
Fe2O3+3CO
2Fe+3CO2
CuO+CO
Cu+CO2
二.钠及其化合物
1.钠
⑴钠的物理性质
状态
颜色
硬度
密度
熔点
导电、导热性
固体
银白色
较小(比水大)
较小(比水小)
较低(用酒精灯加热,很快熔化)
是电和热的良导体
⑵钠的化学性质
①钠与非金属单质的反应
A:
与氧气:
4Na+O2=2Na2O(变暗);O2+2Na
Na2O2(燃烧生成淡黄色固体)
B:
与氯气:
2Na+Cl2
2NaCl;
C:
与S:
2Na+S
Na2S
②钠与水的反应(水中先滴入酚酞)
2Na+2H2O=2NaOH+H2↑
现象概述
现象描述
原因
浮
浮在水面
钠的密度比水小
游
四处游动
钠与水反应产生气体
熔
融化成银白色小球
钠的熔点较低,且该反应放出大量热
响
发出咝咝的响声
钠与水反应剧烈
红
溶液由无色变为红色
生成了碱性物质
③钠与酸的反应:
2Na+2H+=2Na++H2↑
④钠与盐溶液的反应:
2Na+2H2O+CuSO4=Na2SO4+Cu(OH)2↓+H2↑;6Na+6H2O+2FeCl3=6NaCl+2Fe(OH)3↓+3H2↑
⑤Na可与某些有机物反应:
2CH3COOH+2Na→2CH3COONa+H2↑;2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;
2C6H5OH+2Na→2C6H5ONa+H2↑;
⑶钠的保存
通常钠保存在煤油中,原因是①钠极易与空气中的O2、水蒸气反应;
②钠不与煤油反应;
③钠的密度比煤油大,沉于底部。
注意:
钠保存在煤油中,而不能保存在汽油、CCl4中,因汽油易挥发,CCl4的密度比钠的密度大,起不到隔离O2和H2O的作用。
⑷钠的用途:
①冶炼金属:
TiCl4+4Na
Ti+4NaCl;
②钠钾合金,作原子反应堆的导热剂;
③在电光源上,用钠制高压钠灯。
2.钠的重要化合物
⑴Na2O、Na2O2和NaOH
名称和化学式
氧化钠(Na2O)
过氧化钠(Na2O2)
氢氧化钠(NaOH)
颜色和状态
白色固体
淡黄色固体
无色固体
类别
碱性氧化物
离子化合物
过氧化物
离子化合物
碱
离子化合物
电子式
Na+[
]Na+
Na+[
]2-Na+
Na+[
]-
氧元素化合价
-2
-1
-2
化学键
离子键
离子键
非极性键
离子键
极性键
稳定性
不稳定
比Na2O稳定
稳定
与水反应
Na2O+H2O=2NaOH
2Na2O2+2H2O=4NaOH+O2↑
不反应
与酸反应
Na2O+2HCl=2NaCl
+H2O
2Na2O2+4HCl=4NaCl+O2↑+2H2O
NaOH+HCl=NaCl+H2O
与酸酐反应
Na2O+CO2=Na2CO3
2Na2O2+2CO2=2Na2CO3+O2↑
2NaOH+CO2=Na2CO3+H2O
NaOH+CO2=NaHCO3
与盐溶液反应
Na2O+2NaHSO4=2Na2SO4+H2O
Na2O+H2O+CuSO4=Cu(OH)2↓+Na2SO4
2Na2O2+4NaHSO4=4Na2SO4+O2↑+2H2O
2Na2O2+H2O+CuSO4=
Cu(OH)2↓+2Na2SO4+O2
NaOH+NaHSO4=Na2SO4+H2O
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
用途
制氢氧化钠
漂白剂、供氧剂、
氧化剂
化工原料、制纸浆、肥皂
知识拓展:
Na2O2的强氧化性:
能氧化SO2、FeCl2、H2S、Na2SO3、等,因强氧化性而使品红溶液褪色。
⑵Na2CO3和NaHCO3
名称和化学式
碳酸钠(Na2CO3)
碳酸氢钠(NaHCO3)
俗名
纯碱、苏打
小苏打
颜色和状态
白色晶体
白色粉末
水中溶解性
易溶
易溶(比Na2CO3溶解度小)
热稳定性
稳定
不稳定:
2NaHCO3
Na2CO3+CO2↑+H2O
与酸反应
CO32-+H+=HCO3-
HCO3-+H+=H2O+CO2↑
HCO3-+H+=CO2↑+H2O
与某些碱反应
Ba(OH)2+Na2CO3=BaCO3↓+2NaOH
NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O
2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O
与某些盐反应
BaCl2+Na2CO3=BaCO3↓+2NaCl
NaHCO3+NaHSO4=Na2SO4+H2O+CO2↑
与CO2反应
Na2CO3+CO2+H2O=2NaHCO3
不反应
相互转化
Na2CO3
NaHCO3
制法
NaOH+CO2=NaHCO3
2NaHCO3
2Na2CO3+H2O+CO2↑
NaOH+CO2=NaHCO3
鉴别
加酸产生CO2
加热难分解
加酸产生CO2较Na2CO3快
加热分解出CO2
用途
制玻璃、肥皂、造纸、纺织
发酵粉、治胃酸过多
知识拓展:
①钠在露置于空气中的变化过程:
Na→Na2O→NaOH→NaOH(aq)→Na2CO3·10H2O→Na2CO3
银白色→变暗→白色固体→溶液→白色块状→白色粉末
②碳酸钠与盐酸的反应:
若将盐酸逐滴缓慢滴加到碳酸钠溶液中:
H++CO32-=HCO3-;HCO3-+H+=H2O+CO2↑。
现象:
开始无气体生成,滴加到一定量后出现气体。
若将碳酸钠逐滴缓慢滴加到盐酸中:
2H++CO32-=H2O+CO2↑。
现象:
立即出现气泡。
(常用来相互鉴别)
⑶钠及其化合物间的相互转化
3.碱金属元素的原子结构和性质及其递变规律
名称和符号
锂(Li)
钠(Na)
钾(K)
铷(Rb)
铯(Cs)
原子序数
3
11
19
37
55
结
构
原子结构结构简图
电子式
Li·
Na·
K·
Rb·
Cs·
主要化合价
+1
+1
+1
+1
+1
相同点
最外层电子数相同,都是1个电子
不同点
原子核外电子层数不同,依次增多
原子半径
依次递增
离子半径
依次递增
金属活动性
依次递增
质还原性
依次递增
阳离子氧化性
依次递减
物理性质
颜色和状态
银白色固体
密度
0.534g/cm3
0.97g/cm3
0.86g/cm3
1.523g/cm3
1.879g/cm3
熔点
依次递减
沸点
依次递减
化学性质
跟氧气反应
4Li+O2=2Li2O
4Na+O2=2Na2O
2Na+O2
Na2O2
2K+O2=K2O2
K+O2
KO2
Rb+O2
RbO2
Cs+O2
CsO2
跟卤素反应
2M+X2=2MX(M、X2分别表示碱金属、卤素)
跟硫反应
2M+S=M2S
与水反应
2M+2H2O=2MOH+H2↑ 反应剧烈程度:
Li<Na<K<Rb<Cs
与酸反应
2M+2H+=2M++H2↑
与盐溶液反应
(CuSO4)
制法
2MCl
2M+Cl2↑(K:
Na+KCl
K+NaCl)
知识拓展:
碱金属的特殊性:
①Na、K需保存于煤油中,但Li的密度比煤油小,所以Li必须保存在密度更小的石蜡中或密封于石蜡中。
②碱金属中,从Li→Cs,密度呈增大的趋势,但ρ(K)<ρ(Na)
③试剂瓶中的药品取出后,一般不能放回原瓶,但金属Na、K等除外。
三.镁、铝及其化合物
1.镁与铝
⑴原子结构及物理性质
镁
铝
在周期表中位置
第3周期第ⅡA族
第3周期第ⅢA族
原子结构示意图
色态
较低
较低但大于镁
熔点
较小
较小但大于镁
密度
较小
较小但大于镁
硬度
较小
较小但大于镁
⑵镁铝的化学性质
项目
Mg
Al
与非金属反应
O2
方程式
2Mg+O2
2MgO
4Al+3O2
2Al2O3
现象
剧烈反应、耀眼白光、放出大量热
S
Mg+S
MgS
2Al+3S
Al2S3
N2
3Mg+N2
Mg3N2
与H2O
方程式
Mg+2H2O
Mg(OH)2+H2↑
2Al+6H2O=2Al(OH)3↓+3H2↑
现象
冷水慢,沸水快
一般不反应,只有氧化膜被破坏后反应
与酸反应
Mg+2H+=Mg2++H2↑
2Al+6H+=2Al3++3H2↑(常温下,在浓H2SO4、浓HNO3中钝化)
与NaOH溶液
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
与某些氧化物
2Mg+CO2
2MgO+C
2Al+Fe2O3
2Fe+Al2O3
主要用途
镁合金汽车、飞机制造、照明弹等
铝合金汽车、船舶、飞机制造、防锈油漆、导线、电缆等
工业制备
MgCl2
Mg+Cl2↑
2Al2O3
4Al+3O2↑
2.镁和铝氧化物的对比
氧化物
MgO
Al2O3
属类
碱性氧化物
两性氧化物
色态
白色粉末、熔点高
白色粉末、熔点高
化学
性质
H2O
MgO+H2O=Mg(OH)2↓(反应缓慢进行)
不溶解也不反应
酸液
MgO+2H+=Mg2++H2O
Al2O3+6H+=2Al3++3H2O
NaOH溶液
不溶解也不反应
Al2O3+2NaOH=2NaAlO2+H2O
重要用途
制造耐火、耐高温材料
制造耐火、耐高温器材,冶炼铝
3.镁和铝的氢氧化物
氢氧化物
Mg(OH)2
Al(OH)3
属类
碱
两性氢氧化物
色态
白色固体
白色固体
溶解性
难溶
难溶
电离方程式
Mg(OH)2
Mg2++2OH-
H2O+AlO2-+H+
Al(OH)3
Al3++3OH-
与HCl等酸溶液
Mg(OH)2+2HCl=MgCl2+2H2O
(可溶于NH4Cl等强酸弱碱盐)
Al(OH)3+3HCl=AlCl3+3H2O
与NaOH溶液
不反应
Al(OH)3+NaOH=NaAlO2+2H2O
热不稳定性
Mg(OH)2
MgO+H2O
2Al(OH)3
Al2O3+3H2O
实验室制法
可溶性镁盐加NaOH溶液 Mg2++2OH-=Mg(OH)2↓
可溶性铝盐加氨水
Al3++3NH3·H2O=Al(OH)3↓+3NH+4
4.铝及其化合物间相互转化、铝三角及相关图象
实验操作
实验现象
图象
离子方程式
①向可溶性铝盐溶液中滴加NaOH溶液至过量
先生成沉淀又溶解
Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=AlO2-+2H2O
②向可溶性铝盐溶液中滴加稀氨水至过量
出现白色沉淀
Al3++3NH3·H2O=Al(OH)3↓+3NH4+
③向NaOH溶液中滴加可溶性铝盐溶液至过量
开始无明显变化,一段时间后出现沉淀
Al3++4OH-=AlO2-+2H2O;
3AlO2-+Al3++6H2O=4Al(OH)3↓
④向可溶性偏铝酸盐溶液中滴加盐酸至过量
先沉淀又溶解
H++AlO2-+H2O=Al(OH)3↓;
Al(OH)3+3H+=Al3++3H2O
⑤向可溶性偏铝酸盐溶液中逐渐通入CO2气体至过量
先无明显变化,后出现沉淀
AlO-2+2H2O+CO2(过量)=Al(OH)3↓+HCO-3
2AlO2-+3H2O+CO2(少量)=Al(OH)3↓+CO2-3
⑥向盐酸中滴加可溶性偏铝酸盐溶液至过量
出现白色沉淀
4H++AlO2-=Al3++2H2O;
3AlO2-+Al3++6H2O=4Al(OH)3↓
知识拓展:
⑴Al(OH3)的两性:
H2O+AlO2-+H+
Al(OH)3
Al3++3OH-
酸式电离 碱式电离
当向Al(OH)3中加入酸溶液,平衡向碱式电离方向移动,使Al(OH)3溶解。
当向Al(OH)3中加入强碱溶液时,平衡向酸式电离方向移动,使Al(OH)3溶解。
⑵铝热反应及应用:
2Al+Fe2O3
2Fe+Al2O3;4Al+3MnO2
3Mn+2Al2O3
铝热剂――铝粉和金属氧化物;助燃剂――KClO3;引燃剂――镁条。
铝热反应应用:
焊接钢轨,冶炼熔点较高的金属如:
钒、铬、锰等。
⑶既能与强酸又能与强碱反应的物质:
①金属单质:
Al;②两性氧化物:
Al2O3;③两性氢氧化物Al(OH)3;④弱酸的酸式盐:
NaHCO3、NH4HCO3等;⑤弱酸铵盐:
(NH4)2CO3、(NH4)2S等。
四.铁及其化合物
1.铁
⑴铁的原子结构:
位于第4周期Ⅷ族,是过渡元素。
原子结构示意图:
;常见价态+2,+3价。
⑵物理性质:
纯铁为银白色有金属光泽,有延展性和导热性,能导电,能被磁铁吸引,密度7.86g/cm3,熔点1535℃,沸点2750℃。
⑶化学性质:
铁能与Cl2、Br2、O2、I2、S等非金属单质反应;与稀硫酸、浓硫酸、硝酸、盐酸等酸反应;与H2O、Fe3+、Cu2+等反应。
①与铁生成+3价的有:
Cl2、Br2、浓硫酸、硝酸等。
②与铁生成+2价的有:
I2、S、稀硫酸、盐酸、Fe3+、Cu2+等。
③与铁生成Fe3O4的有:
O2、H2O等。
2.铁的氧化物
3.铁的氢氧化物
4.亚铁和铁盐的鉴别
5.铁三角
知识拓展:
●Fe3+的性质规律:
⑴水解性:
①Fe3+半径小,所带电荷高,水解能力强。
常温下,Fe3++3H2O
Fe(OH)3+3H+
沸水中,Fe3++3H2O(沸水)
Fe(OH)3(胶体)+3H+
②遇HCO3-、CO32-、AlO2-、ClO-等离子时,水解完全。
如Fe3++3HCO3-=Fe(OH)3↓+3CO2↑。
③将FeCl3溶液蒸干并灼烧,得Fe2O3。
④在pH≥4时,它就形成Fe(OH)3而沉淀完全。
⑵较强的氧化性:
①Fe3+的氧化性在金属阳离子中是比较强的,其氧化性:
H+ ②Fe3+表现氧化性的反应有:
⑶特征络合反应:
Fe3++3SCN-=Fe(SCN)3显红色。
Fe3++6C6H5OH=[Fe(C6H5O)6]3-+6H+,显紫色。
●制Fe(OH)2白色沉淀:
Fe(OH)2极易被氧化,溶解在水中少量的O2都能将它氧化成Fe(OH)3,所以按一般强碱与弱酸盐反应制弱碱的操作很难得到Fe(OH)2白色沉淀。
要制得Fe(OH)2白色沉淀必须用加热煮沸过的蒸馏水(以减少溶解在水中的
O2)临时配制的FeSO4溶液,最好在溶液中再滴几滴植物油以避免FeSO4溶液与空气接触,准备加入的NaOH溶液也要先加热煮沸,加入NaOH溶液时应将滴管尖嘴伸人FeSO4溶液的试管底部再挤出NaOH溶液。
五.铜及其化合物
1.铜
⑴原子结构:
铜元素位于元素周期表第4周期ⅠB族,过渡元素。
原子结构示意图:
;常见价态+1和+2价。
⑵物理性质:
紫红色光泽,熔点1083.4℃,沸点为2567℃,有良好延展性,是电和热的良导体。
⑶化学性质:
①与非金属单质2Cu+O2
2CuO(黑色);2Cu+S
Cu2S;Cu+Cl2
CuCl2
②与酸反应:
与非氧化性酸反应(稀盐酸、稀硫酸)不反应。
Cu+2H2SO4(稀)
CuSO4+SO2↑+2H2O;Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
③盐溶液:
Cu+2AgNO3=2Ag+Cu(NO3)2;Cu+2FeCl3=CuCl2+2FeCl2
④在潮湿空气中生成铜绿:
2Cu+O2+H2O+CO2=Cu2(OH)2CO3
2.铜的化合物
⑴铜的氧化物[CuO]
CuO+2HCl=CuCl2+H2O;H2+CuO
Cu+H2O;C+2CuO
2Cu+CO2↑
⑵铜的氢氧化物[Cu(OH)2]:
蓝色难溶于水。
Cu(OH)2+2HCl=CuCl2+2H2O;Cu(OH)2
CuO+H2O;
CH3CHO+2Cu(OH)2
Cu2O↓+CH3COOH+2H2O
⑶硫酸铜[CuSO4]
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;CuSO4+Fe=Cu+FeSO4;
CuSO4·5H2O
CuSO4+5H2O(蓝色粉末变为白色粉末);CuSO4+5H2O=CuSO4·5H2O(白色粉末变成蓝色,常用来检验水的存在)。
3.铜及其化合物间的相互转化
六.金属规律小结:
金属活动顺序表及应用(重点:
钠、镁、铝、铁、铜的性质及强弱比较)
金属活动顺序
KCaNa
MgAlZn
FeSnPb
(H)
CuHgAg
PtAu
原子失电子能力
由大到小,还原性由强到弱
离子得电子能力
由小到大,氧化性由弱到强
和氧气反应
常温易被氧化
常温能被氧化
常温干燥空气中不易被氧化
加热时能被氧化
不能氧化
和水反应
剧烈反应得强碱和H2
与热水慢反应
高温与水蒸气反应生成金属氧化物和H2
不跟水反应
和酸反应
剧烈反应置换出氢
能置换出酸(非氧化性酸)中的氢
不能置换稀酸中的氢
与氧化性酸反应
只溶于王水
和强碱反应
仅Al、Zn能跟强碱水溶液反应
和盐溶液反应
先与水反应
前面的金属从盐溶液中置换出后面的金属
金属氧化物与水
剧烈反应
弱
不溶于水,也不与水反应
碱的热分解
不分解
受热分解
常温分解
冶炼方法
熔融电解法
热还原法(高温用CO、Al等)
热分解法
物理方法
在自然界中的存在形式
只以化合态存在
多以化合态,极少以游离态
只以游离态存在
七.合金
1.概念:
由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
2.性能:
硬度比单一金属大;熔点比单一金属低;化学性质与单一成分不同;机械性能优于单一成分
(注:
文档可能无法思考全面,请浏览后下载,供参考。
可复制、编制,期待你的好评与关注!
)