黑龙江省大庆市喇中初中化学 考题精选复习25 二氧化碳和一氧化碳.docx
《黑龙江省大庆市喇中初中化学 考题精选复习25 二氧化碳和一氧化碳.docx》由会员分享,可在线阅读,更多相关《黑龙江省大庆市喇中初中化学 考题精选复习25 二氧化碳和一氧化碳.docx(24页珍藏版)》请在冰豆网上搜索。
黑龙江省大庆市喇中初中化学考题精选复习25二氧化碳和一氧化碳
二氧化碳和一氧化碳
1、“凤凰”号火星探测器圆满完成任务,向地面发回数量堪称史无前例的图像和数据,为人类探索火星提供了宝贵的科学资料。
请完成14~16题。
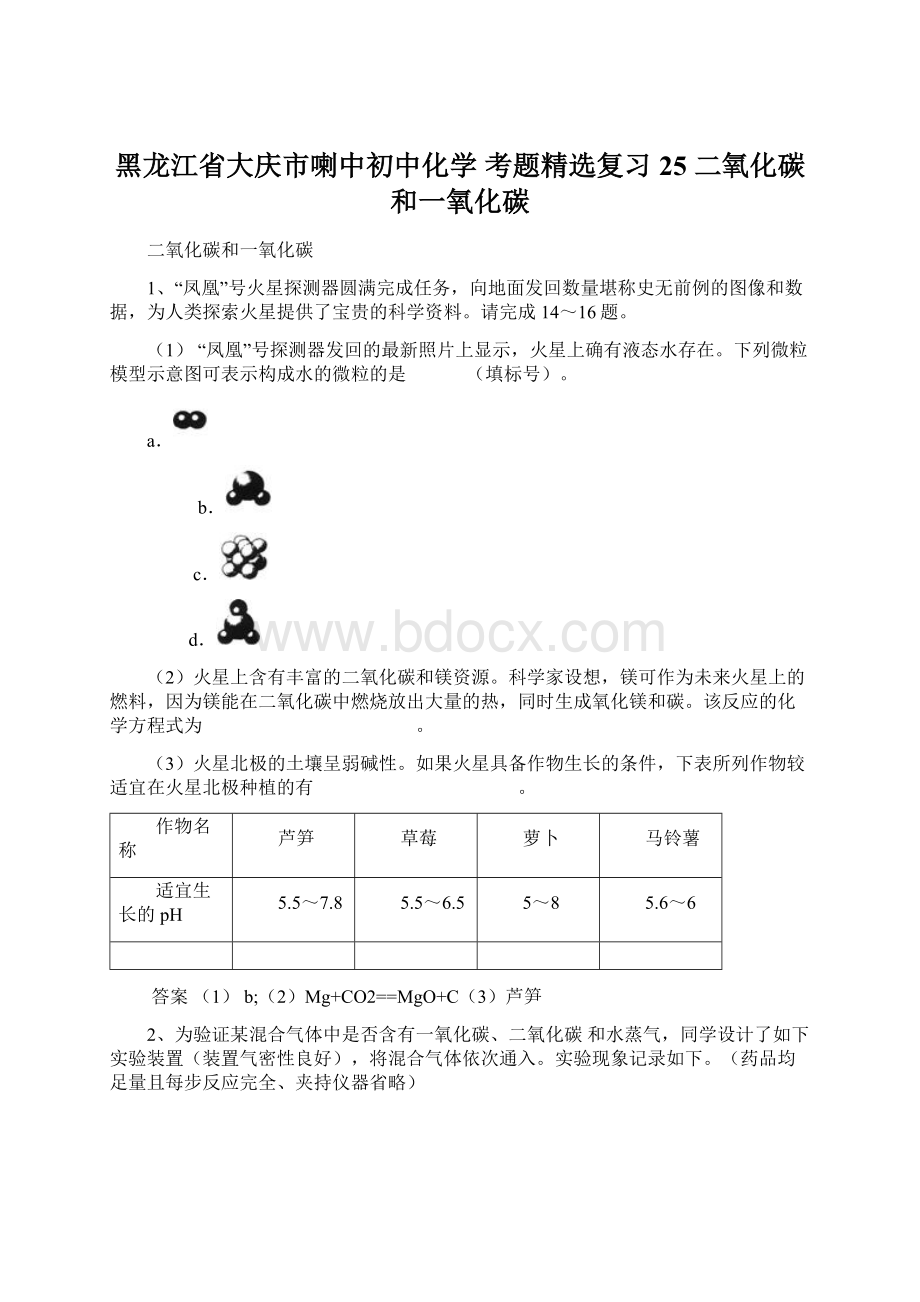
(1)“凤凰”号探测器发回的最新照片上显示,火星上确有液态水存在。
下列微粒模型示意图可表示构成水的微粒的是 (填标号)。
a.
b.
c.
d.
(2)火星上含有丰富的二氧化碳和镁资源。
科学家设想,镁可作为未来火星上的燃料,因为镁能在二氧化碳中燃烧放出大量的热,同时生成氧化镁和碳。
该反应的化学方程式为 。
(3)火星北极的土壤呈弱碱性。
如果火星具备作物生长的条件,下表所列作物较适宜在火星北极种植的有 。
作物名称
芦笋
草莓
萝卜
马铃薯
适宜生长的pH
5.5~7.8
5.5~6.5
5~8
5.6~6
答案
(1) b;
(2)Mg+CO2==MgO+C(3)芦笋
2、为验证某混合气体中是否含有一氧化碳、二氧化碳 和水蒸气,同学设计了如下实验装置(装置气密性良好),将混合气体依次通入。
实验现象记录如下。
(药品均足量且每步反应完全、夹持仪器省略)
装置
现象
甲
增重
乙
无明显现象
丙
粉末由 变红
丁
试液由紫变红,气球变大
Ⅰ.仪器a的名称 (21) 。
Ⅱ.丙中粉末由 (22) 变红,发生的化学反应方程式为 (23) ,其中氧化铜作 (24)
剂。
Ⅲ.根据上述现象,分析混合气体中一定含有水蒸气、一氧化碳,可能含有二氧化碳 。
写出可能
含有二氧化碳的理由 (25) 。
Ⅳ.在不改变装置的前提下,只需将装置 (26) 中药品换成 (27) ,即可判断二氧化碳是否存在。
答案(21)锥形瓶(22)黑
(23)CuO+CO
Cu+CO2(24)氧化
(25)甲中氧化钙吸收水蒸气生成氢氧化钙,如含有CO2会与氢氧化钙反应,导致乙中无明显现象
(26)甲(27)CuSO4
3、探究水蒸气通过灼热的木炭后,得到的混合气体的主要成分。
【提出猜想】该混合气体主要成分为CO、CO2、H2和H2O。
【查阅资料】a.浓硫酸可作干燥剂。
b.氢气在加热的条件下与氧化铜反
应生成铜和水。
【实验过程】设计实验装置如下:
(部分夹持仪器已略去;假设每个装置里的药品足量,反应充分)。
装置A中无水硫酸铜变蓝,写出该反应的化学方程式 (11) ,装置B中澄清石灰水变浑浊,写出该反应的化学方程式 (12) ,由此得出混合气体中含有CO2和H2O气体;②通过观察装置D、E中的现象后,为了确认混合气体中含有氢气,装置C中的试剂是 (13) 。
为了证明CO气体的存在,装置F中试剂是 (14) 。
【实验结论】猜想正确。
答案(11)CuSO4+5H2O→CuSO4•5H2O(12)CO2+Ca(OH)2→CaCO3↓+H2O
(13) 浓硫酸 (14)澄清石灰水
4、小明为了验证CO的化学性质,他设计了如图所示的实验装
置,请你结合装置图回答下列问题:
(1)写出下列装置中发生的化学反应方程式
装置A ,
装置D ,
(2)装置B的作用是 ;
(3)装置有一个明显不足,请指出具体的改进措施 。
答案
(1)A装置CO2+C 加热2CO D 装置C+2CuO 高温 2Cu+CO2↑
(2)除去CO2 (3)在E的末端放一个燃着的酒精灯或其他符合题意的答案
5、科学家把工业上排出的二氧化碳气体采用“组分转化”技术,将CO2和H2以一定比例混合,在一定条件下反应生成一种重要的化工原料和水,反应的化学方程式为:
2CO2+6H2
X十4H2O,
(1)请写出X的化学式 , 判断依据是 。
(2)为了减缓大气CO2含量的增加,下列建议中,目前可行的是 (填序号)
①严格遵守国际相关“低碳”公约
②禁止使用煤、
石油等矿物能源
③更多地利用太阳能、风能等清洁能源
④少开私家车
答案
6、按照要求写出下列化学方程式:
(1)实验室用氯酸钾制取氧气
(2)木炭粉与氧化铁发生化学反应
(3)铁在氧气中燃烧产生黑色
固体
(4)碳酸在常温下发生分解反应
答案
7、下列说法正确的是( )
A.油锅中的油着火,用水浇灭
B.检验二氧化碳气体:
用燃着的小木条
C.氢气和氮气的混合气体遇明火,猛烈爆炸
D.“釜底抽薪”可理解为通过清除可燃物来达到灭火目的
答案D
8、为了制取CO2并验证它的性质,张林同学设计并进行了如图所示的实验,请根据要求回答有关问题.
(1)玻璃管内发生的化学反应体现碳具有 性.
(2)D中石蕊溶液始终没有变红,则C装置中M最有可能是 (填序号).
A.稀硫酸 B.澄清石灰水 C.氢氧化钠溶液
(3)尾气的处理方法可以是 .
(4)为了证明A中反应后的溶液里含有CaCl2,张林同学向溶液中滴加少许Na2CO3溶液,结果没有观察到白色沉淀,你推测是 (填物质名称或化学式)的干扰.
答案分析:
(1)根据碳的化学性质来分析;
(2)根据出现此种现象的原因来分析,可能是在C处二氧化碳已经被完全吸收;
(3)尾气中含有一氧化碳,会污染空气;
(4)加入碳酸钠溶液不会产生沉淀可能是盐酸有剩余.
解答:
解:
(1)在该装置中,碳能将二氧化碳转化为一氧化碳,故填:
还原;
(2)中不变色,说明在C处二氧化碳已经被完全吸收,稀硫酸不与二氧化碳反应;石灰水虽然反应,但由于氢氧化钙微溶于水,不可能将二氧化碳完全吸收;氢氧化钠易溶于水,且能与二氧化碳反应;
故选:
C;
(3)尾气中的一氧化碳有毒,会污染空气,所以要进行的点燃处理或用气球收集起来;故填:
点燃(其他合理答案亦可);
(4)加入碳酸钠溶液后没有产生白色沉淀,说明A中稀盐酸有剩余.
故填:
盐酸(或HCl).
9、某学习小组在做氢气还原氧化铜的实验时,在试管内加入氧化铜固体10克,通入氢气一会儿后再给氧化铜加热,反应完全后撤去酒精灯并停止通入氢气,在空气中将试管冷却,发现部分红色团体又变回黑色.称得试管中剩余固体质量为8.4克.
(1)“在空气中将试管冷却”会导致 ,使“部分红色固体又变回黑色”.
(2)按此实验操作及获得的数据,可知试管剩余固体中有氧化铜 克.
答案分析:
根据已有的知识进行分析,一氧化碳能将氧化铜还原为铜,铜在较高温度下能被空气中的氧气氧化为氧化铜;一氧化碳还原氧化铜时,固体质量减少量即为氧元素的质量,根据减少的氧元素的质量可以求出被还原的氧化铜的质量,从而求出剩余的氧化铜的质量.
解:
(1)铜在较高温度时易被空气中的氧气氧化,故填:
铜被氧化;
(2)根据题干提供的数据,固体质量减少量为:
10g﹣8.4g=1.6g
则被还原的氧化铜的质量为:
1.6g÷
=8g
故剩余的氧化铜的质量为10g﹣8g=2g
故填:
2.
10、如图,实验室中用碳酸钙与盐酸反应制取CO2气体,此CO2气体中常含有水蒸气和氯化氢气体若要除去这两种气体杂质,可将生成的气体通过甲、乙两个洗气瓶,通过导管的正确顺序是( )
A、①②③④ B、②①③④
C、④③②① D、③④②①
答案D
11、实验室有一气体发生装置产生的无色气体可能含有H2、CO、CO2、HCl中的一种或几种,现将气体通过以下装置.
实验现象如下:
B处由紫色变成红色;C处有白色沉淀生成;D处有白色沉淀生成;F处由黑色变成红色;G处由白色变成蓝色;H处无现象.
(1)无色气体肯定含 .
(2)由长颈漏斗加入的酸是 ,锥形瓶中装入的固体是少量 和 的混合物.
(3)E装置是为了排除对验证 的影响.
(4)E装置中浓硫酸(选填“能”或“不能”) 换成浓氢氧化钠.
(5)如果B装置中的试纸不变色,则可省去 、 装置(填装置代号).
答案分析:
根据现象逐一分析:
石蕊试液变成红色,说明溶液显酸性,有酸性气体存在;硝酸银溶液产生白色沉淀说明有氯化氢存在;D处石灰水产生白色沉淀,说明有二氧化碳的存在;F处的氧化铜变成红色,说明有还原性气体存在,可能是氢气,一可能是一氧化碳;G处白色硫酸铜变成蓝色,说明有水的生成.
解:
(1)分析装置A中的气体一定有盐酸挥发出的氯化氢气体,盐酸和碳酸盐、活泼金属产生的二氧化碳和氢气;一定不含一氧化碳,因为H处的石灰水无现象,说明没有二氧化碳的生成,因此还原性气体就没有一氧化碳;
(2)C处的硝酸银溶液产生白色沉淀,说明有氯化氢的存在,氯化氢来自盐酸的挥发性,因此有长颈漏斗加入的酸是盐酸;D处的石灰水产生白色沉淀,说明有二氧化碳的存在,是盐酸与碳酸盐(如碳酸钙)反应产生的;F处的氧化铜变成红色,说明有还原性气体存在,G处白色硫酸铜变成蓝色,说明有水的生成,进一步说明有氢气的存在,氢气可以是盐酸与活泼金属(如锌)反应产生的;
(3)E装置的浓硫酸把还原性气体干燥后,就能证明硫酸铜变色是来源于氢气,而不是还原性气体带来的水,故是排除对氢气的干扰;
(4)E中的浓硫酸起到干燥氢气的作用,以免产生对使硫酸铜变成蓝色的水的来源产生干扰,即硫酸铜变色是氢气反应产生的水,而不是带来的水;另外氢氧化钠溶液没有干燥的作用;
(5)如果B装置中的试纸不变色,说明没有酸性气体的存在,即没有二氧化碳和氯化氢气体,所以可以省略C和D装置.
故答案为:
(1)H2、CO2、HCl.
(2)稀盐酸,Zn 和 CaCO3.
(3)H2.
(4)不能.
(5)C、D.
12、小丽利用底部有一个小孔的大试管,如图甲所示配制成一个制取CO2气体的装置.
(1)实验前,关闭止水夹,先将试管底部稍浸没在水中,再用双手紧握试管,观察到 ,则说明装置气密性良好;
(2)小丽将CO2通入盛有NaOH溶液的试管中,观察不到明显现象,那么CO2与NaOH是否发生反应?
为此又做了实验:
在集满CO2的软塑料瓶(如图乙)中加入适量的NaOH溶液,盖紧瓶塞振荡,发生瓶变瘪,于是认为CO2与NaOH发生了反应,小衢提出质疑,认为导致软塑料瓶变瘪的原因还有可能是 ;
(3)小科从变瘪的软塑料瓶中取出少量试液置于试管中,滴入 溶液(填一种盐),观察到有白色沉淀产生,就证明了CO2与NaOH的反应确实已经发生.
答案分析:
(1)检查装置的气密性装置气密性检验有多种方法,原理都是根据装置内外的压强差形成水柱或气泡,据此分析即可;
(2)在集满CO2的软塑料瓶(如图乙)中加入适量的NaOH溶液,盖紧瓶塞振荡,发生瓶变瘪,说明二氧化碳被吸收了,针对以上现象,有两种可能:
①认为CO2与NaOH发生了反应;②认为二氧化碳与溶于水;
(3)因为变瘪后的塑料瓶内有碳酸钠生成,所以若加入酸性溶液会有气泡生成.
解:
(1)检查装置气密性的原理都是根据装置内外的压强差形成水柱或气泡;故该装置检查气密性的方法是:
关闭止水夹(或用手指堵住导管),将试管通底部分浸入水中,再用手握试管,观察通底处是否有气泡冒出.观察到试管底部有气泡冒出,则说明装置气密性良好;
(2)在集满CO2的软塑料瓶(如图乙)中加入适量的NaOH溶液,盖紧瓶塞振荡,发生瓶变瘪,于是认为CO2与NaOH发生了反应,小衢提出质疑,认为导致软塑料瓶变瘪的原因还有可能是:
二氧化碳溶于水;
(3)CO2与NaOH的反应有碳酸钠生成,所以若加入氯化钙溶液会有白色沉淀生成,就证明了CO2与NaOH的反应确实已经发生.
故答案为:
(1)试管底部有气泡冒出;
(2)二氧化碳溶于水;
(3)氯化钙.
13、正确的实验操作是实验成功的保证,下列实验操作正确的是( )
A.B.C.D.
答案分析:
通过分析实验原理,根据实验常用仪器及实验操作注意事项作答.
解:
A、双氧水和二氧化锰制取氧气的实验装置中,长颈漏斗要伸入液面以下以防止产生的氧化从长颈漏斗逸出.故不正确;
B、过滤操作中应用玻璃棒来引流,故不正确;
C、大理石和稀盐酸反应的实验中,应先加大理石且要先将试管横放再把大理石慢慢滑落到试管里.故不正确.
D、该实验可观察到烛火自下而上依次熄灭,说明二氧化碳具有灭火性及二氧化碳的密度比空气大.故正确.
故选D.
14、在氢气还原氧化铜的实验中,进行如下操作:
①加热 ②停止加热 ③通入氢气 ④停止通入氢气.
下列操作顺序正确的是( )
A.③①④②B.①③②④C.③①②④D.①③④②
答案分析:
实验室用氢气还原氧化铜的实验步骤:
可概括为“实验开始先通氢,通氢以后再点灯,由黑变红先撤灯,试管冷却再停氢”,据此进行分析解答即可.
解:
氢气还原氧化铜的步骤为:
①先检验氢气的纯度,防止氢气不纯实验时引起爆炸;②通入氢气,排净试管内原有空气;③加热氧化铜;④观察到由黑变红时停止加热;⑤继续通氢气至试管冷却为止,防止生成的铜再次被氧化;停止反应时,先熄灭酒精灯再停止通氢.
故正确顺序为:
③①②④.
故选:
C.
15、超临界流体是物质介于气态和液态之间的新状态,目前应用最广泛的是超临界二氧化碳,它在化学工业上可取代氟利昂作溶剂等.下列有关超临界二氧化碳的说法中不正确的是( )
A.超临界二氧化碳是合成的一种新物质
B.超临界二氧化碳是由CO2分子构成的
C.超临界二氧化碳溶解某些物质后,二氧化碳可在常温常压下完全挥发
D.用超临界二氧化碳代替氟利昂,可减轻大量使用氟利昂对大气臭氧层造成的破坏
答案分析:
可以根据超临界二氧化碳的性质方面进行分析、判断,从而得出正确的结论.
解:
A、超临界二氧化碳与其气态或液态之间的转化没有新物质生成,是物理变化,故A错误;
B、超临界二氧化碳就是二氧化碳,是由CO2分子构成的,故B正确;
C、超临界二氧化碳是在特殊条件下的一种的新状态,在常温下变为二氧化碳气体,故C正确;
D、用超临界二氧化碳代替氟氯代烷可减轻对臭氧层的破坏,故D正确;
故选A
16、有三瓶无色无味的气体,分别是氧气、空气、二氧化碳,区别它们最简单的方法是( )
A.伸入燃烧的木条B.测定气体的密度
C.滴入澄清石灰水,振荡D.滴入紫色石蕊试液,振荡
答案分析:
区别空气、氧气和二氧化碳三瓶无色气体,要求根据三种气体性质差别,所设计的方案能出现三种明显不同的实验现象,达到鉴别气体的目的.
解:
A、燃着的木条分别放入瓶中,燃烧无明显变化的气体为空气;燃烧更旺的气体为氧气;燃烧熄灭的气体为二氧化碳;故正确,
B、三种气体密度不同,测三瓶气体的密度可以区别三种气体,但不是最简单方法;故错误,
C、倒入澄清石灰水,石灰水变浑浊的气体为二氧化碳,无明显现象的为空气或氧气.无法区别三种气体,故错误,
D、倒入紫色石蕊试液,使溶液变红的气体为二氧化碳,无明显现象的为空气或氧气.无法区别三种气体,故错误,
故选A.
17、 “节能减排”已经引起当今社会普遍关注.化石燃料燃烧会产生大量的CO2,大气中CO2含量过高会导致温室效应等环境问题.
(1)计算1000gCH4完全燃烧产生CO2的质量m;
(2)从下表数据分析,与煤相比,用天然气做燃料的优点是 .
1000g 物质完全燃烧产生CO2的质量
1000g 物质完全燃烧放出的热量
CH4
m
5.6×104KJ
C
3.67×103g
3.2×104KJ
答案分析:
先正确写出甲烷燃烧的方程式,根据方程式找出甲烷与二氧化碳之间的质量关系,由甲烷的质量就可以求出产生二氧化碳的质量.再由表格提供的信息进行分析比较可以得出用天然气做燃料的优点.
解:
(1)设1000gCH4完全燃烧产生CO2的质量m,则:
CH4 +2O2
CO2+2H2O
16 44
1000g m
m=2750g
答:
1000gCH4完全燃烧产生CO2的质量为2750g.
(2)天然气燃烧后产生的热量多但排放的二氧化碳少.
18、
(1)下列做法中不符合“低碳绿色生活”理念的是(填序号) .
①节约用水、用电 ②废物分类回收、利用 ③坚持每天测量空气中二氧化碳的含量④减少一次性餐具的使用
(2)任何事物都有其两面性,二氧化碳在生活、生产中也有着广泛的应用.例如:
①日常生活中做灭火剂,这是利用了二氧化碳密度比空气大和 的性质.②工业上用二氧化碳为原料制备纯碱.
(3)大气中的二氧化碳利用植物光合作用能生成氧气,请写出实验室中高锰酸钾制取氧气的化学反应方程式 .
(4)为减缓大气中二氧化碳含量的增加,以下建议可行的是 (填序号).
①开发太阳能、水能、风能等新能源;
②禁止使用煤、石油、天然气等化石燃料;
③大力植树造林,禁止乱砍滥伐.
答案分析:
(1)每天测量空气中二氧化碳的含量与“低碳绿色生活”无关;
(2)二氧化碳的密度比空气大,不能燃烧,不支持燃烧;
(3)高锰酸钾受热分解能生成锰酸钾、二氧化锰和氧气;
(4)开发新能源、植树造林等措施能够减缓大气中二氧化碳含量的增加.
解:
(1)节约用水、用电,废物分类回收、利用,减少一次性餐具的使用等措施符合“低碳绿色生活”理念.故填:
③.
(2)①日常生活中做灭火剂,这是利用了二氧化碳密度比空气大和不燃烧、不支持燃烧.故填:
不燃烧、不支持燃烧.
(3)实验室中高锰酸钾制取氧气的化学反应方程式为:
2KMnO4
K2MnO4+MnO2+O2↑.
(4)开发太阳能、水能、风能等新能源,大力植树造林,禁止乱砍滥伐等措施能够减缓大气中二氧化碳含量的增加,禁止使用煤、石油、天然气等化石燃料是不现实的.故填:
①③.
19、通过如图所示实验可以得出的结论,其中不合理的是( )
A.甲实验既可探究可燃物的燃烧条件,又可以说明白磷的着火点比红磷低,也由此可推出灭火的方法
B.乙实验既可以说明分子在不停的运动着,又可以说明浓氨水具有挥发性
C.丙实验既可以说明二氧化碳溶于水,又可以说明二氧化碳具有酸性
D.丁实验既可以说明一氧化碳具有还原性,又可以说明一氧化碳具有可燃性
答案分析:
A、根据燃烧的条件和磷的性质分析.
B、氨水具有挥发性,因为氨气分子的不停的运动;使酚酞溶液变红,说明氨水呈碱性;
C、丙实验可以说明二氧化碳易溶于水,但不可以说明二氧化碳显酸性;
D、一氧化碳既具有可燃性,又具有还原性.
解:
A、该实验中铜片上白磷燃烧而水中白磷未燃烧,说明燃烧需要与氧气接触;铜上红磷未燃烧而白磷燃烧,说明燃烧需要达到着火点且白磷着火点较低;该实验既探究可燃物的燃烧条件,又说明白磷的着火点比红磷低,并由此推出灭火的方法;故A合理;
B、该实验观察到A烧杯内酚酞变红,说明氨分子不断运动,同时也表明浓氨水具有挥发性;故B合理;
C、该实验中观察到塑料瓶会变瘪,可判断二氧化碳溶于水,因为没有指示剂的存在,所以不能说明生成碳酸;故C不合理;
D、该实验既可以说明一氧化碳具有还原性,又可以说明一氧化碳具有可燃性.合理.
故选C.
20、下列有关环境污保护的叙述中,错误的是( )
A.“温室气体”主要指CO2、CH4等能导致地球升温的气体
B.“白色污染”主要指白色粉尘对环境的污染
C.大气中的二氧化硫、二氧化氮是形成“酸雨”的主要物质
D.“绿色化学”是指对环境无负面影响的化学
答案分析:
导致“温室效应”的气体是CO2、CH4、O3 等气体;“白色污染”是人们对塑料垃圾污染环境的一种形象称谓;形成酸雨的主要气体是大气中的二氧化硫、二氧化氮;“绿色化学”是指从源头上减少和消除工业生产对环境的污染;反应物的原子全部转化为期望的最终产物.
解:
A、导致“温室效应”的气体是CO2、CH4、O3 等气体,所以A说法正确;
B、“白色污染”是人们对塑料垃圾污染环境的一种形象称谓,所以B说法不正确;
C、形成“酸雨”的主要气体是大气中的二氧化硫、二氧化氮,所以C说法正确;
D、“绿色化学”是指从源头上减少和消除工业生产对环境的污染;反应物的原子全部转化为期望的最终产物,所以D说法正确.
故选B.
21、我国劳动人民早在五千年前就会使用木炭炼铜。
在化学实验室里模拟炼铜,既可用传统的实验装置(见图甲),又能用改进的微型实验装置(见图乙)。
化学兴趣小组采用图乙装置,开展以下探究活动。
(1)写出木炭与CuO反应的化学方程式:
,失去氧原子的物质是 ,发生了 反应。
氧化剂还原剂都属于 物(反应物或生成物)。
(2)判断木炭与CuO已经发生化学反应的依据是 。
(3)使用图乙装置与使用图甲装置相比,其优点是 (写出1条即可)。
(4)用甲装置进行实验,完毕后先停止加热,可能会引起的后果是 。
(5)澄清石灰水中含有的氢氧化钙属于 (填酸、碱、盐或氧化物),澄清石灰水也参与了化学反应,在反应中逐渐变成了 (填溶液、乳浊液或悬浊液)。
答案
(1)(4分)C+2CuO
2Cu+CO2↑ CuO 还原 反应物
(2)(1分)黑色固体中逐渐有红色固体产生,澄清的石灰水变浑浊
(3)(1分)操作简单(或现象明显、节约药品、反应条件容易达到、反应速率快等)
(4)(1分)液体倒流,引起试管爆裂
(5)(2分)碱 悬浊液
22、归纳总结是学习化学的一种方法。
某同学发现X、Y、Z三种物质有如右图所示的循环转化关系,“→”表示能转化。
(1)若X、Y、Z均为含钙化合物,X是一种常用干燥剂,Y俗称熟石
灰.则X的化学式为