化学铁及其化合物推断题的专项培优练习题及答案解析.docx
《化学铁及其化合物推断题的专项培优练习题及答案解析.docx》由会员分享,可在线阅读,更多相关《化学铁及其化合物推断题的专项培优练习题及答案解析.docx(15页珍藏版)》请在冰豆网上搜索。
化学铁及其化合物推断题的专项培优练习题及答案解析
2020-2021化学铁及其化合物推断题的专项培优练习题及答案解析
一、铁及其化合物
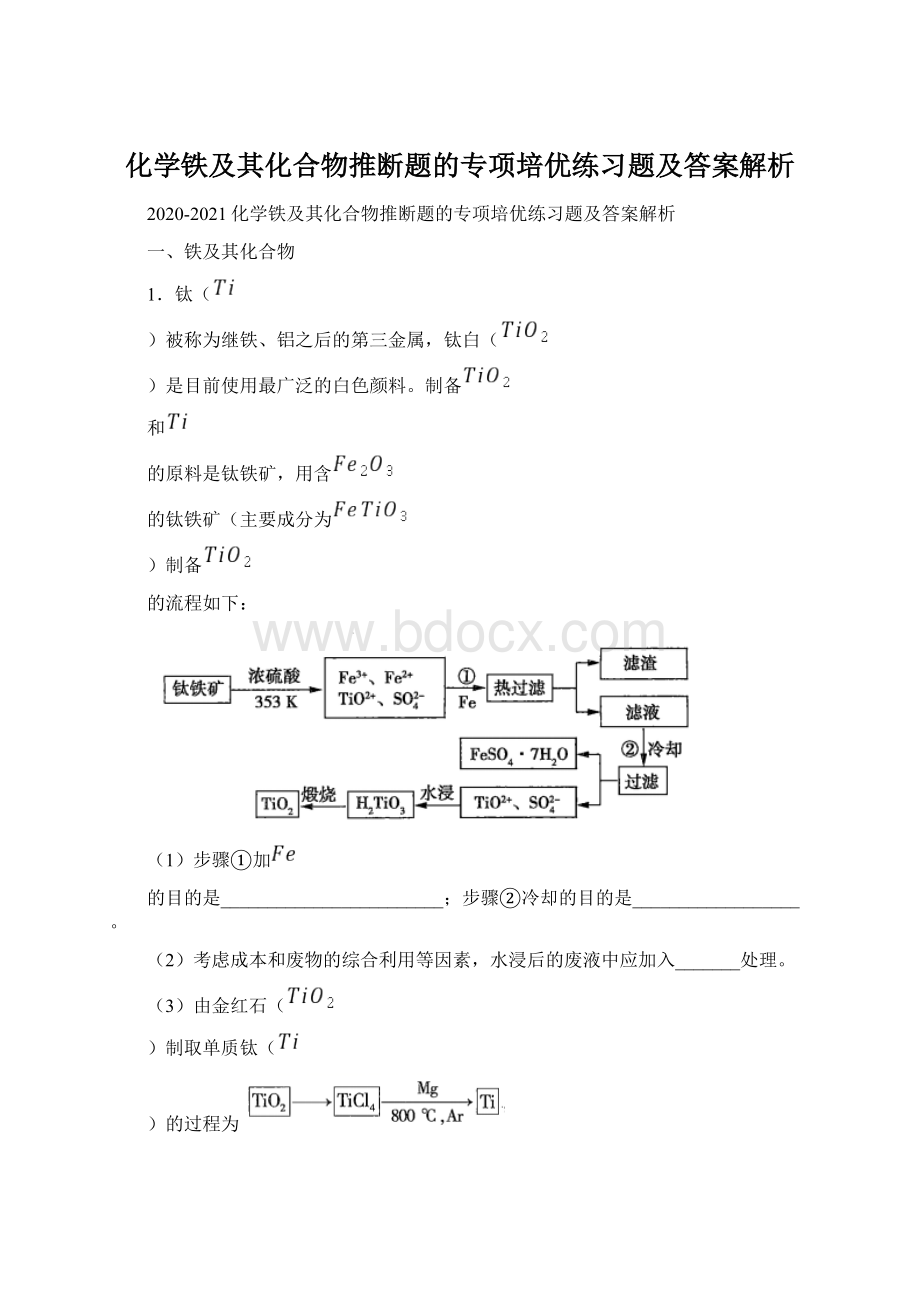
1.钛(
)被称为继铁、铝之后的第三金属,钛白(
)是目前使用最广泛的白色颜料。
制备
和
的原料是钛铁矿,用含
的钛铁矿(主要成分为
)制备
的流程如下:
(1)步骤①加
的目的是________________________;步骤②冷却的目的是__________________。
(2)考虑成本和废物的综合利用等因素,水浸后的废液中应加入_______处理。
(3)由金红石(
)制取单质钛(
)的过程为
,其中反应
在氩气气氛中进行的理由是______________________________。
【答案】将
还原为
析出绿矾(
)生石灰(或碳酸钙、碱)高温下镁或钛与
、
等反应
【解析】
【分析】
根据钛铁矿中
、
与浓硫酸反应的溶液中加入铁粉、过滤后,滤液冷却得到硫酸亚铁晶体推知,铁粉与铁离子发生反应得到亚铁离子。
水浸后的溶液成酸性。
【详解】
(1)分析题图可知,钛铁矿中的铁最终转化成副产品绿矾,所以要将+3价
转化为+2价
;降低温度,减小了
的溶解度,有利于绿矶结晶析出。
(2)水浸过程发生的离子反应为
,废液呈酸性,所以处理水浸后的废液应加入
、
或碱。
(3)由于
和
易与空气中的
、
等反应,故该反应应在氩气气氛中进行。
2.印刷电路板(PCB)是用腐蚀液(FeCl3溶液)将覆铜板上的部分铜腐蚀掉而制得。
一种制作PCB并将腐蚀后废液(其中金属阳离子主要含Fe3+、Cu2+、Fe2+)回收再生的流程如图。
请回答:
(1)腐蚀池中发生反应的化学方程式是__。
(2)上述各池中,没有发生化学变化的是__池。
(3)由置换池中得到固体的操作名称是__。
(4)置换池中发生反应的离子方程式有__。
(5)请提出利用酸从固体中回收Cu并将滤液回收利用的合理方案:
__。
(6)向再生池中通入Cl2也可以使废液再生,相比Cl2,用双氧水的优点是__。
【答案】Cu+2FeCl3=CuCl2+2FeCl2沉降过滤Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu用盐酸溶解固体中的Fe,过滤后得到Cu,并将滤液加入再生池避免有毒气体污染环境
【解析】
【分析】
腐蚀液(FeCl3溶液)将覆铜板上,发生反应为:
Cu+2FeCl3=CuCl2+2FeCl2,再在沉降池中沉降后加入铁粉置换出铜单质、以及铁与铁离子反应生成亚铁离子,再生池中主要指FeCl2,通入过氧化氢氧化生成FeCl3,循环利用。
【详解】
(1)腐蚀液(FeCl3溶液)将覆铜板上腐蚀池中发生反应的化学方程式为:
Cu+2FeCl3=CuCl2+2FeCl2;
(2)腐蚀池中发生:
Cu+2FeCl3=CuCl2+2FeCl2;置换池中铁粉置换出铜、以及铁与铁离子反应生成亚铁离子,再生池中过氧化氢氧化FeCl2,没有发生化学变化的是沉降池;
(3)置换池中铁粉置换出铜,固液分离的操作为过滤;
(4)置换池中铁粉置换出铜、以及铁与铁离子反应生成亚铁离子,其离子反应方程式:
Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu;
(5)根据金属活动性顺序表可知,铁能与稀盐酸发生反应,而铜不与稀盐酸反应,所以用盐酸溶解固体中的Fe,过滤后得到Cu,并将滤液加入再生池;
(6)Cl2有毒,污染环境,需要尾气处理,加双氧水氧化后生成水,避免有毒气体污染环境,故答案为:
避免有毒气体污染环境。
3.某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如下图所示:
已知①A、B、C、D、G含有同种元素。
②
纯A(单质)
B溶液
D固体
G溶液
颜色
银白色
黄色
红棕色
浅绿色
③E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,也能将一种氧化物氧化为F,F是含有三种元素的化合物,与A反应生成E、G。
依据以上信息填空:
(1)写出D的化学式:
___________________________________________。
(2)G生成C的过程中所出现的现象为_________________________。
(3)写出反应A→B的化学方程式:
_________________________________。
(4)B→F的离子方程式为________;G与次氯酸反应的离子方程式为________________________________。
【答案】Fe2O3先产生白色沉淀,迅速变为灰绿色,最后变为红褐色2Fe+3Cl2
2FeCl32Fe3++SO2+2H2O=2Fe2++SO42-+4H+H++2Fe2++HClO=2Fe3++Cl-+H2O
【解析】
【分析】
结合框图,D固体呈红棕色,则其为Fe2O3;A、B、C、D、G含有同种元素,B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,则B为FeCl3,G中含有Fe2+,A为Fe。
由“B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,也能将一种氧化物氧化为F,F是含有三种元素的化合物,与A反应生成E、G”,则F为H2SO4,G为FeSO4;E是通常情况下密度最小的气体,则E为H2。
由B→C→D的转化可推知,C为Fe(OH)3。
【详解】
(1)由以上分析可知,D为氧化铁,其化学式:
Fe2O3。
答案为:
Fe2O3;
(2)FeSO4生成Fe(OH)3,可先加碱、后氧化,所出现的现象为先产生白色沉淀,迅速变为灰绿色,最后变为红褐色。
答案为:
先产生白色沉淀,迅速变为灰绿色,最后变为红褐色;
(3)反应Fe→FeCl3需用Cl2将Fe氧化,反应方程式为2Fe+3Cl2
2FeCl3。
答案为:
2Fe+3Cl2
2FeCl3;
(4)FeCl3→H2SO4,应使用SO2,离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;FeSO4与次氯酸反应,生成Fe3+、Cl-和H+,离子方程式为H++2Fe2++HClO=2Fe3++Cl-+H2O。
答案为:
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;H++2Fe2++HClO=2Fe3++Cl-+H2O。
【点睛】
利用框图进行物质推断时,先确定信息充足的物质,然后利用已知的少量信息、反应条件及未知物质前后的已知物质,推断出未知物质的组成。
4.A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应。
(1)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是__________。
(2)若B、C、F都是气态单质,且B有毒,③的反应中还有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,则A、D反应产物的电子式是________,反应③的化学方程式是____。
(3)若A、D、F都是短周期元素组成的非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是________。
【答案】2Fe2++Cl2=2Fe3++2Cl-
4NH3+5O2
4NO+6H2O2C+SiO2
2CO↑+Si
【解析】
(1).A是常见的金属单质,D、F是气态单质,反应①为置换反应且在水溶液中进行,由转化关系可知,A为变价金属,F具有强氧化性,则A为Fe,F为Cl2、B为HCl、C为氯化亚铁、D为氢气、E为氯化铁,反应②(在水溶液中进行)的离子方程式是:
2Fe2++Cl2=2Fe3++2Cl-,故答案为:
2Fe2++Cl2=2Fe3++2Cl-;
(2).B、C、F都是气态单质,B有毒,则B为氯气,反应②需要放电条件才能发生,为氮气与氧气反应,③反应中有水生成,可以推知C为N2,F为O2,E为NO,A为NH3,反应①为置换反应,A、D相遇有白烟生成,可推知D为HCl,A与D反应产物为氯化铵,电子式为
,反应③的化学方程式是:
4NH3+5O2
4NO+6H2O,故答案为:
;4NH3+5O2
4NO+6H2O;
(3).A、D、F都是短周期元素组成的非金属单质,且A、D所含元素同主族,A、F所含元素同周期,反应①为置换反应,考虑是碳与二氧化硅反应生成硅与CO,碳与F反应生成E,CO与F生成E,则F为氧气,通过验证符合图示转化关系,则反应①的化学方程式是2C+SiO2
2CO↑+Si,故答案为:
2C+SiO2
2CO↑+Si。
5.钾、钠、镁、铁均能与水发生置换H2的反应。
(1)其中反应最剧烈的是____。
(2)其中铁与水的反应比较特殊。
其特殊性在于:
①_________;②产物为氧化物而非氢氧化物。
你对②和①的关联性作何解释?
__________
(3)证明②的氧化物含Fe3+必需的试剂是______。
【答案】钾反应需在高温条件下进行铁的氢氧化物在高温条件下会分解稀硫酸(或稀盐酸)、KCNS试液
【解析】
【分析】
(1)根据金属的活泼性分析判断;
(2)①根据铁与水的反应条件分析;②根据高温下铁的氢氧化物的稳定性分析解答;
(3)需要将Fe的氧化物转化为溶于水的离子,再检验。
【详解】
(1)金属的活泼性越强,与水反应越剧烈,活泼性:
K>Na>Mg>Fe,所以与水发生置换H2反应最剧烈的是钾,故答案为:
钾;
(2)①铁与水蒸气的反应,需要在高温条件下反应才能发生,故答案为:
反应需在高温条件下进行;
②铁的氢氧化物不稳定受热易分解,所以高温下铁的氢氧化物会分解生成四氧化三铁,因此产物为氧化物而非氢氧化物,故答案为:
铁的氢氧化物在高温条件下会分解;
(3)四氧化三铁难溶于水,需要用HCl(或稀硫酸)溶解生成Fe3+,Fe3+遇到KCNS试液,溶于变红色,故答案为:
稀硫酸(或稀盐酸)、KCNS试液。
6.粉煤灰是燃煤产生的工业固体废料,主要成分有Al2O3、SiO2,还含有少量Fe2O3、CaO等。
采用酸碱联合的方法从粉煤灰中综合回收氧化铝及二氧化硅的工艺流程如下:
硫酸熟化过程中发生的反应有:
Al2O3∙2SiO2+3H2SO4=Al(SO4)3+2SiO2+3H2O
3Al2O3∙2SiO2+9H2SO4=3Al2(SO4)3+2SiO2+9H2O
(1)“结晶”操作:
缓缓加热,浓缩至______,放置冷却,得到Al2(SO4)3∙18H2O。
(2)Al2(SO4)3∙18H2O在250~300℃下失重40.5%得Al2(SO4)∙xH2O,x=______。
(3)“还原焙烧”过程中发生反应的化学方程式为_________。
(4)设计实验检验粗氧化铝中是否含有Fe2O3:
__________。
(5)向硅酸钠溶液中通入过量CO2制备白炭黑的化学方程式为___________。
(6)粗氧化铝制备冶金级氧化铝过程中发生反应[Al(OH)4]-+CO2=Al(OH)3↓+HCO3-,该反应的平衡常数为_______[已知Al(OH)3+H2O
[Al(OH)4]-+H+K1=4×10-13;H2CO3
H2O+CO2K2=600;Kal(H2CO3)=4.2×10-7、Ka2(H2CO3)=5.6×10-11]。
【答案】表面出现结晶薄膜32Al2(SO4)3+3C
2Al2O3+3CO2↑+6SO2↑取粗氧化铝少许于试管中加稀硫酸溶解,静置,滴加KSCN溶液,若溶液变红,则粗氧化铝中含有Fe2O3杂质Na2SiO3+2CO2+(n+1)H2O=2NaHCO3+SiO2∙nH2O↓1.75×103
【解析】
【分析】
粉煤灰主要成分有Al2O3、SiO2,还含有少量Fe2O3、CaO等,加入浓硫酸反应生成硫酸铝,水浸主要得到SiO2高硅渣,滤液经过结晶脱水得到硫酸铝,硫酸铝与焦炭反应生成粗氧化铝,验证粗氧化铝是否含有氧化铁,先将物质溶于稀硫酸后加KSCN溶液,观察现象;向硅酸钠溶液中通入足量二氧化碳反应生成碳酸氢钠和白炭黑SiO2∙nH2O。
【详解】
(1)“结晶”操作:
缓缓加热,浓缩至表面出现结晶薄膜,放置冷却,得到Al2(SO4)3∙18H2O;故答案为:
表面出现结晶薄膜。
(2)假设100gAl2(SO4)3∙18H2O在250~300℃下失重40.5%,剩余100g×(1−40.5%)=59.5gAl2(SO4)∙xH2O,
,解得x=3;故答案为:
3。
(3)根据“还原焙烧”产物之一经过烟气制酸,硫酸铝和碳“还原焙烧”生成氧化铝、二氧化碳和二氧化硫,发生反应的化学方程式为2Al2(SO4)3+3C
2Al2O3+3CO2↑+6SO2↑;故答案为:
2Al2(SO4)3+3C
2Al2O3+3CO2↑+6SO2↑。
(4)实验检验粗氧化铝中是否含有Fe2O3,将粗品溶于稀硫酸中,利用生成的铁离子与KSCN溶液反应是否有红色物质生成;故答案为:
取粗氧化铝少许于试管中加稀硫酸溶解,静置,滴加KSCN溶液,若溶液变红,则粗氧化铝中含有Fe2O3杂质。
(5)向硅酸钠溶液中通入过量CO2生成碳酸氢钠和白炭黑SiO2∙nH2O,其化学方程式为Na2SiO3+2CO2+(n+1)H2O=2NaHCO3+SiO2∙nH2O↓;故答案为:
Na2SiO3+2CO2+(n+1)H2O=2NaHCO3+SiO2∙nH2O↓。
(6)①Al(OH)3+H2O
[Al(OH)4]-+H+,②H2CO3
H2O+CO2,③H2CO3
HCO3-+H+,根据盖斯定律③−①−②得到[Al(OH)4]-+CO2=Al(OH)3↓+HCO3-,方程式相减,平衡常数相除,因此[Al(OH)4]-+CO2=Al(OH)3↓+HCO3-平衡常数为
;故答案为:
1.75×103。
7.2019年诺贝尔化学奖颁给了为锂电池发展作出突出贡献的三位科学家。
某废旧锂电池正极主要由LiFePO4、铝箔、炭黑等组成,Fe、Li、P具有极高的回收价值,具体流程如下:
(1)过程ⅰ生成NaAlO2溶液的离子方程式是__。
(2)过程ⅱ中HCl/H2O2的作用是__。
(3)浸出液X的主要成分为Li+、Fe3+、H2PO4-等。
过程ⅲ控制碳酸钠溶液浓度20%、温度85℃、反应时间3h条件下,探究pH对磷酸铁沉淀的影响,如图所示。
①综合考虑铁和磷沉淀率,最佳pH为__。
②结合平衡移动原理,解释过程ⅲ中pH增大,铁和磷沉淀率增大的原因__。
③当pH>2.5后,随pH增加,磷沉淀率出现了减小的趋势,解释其原因__。
(4)LiFePO4可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应制取,共沉淀反应的化学方程式为__。
【答案】2Al+2OH-+2H2O=2AlO2-+3H2↑溶解LiFePO4,将Fe2+氧化为Fe3+(2Fe2++H2O2+2H+=2Fe3++2H2O)2.5H2PO4-
HPO42-+H+,HPO42-
PO43-+H+,加入Na2CO3后,CO32-结合H+使c(H+)减小,促进上述电离平衡正向移动,c(PO43−)增大,与Fe3+结合形成磷酸铁沉淀(或者:
H2PO4-
HPO42-+H+,HPO42-
PO43-+H+,溶液pH增大,c(H+)减小,促进上述电离平衡正向移动,c(PO43-)增大,与Fe3+结合形成磷酸铁沉淀pH>2.5时,沉淀中的磷酸铁会有部分开始转变生成Fe(OH)3,使得部分PO43-释放,导致磷沉淀率下降(NH4)2Fe(SO4)2+H3PO4+LiOH=2NH4HSO4+LiFePO4↓+H2O或(NH4)2Fe(SO4)2+H3PO4+3LiOH=(NH4)2SO4+Li2SO4+LiFePO4↓+3H2O
【解析】
【分析】
含LiFePO4、铝箔、炭黑的废旧锂电池,用NaOH溶解后过滤,滤液为NaAlO2溶液,滤渣为LiFePO4和炭黑,再用盐酸酸化的H2O2溶解滤渣并过滤,得到主要成分为Li+、Fe3+、H2PO4-等的溶液X,向X中加入Na2CO3溶液,有FePO4•2H2O析出,过滤的滤液主要是LiCl,再加入饱和Na2CO3溶液,再过滤即可得到LiCO3粗产品,据此分析解题。
【详解】
(1)过程ⅰAl溶于NaOH溶液生成NaAlO2和H2,发生反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)过程ⅱ是除铝后料中加入盐酸酸化的H2O2,过滤后得到主要成分为Li+、Fe3+、H2PO4-等的溶液X,由知HCl/H2O2的作用是溶解LiFePO4,将Fe2+氧化为Fe3+;
(3)①分析图中数据可知,当pH=2.5时磷的沉淀率最高,铁的沉淀率较高,则过程ⅲ选择的最佳pH为2.5;
②已知溶液X中存在H2PO4-的电离平衡,即H2PO4-
HPO42-+H+,HPO42-
PO43-+H+,过程ⅲ中当加入Na2CO3后,CO32-结合H+使c(H+)减小,促进上述电离平衡正向移动,c(PO43−)增大,与Fe3+结合形成磷酸铁沉淀,提高了铁和磷沉淀率;
③已知FePO4(s)
Fe3+(aq)+PO43-(aq),当pH>2.5后,随pH增加,溶液中c(OH-)增大,Fe3+开始转变生成Fe(OH)3,促进溶解平衡正向移动,使得部分PO43-释放,导致磷沉淀率下降;
(4)(NH4)2Fe(SO4)2、H3PO4与LiOH溶液混合生成LiFePO4,同时得到(NH4)2SO4和Li2SO4,结合原子守恒,发生反应的化学方程式为(NH4)2Fe(SO4)2+H3PO4+LiOH=2NH4HSO4+LiFePO4↓+H2O。
8.以粉煤灰(主要含3Al2O3·2SiO2、SiO2,还含有少量CaO、Fe2O3等物质)为原料制取Al2O3的流程如图:
(1)当(NH4)2SO4和3Al2O3·2SiO2的配比a(a=
)不同时,“焙烧”后所得产物的X射线衍射谱图如图所示(X射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。
由图可知,当a=___时,3Al2O3·2SiO2的利用率最高。
(2)“沉淀、过滤”所得滤渣为Fe(OH)3和Al(OH)3,生成Fe(OH)3的离子反应方程式为___。
(3)“碱浸”加入NaOH发生反应的离子方程式为___。
(4)“水解、过滤”可得到Al(OH)3沉淀,升高温度有利于水解的原因是___。
该步骤可将加水改成通入过量的___气体。
(5)流程中,可以回收并循坏利用的物质除NH3外,还有___和___。
【答案】8Fe3++3NH3+3H2O=Fe(OH)3↓+3NH4+OH-+Al(OH)3=AlO2-+2H2O水解为吸热反应,升高温度有利于平衡正向进行CO2NaOH(NH4)2SO4
【解析】
【分析】
粉煤灰、(NH4)2SO4进行灼烧处理,把3Al2O3·2SiO2转化为NH4Al(SO4)2,且当(NH4)2SO4和3Al2O3·2SiO2的配比a(a=
)不同时各产物含量不同,如图a=8时,体系中NH4Al(SO4)2含量最高,此时3Al2O3·2SiO2的利用也率最高。
加硫酸进行酸浸,过滤,滤液中含有Al3+、Fe3+以及其他可溶性离子,通入氨气生成沉淀Al(OH)3和Fe(OH)3,滤液Ⅰ为(NH4)2SO4,加入氢氧化钠进行碱浸取过滤,滤渣为Fe(OH)3滤液Ⅱ为NaOH和NaAlO2,加水水解得到Al(OH)3沉淀,煅烧得氧化铝。
【详解】
(1)根据分析,当(NH4)2SO4和3Al2O3·2SiO2的配比a=8时,体系中NH4Al(SO4)2含量最高,此时3Al2O3·2SiO2的利用也率最高。
(2)通入氨气“沉淀、过滤”所得滤渣为Fe(OH)3和Al(OH)3,生成Fe(OH)3离子反应方程式:
Fe3++3NH3+3H2O=Fe(OH)3↓+3NH4+;
(3)根据分析,“碱浸”加入NaOH发生反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O;
(4)“水解、过滤”可得到Al(OH)3沉淀,水解过程是吸热的,升高温度促进AlO2-水解;该步骤可将加水改成通入过量的酸性气体二氧化碳(CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓);
(5)流程中,滤液Ⅰ为(NH4)2SO4,滤液Ⅱ含有NaOH,故可以回收并循坏利用的物质除NH3外,还有(NH4)2SO4和NaOH。
【点睛】
氢氧化铝是两性氢氧化物,遇强酸强碱发生反应而溶解,不与弱酸弱碱反应。
氢氧化铝的制备:
1.向氯化铝溶液中通过量氨气;2.向偏铝酸钠中通入过量的二氧化碳;3.氯化铝和偏铝酸钠发生双水解。
9.富铁铝土矿(主要含有A12O3、Fe2O3、FeO和SiO2)可用于制备净水剂明矾KAl(SO4)2·12H2O和补血剂FeSO4·7H2O。
工艺流程如下(部分操作和产物略去):
(1)操作1的名称是___________。
(2
)反应①②③④中是氧化还原反应的是_______(填写编号)。
(3)综合考虑,金属X最好选择的试剂是__,写出该反应的离子方程式_______。
(4)反应①的离子方程式是_________、__________。
(5)溶液D中含有的金属阳离子是_______,检验方法是________。
(6)用含铝元素27℅的上述矿石10吨,通过上述流程最多生产明矾____吨。
【答案】过滤④FeFe+2Fe3+=3Fe2+SiO2+2OH-=SiO32-+H2OAl2O3+2OH-=2AlO2-+H2OFe2+取少量溶液D于试管中,滴入硫氰化钾溶液,若无明显变化,再滴入几滴氯水,若溶液变红,证明含有Fe2+47.4
【解析】
【分析】
由流程可知,富铁铝土矿用氢氧化钾溶液浸取后过滤,滤渣为氧化铁,滤液中含有硅酸钾和偏铝酸钾;向滤液中加入足量的硫酸,可以得到硅酸沉淀和硫酸铝、硫酸钾溶液,结晶后得到明矾;滤渣经硫酸溶解后可以得到硫酸铁溶液,加入铁粉后得到硫酸亚铁溶液,用结晶法可以得到绿矾。
【详解】
(1)操作I得到溶液和滤渣,因此操作I为过滤;
(2)反应①中加入NaOH溶液,根据成分只有Al2O2和SiO2与NaOH反应,发生Al2O3+2OH-=2AlO2-+H2O,SiO2+OH-=SiO32-+H2O,不属于氧化还原反应,反应②中加入硫酸,发生的SiO32-+2H+=H2SiO3↓,AlO2-+4H+=Al3++2H2O,没有化合价的改变,不属于氧化还原反应,反应③发生Fe2O3+6H+=2Fe3++3H2O,FeO+2H+=Fe2++H2O,没有化合价的改变,不属于氧化还原反应,根据操作4得到FeSO4·7H2O,说明反应④中加入一种金属,把Fe3+转化成Fe2+,即这种金属是铁单质,离子方程式为Fe+2Fe3+=3Fe2+,存在化合价的变化,属于氧化还原反应;
(3)操作4得到FeSO4·7H2O,不能引入新杂质,因此此金属为Fe,离子方程式为:
Fe+2Fe3+=3Fe2+;
(4)根据
(1)的分析,离子方程式为Al2O3+2OH-=2AlO2-+H2O,SiO2+OH-=SiO32-+H2O;
(5)根据(3)的分析,溶液D中含有的金属阳离子是Fe2+,利用Fe2+的还原性,具体操作是:
取少量溶液D于试管中,滴入硫氰化钾溶液,若无明显变化,再滴入