备战高考化学氧化还原反应大题培优及答案.docx
《备战高考化学氧化还原反应大题培优及答案.docx》由会员分享,可在线阅读,更多相关《备战高考化学氧化还原反应大题培优及答案.docx(31页珍藏版)》请在冰豆网上搜索。
备战高考化学氧化还原反应大题培优及答案
备战高考化学氧化还原反应(大题培优)及答案
一、高中化学氧化还原反应
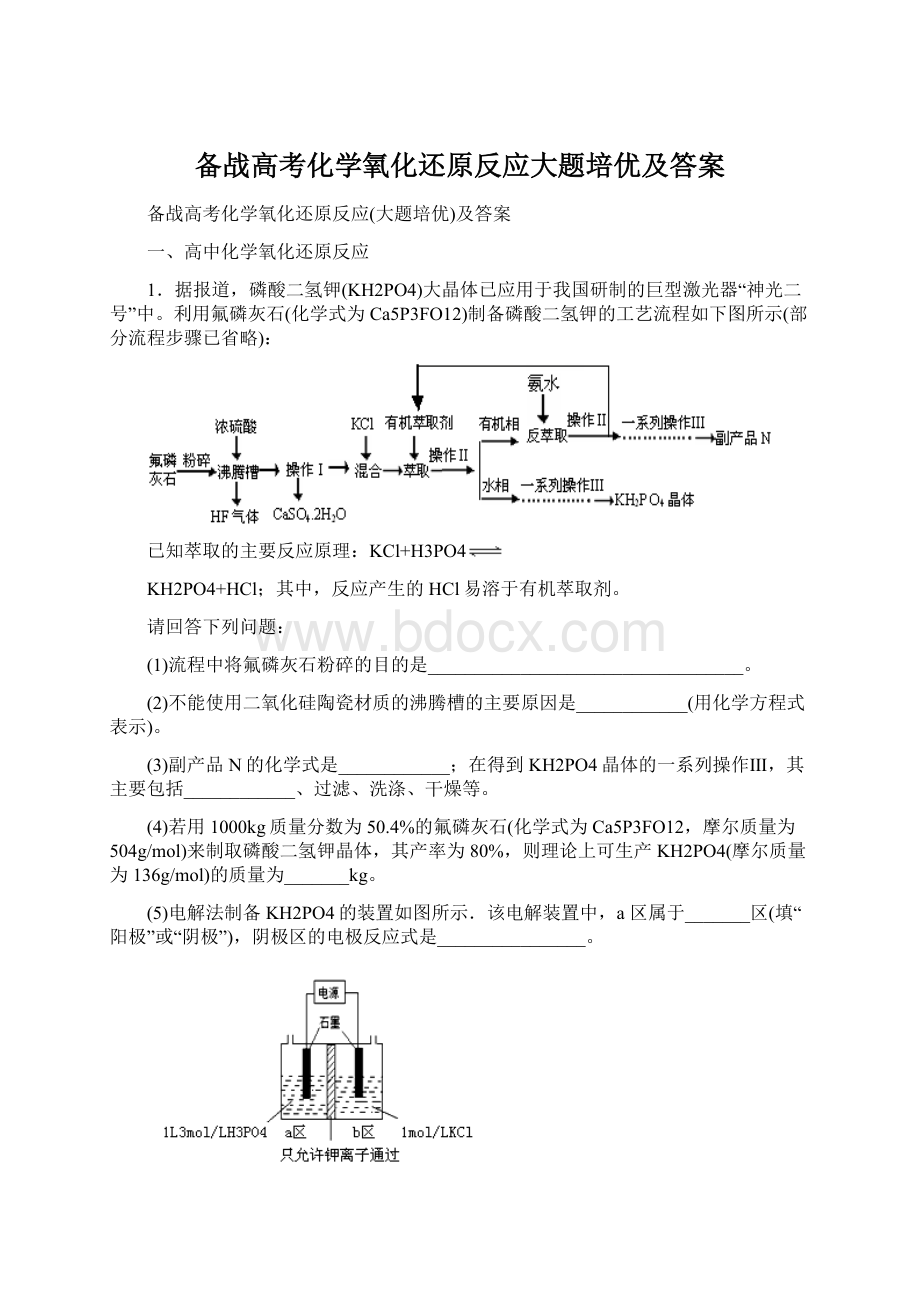
1.据报道,磷酸二氢钾(KH2PO4)大晶体已应用于我国研制的巨型激光器“神光二号”中。
利用氟磷灰石(化学式为Ca5P3FO12)制备磷酸二氢钾的工艺流程如下图所示(部分流程步骤已省略):
已知萃取的主要反应原理:
KCl+H3PO4
KH2PO4+HCl;其中,反应产生的HCl易溶于有机萃取剂。
请回答下列问题:
(1)流程中将氟磷灰石粉碎的目的是__________________________________。
(2)不能使用二氧化硅陶瓷材质的沸腾槽的主要原因是____________(用化学方程式表示)。
(3)副产品N的化学式是____________;在得到KH2PO4晶体的一系列操作Ⅲ,其主要包括____________、过滤、洗涤、干燥等。
(4)若用1000kg质量分数为50.4%的氟磷灰石(化学式为Ca5P3FO12,摩尔质量为504g/mol)来制取磷酸二氢钾晶体,其产率为80%,则理论上可生产KH2PO4(摩尔质量为136g/mol)的质量为_______kg。
(5)电解法制备KH2PO4的装置如图所示.该电解装置中,a区属于_______区(填“阳极”或“阴极”),阴极区的电极反应式是________________。
(6)工业上还可以用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,同时逸出SiF4和CO,该反应的化学方程式为________________________________________。
【答案】增大氟磷灰石与稀硫酸反应的接触面积,加快化学反应速率4HF+SiO2═SiF4↑+2H2ONH4Cl蒸发浓缩、冷却结晶326.4kg阴极2H++2e-=H2↑4Ca5P3FO12+21SiO2+30C
20CaSiO3+3P4+SiF4↑+30CO↑
【解析】
【分析】
氟磷灰石(化学式为Ca5P3FO12)粉碎后加入浓硫酸,反应生成氢氟酸、硫酸钙、磷酸等,加入氯化钾后用有机萃取剂,KCl+H3PO4
KH2PO4+HCl,反应产生的HCl易溶于有机萃取剂,有机相中含有氯化氢,加入氨水反应生成氯化铵,因此副产品主要为氯化铵,水相中含有KH2PO4,经过一系列操作得到KH2PO4晶体。
【详解】
(1)流程中将氟磷灰石粉碎,可以增大氟磷灰石与稀硫酸反应的接触面积,加快化学反应速率,故答案为增大氟磷灰石与稀硫酸反应的接触面积,加快化学反应速率;
(2)根据流程图,反应中生成了氢氟酸,氢氟酸能够与二氧化硅反应,因此不能使用二氧化硅陶瓷材质的沸腾槽,故答案为4HF+SiO2═SiF4↑+2H2O;
(3)根据上述分析,副产品N的化学式为NH4Cl;在得到KH2PO4晶体的一系列操作Ⅲ为蒸发浓缩、冷却结晶、过滤、洗涤、干燥等,故答案为NH4Cl;蒸发浓缩、冷却结晶;
(4)1000kg质量分数为50.4%的氟磷灰石(化学式为Ca5P3FO12)中含有Ca5P3FO12的质量为504kg,根据P元素守恒,理论上可生产KH2PO4的质量为504kg×80%×
÷
=326.4kg,故答案为326.4kg;
(5)根据图示,应该在a区生成KH2PO4,则钾离子由b区移向a区,则a区属于阴极区;阴极上氢离子放电生成氢气,电极反应式为2H++2e-=H2↑,故答案为阴极;2H++2e-=H2↑;
(6)用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,同时逸出SiF4和CO,反应的化学方程式为4Ca5P3FO12+21SiO2+30C
20CaSiO3+3P4+SiF4↑+30CO↑,故答案为4Ca5P3FO12+21SiO2+30C
20CaSiO3+3P4+SiF4↑+30CO↑。
2.
(1)已知草酸(H2C2O4)分解的化学方程式为:
H2C2O4
CO↑+CO2↑+H2O,下列装置中,可用作草酸分解制取气体的是__________(填序号)
(2)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。
①、为得到干燥、纯净的CO气,洗气瓶A、B中盛放的试剂分别是_______、________。
②、在点燃C处酒精灯之前,应先持续通入一段时间的混合气体,其目的是______________________
③、准确称量样品的质量20.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为16.64g,D中浓硫酸增重1.44g,则n=______。
④、在本实验中,下列情况会使测定结果n偏大的是____(填字母)
a.缺少装置Ab.缺少装置Bc.反应后固体是铁和少量Fe2O3·nH2O
【答案】④NaOH溶液浓硫酸排除装置中的空气,防止CO中混有空气而在加热时发生爆炸2b
【解析】
【详解】
(1)该反应的反应物是液体,反应条件是加热,应选择固液反应且需要加热的装置,所以选④.
(2)①为得到干燥、纯净的CO气,应先除去混合气体中的二氧化碳,用氢氧化钠吸收即可;混合气体通入氢氧化钠溶液时会带走水蒸气,为除去水蒸气,选用浓硫酸洗气。
②装置中含有空气,CO中混有空气加热时可能发生爆炸,所以要通入混合气体一段时间,排除装置中的空气。
③由题意知,固体质量减少的量为水和氧的量,浓硫酸吸收的量为水,反应方程式为:
Fe2O3.nH2O+3CO=Fe+3CO2+nH2O固体质量减少量
18ng(18n+48)g
1.44g20.00g-16.64g
所以18ng:
1.44g=(18n+48)g:
(20.00g-16.64g)
解得n=2。
④a、缺少装置A,未除去CO2,可能影响CO还原氧化物,固体质量差变小,导致所测n值偏小,错误;b、缺少洗气瓶B会导致装置E增重的质量偏大,所以测定结果n偏大,正确;c、反应后固体是铁和少量Fe2O3•nH2O,固体减少的质量偏小,导致所测n值偏小,错误。
3.过氧硫酸氢钾复合盐(K2SO4•KHSO4•2KHSO5)易分解,可用作漂白剂、NOx和SO2等的脱除剂。
某研究小组制备过氧硫酸氢钾复合盐的流程如图所示。
已知:
浓硫酸与H2O2反应,部分转化为过硫酸(化学式为H2SO5,是一种一元强酸)
(1)H2SO5中硫元素的化合价为+6价,其中过氧键的数目为________;工业上用过氧硫酸氢钾复合盐溶液脱除NO时,反应的离子方程式为___________________________。
(2)若反应物的量一定,在上述流程的“转化”步骤中需用冰水浴冷却,且缓慢加入浓硫酸,其目的是___________________________。
(3)“结晶”操作中,加入K2CO3即可获得过氧硫酸氢钾复合盐晶体,该过程的化学方程式为______________________________。
过氧硫酸氢钾复合盐产率(以产品含氧量表示)随溶液pH和温度的变化关系如图所示,则该过程适宜的条件是_________________。
(4)产品中KHSO5含量的测定:
取1.000g产品于锥形瓶中,用适量蒸馏水溶解,加入5mL5%的硫酸和5mL25%的KI溶液,再加入1mL淀粉溶液作指示剂,用0.2000mol·L-1硫代硫酸钠标准液滴定至终点,消耗标准液的体积为25.00mL。
已知:
2KHSO5+4KI+H2SO4=2I2+3K2SO4+2H2OI2+2Na2S2O3=Na2S4O6+2NaI
①用_____滴定管盛装标准浓度的硫代硫酸钠溶液(填“甲”或“乙”)。
②产品中KHSO5的质量分数为___________。
【答案】13HSO5-+2NO+H2O=3SO42-+2NO3-+5H+防止浓硫酸与H2O2溶液混合时放出大量热使H2O2分解5K2CO3+4H2SO5+4H2SO4=2(K2SO4•KHSO4•2KHSO5)↓+5CO2↑+5H2O控制pH在2.0~2.5之间,温度在0℃左右乙38.00%
【解析】
【详解】
(1)H2SO5中硫元素的化合价为+6价,依据化合价的代数和为0计算,有2个氧原子显-1价,所以过氧键的数目为1。
答案为1;
工业上用过氧硫酸氢钾复合盐溶液脱除NO时,反应的离子方程式为3HSO5-+2NO+H2O=3SO42-+2NO3-+5H+。
答案为3HSO5-+2NO+H2O=3SO42-+2NO3-+5H+
(2)在“转化”步骤中,30%的H2O2溶液加入98%的浓硫酸中,相当于浓硫酸稀释,会放出大量的热,而H2O2受热易分解,所以需用冰水浴冷却,且缓慢加入浓硫酸。
答案为:
防止浓硫酸与H2O2溶液混合时放出大量热使H2O2分解;
(3)“结晶”操作中,加入K2CO3即可获得过氧硫酸氢钾复合盐晶体,该过程的化学方程式为5K2CO3+4H2SO5+4H2SO4=2(K2SO4•KHSO4•2KHSO5)↓+5CO2↑+5H2O。
答案为:
5K2CO3+4H2SO5+4H2SO4=2(K2SO4•KHSO4•2KHSO5)↓+5CO2↑+5H2O
从溶液pH看,过氧硫酸氢钾复合盐产率在2.0~2.5之间时最大;从温度看,过氧硫酸氢钾复合盐产率在0℃左右最大,所以该过程适宜的条件是控制pH在2.0~2.5之间,温度在0℃左右。
答案为:
控制pH在2.0~2.5之间,温度在0℃左右;
(4)①硫代硫酸钠溶液呈碱性,应放在碱式滴定管内。
答案为乙;
②由反应2KHSO5+4KI+H2SO4=2I2+3K2SO4+2H2O和I2+2Na2S2O3=Na2S4O6+2NaI可得出如下关系式:
KHSO5——2Na2S2O3
n(Na2S2O3)=0.2mol/L×0.025L=0.005mol,n(KHSO5)=0.0025mol
产品中KHSO5的质量分数为:
答案为:
38.00%。
4.利用钒钛磁铁矿冶炼后产生的钒渣(主要含FeO·V2O3、Al2O3、SiO2及少量可溶性磷酸盐)生产V2O5的工艺流程如下,回答下列问题:
已知:
①V2O5、Al2O3、SiO2可与Na2CO3、NaCl组成的混合钠盐在高温下反应,并转化为NaVO3、NaAlO2、Na2SiO3等可溶性钠盐。
②AlO
+4H+=Al3++2H2O。
(1)焙烧Ⅰ包括氧化和钠化成盐两个过程,氧化的目的是获得V2O5,写出氧化过程中FeO·V2O3发生反应的化学方程式________;废渣Ⅰ的主要成分是________;精制Ⅰ中加盐酸调pH的主要作用是________,加入NH3·H2O后发生反应的离子方程式为________。
(2)精制Ⅱ中加入CaCl2溶液除去磷酸盐,pH过小时影响除磷效果的原因是________;pH过大时,沉淀量增大的原因是________。
(3)沉钒所得NH4VO3沉淀需进行洗涤,洗涤时除去的阴离子主要是________。
NH4VO3在500℃时焙烧脱氨制得产品V2O5,反应方程式为2NH4VO3
V2O5+H2O↑+2NH3↑。
但脱氨过程中,部分V2O5会转化成V2O4,反应中氧化剂与还原剂物质的量之比为3:
2,该反应的化学方程式为________。
【答案】4FeO·V2O3+5O2
2Fe2O3+4V2O5Fe2O3[或Fe(OH)3]除Si并转化AlO2-写“除Si”即得分)Al3++3NH3·H2O=Al(OH)3↓+3NH
H++NH3·H2O=H2O+NH
(写出第一个离子方程式即得分)形成溶解度较大的酸式盐(或形成溶解度较大的磷酸氢钙和/或磷酸二氢钙)产生了Ca(OH)2沉淀Cl-3V2O5+2NH3
3V2O4+N2+3H2O
【解析】
【分析】
氧化过程FeO·V2O3生成对应的金属氧化物Fe2O3和V2O5;经过氧化和钠化后,V2O5、Al2O3、SiO2均转化为可溶性盐,Fe2O3[或Fe(OH)3]成为滤渣;精制Ⅰ中加盐酸调pH为了和SiO32-反应生成硅酸沉淀,将AlO2-转化为Al3+;加入NH3·H2O后与Al3+发生反应生成Al(OH)3沉淀;精制Ⅱ中加入CaCl2溶液生成磷酸钙沉淀,除去磷酸盐,沉钒时加入试剂NH4Cl,所得NH4VO3沉淀,焙烧得到产品,据此分析。
【详解】
(1)氧化过程FeO·V2O3生成对应的金属氧化物Fe2O3和V2O5,化学方程式为:
4FeO·V2O3+5O2
2Fe2O3+4V2O5;经过氧化和钠化后,V2O5、Al2O3、SiO2均转化为可溶性盐,Fe2O3[或Fe(OH)3]成为滤渣;精制Ⅰ中加盐酸调pH为了和SiO32-反应生成硅酸沉淀,将AlO2-转化为Al3+;加入NH3·H2O后与Al3+发生反应生成Al(OH)3沉淀,还可以中和酸,反应方程式为:
、
,故答案为:
4FeO·V2O3+5O2
2Fe2O3+4V2O5;Fe2O3[或Fe(OH)3];除Si并转化AlO2-(写“除Si”即得分);
,
(写出第一个离子方程式即得分);
(2)精制Ⅱ中加入CaCl2溶液生成磷酸钙沉淀,除去磷酸盐,pH过小时形成溶解度较大的酸式盐;pH过大时易形成Ca(OH)2沉淀,故答案为:
形成溶解度较大的酸式盐(或形成溶解度较大的磷酸氢钙和/或磷酸二氢钙);产生了Ca(OH)2沉淀;
(3)沉钒时加入试剂NH4Cl,因此所得NH4VO3沉淀含有阴离子主要为Cl-;脱氨过程中,部分V2O5会转化成V2O4,且反应中氧化剂与还原剂物质的量之比为3:
2,则V2O5为氧化剂,NH3为还原剂,还原产物为V2O4,氧化产物为N2,则氧化还原方程式为:
3V2O5+2NH3
3V2O4+N2+3H2O,故答案为:
Cl-;3V2O5+2NH3
3V2O4+N2+3H2O。
5.NH3和Cl2在常温下可快速反应生成氮气:
2NH3+3Cl2→N2+6HCl。
当Cl2和NH3比例不同时,产物有差异。
(1)该反应可用于检验化工生产中氯气是否泄漏。
如氯气有少量泄漏,用氨气检验时的现象为_____________________________。
(2)若利用该反应处理含有氨气和氯气的尾气,用于制备盐酸,Cl2和NH3的最佳比例为_____。
(3)常温常压下,取总物质的量为12mol的氯气和氨气的混合气体,完全反应后,气体物质的量保持不变。
求:
①反应前氯气和氨气的物质的量之比______________
②反应后生成的氧化产物的质量_______________。
(4)若将总体积为100L的NH3和Cl2混合,实验精确测得充分反应后无色混合气体中N2占混合气体的
,求生成氧化产物的物质的量_____________。
(该实验数据在标准状况下测定)
【答案】有白烟生成3∶2n(NH3)∶n(Cl2)=1∶1m(N2)=56g余NH3和N20.263mol,余HCl和N20.893mol
【解析】
【分析】
NH3和Cl2在常温下可快速反应生成氮气:
2NH3+3Cl2→N2+6HCl。
当Cl2和NH3比例不同时,产物有差异。
(1)要检验化工生产中氯气是否泄漏,则需要有明显的现象,从提供的反应可以看出,氨气过量时会有明显现象,找到该反应并指出现象即可;
(2)要求是利用氨气和氯气之间反应生成氯化氢用于制备盐酸,故按该反应中Cl2和NH3的比例来回答;
(3)常温常压下,取总物质的量为12mol的氯气和氨气的混合气体,完全反应后,气体物质的量保持不变,说明
反应后氨气有剩余,再发生反应NH3+HCl=NH4Cl,HCl不能完全反应,按此思路计算①反应前氯气和氨气的物质的量之比及②反应后生成的氧化产物的质量;
(4)若将总体积为100L的NH3和Cl2混合,①
恰好反应,根据方程式计算混合气体总体积,进而计算氮气体积;
②NH3过量时,发生反应
,剩余混合气体为氮气、氨气,设Cl2有xL,利用方程式和已知条件计算出氮气的体积、氧化产物的物质的量;
【详解】
(1)按题意,用于检验氯气是否泄漏的反应应有明显现象,氯气和氨气可能的反应为
、当氨气过量时会与生成的HCl反应生成氯化铵,有白烟,现象明显;
答案为:
有白烟生成;
(2)氨气和氯气在常温下可快速反应生成氮气:
,若利用该反应处理含有氨气和氯气的尾气,用于制备盐酸,Cl2和NH3的最佳比例为3:
2;
答案为:
3:
2;
(3)①常温常压下,取总物质的量为12mol的氯气和氨气的混合气体,完全反应后,气体物质的量保持不变,说明
反应后氨气有剩余,再多余氨气再与部分HCl发生反应NH3+HCl=NH4Cl,HCl不能完全反应,设反应
中消耗氯气的物质的量为x,
,
,前者体积增大与后者体积减小相等,则
,得x=6,
故反应前氯气和氨气的物质的量之比为
:
1;
答案为:
1:
1;
②反应后生成的氧化产物为氮气,氯气为6mol,由
可知,生成氮气的物质的量为2mol,故氧化产物氮气的质量=2mol×28g/mol=56g,
故答案为:
56g;
(4)在
反应中,NH3和Cl2恰好完全反应时,混合气体中N2占混合气体的
,由于氨气与HCl可以反应生成HN4Cl,而充分反应后的混合气体中N2占混合气体的
,则有两类情况:
①Cl2与氨气恰好反应,由方程式可知5体积气体生成7体积气体,故反应后混合气体总体积=100L×
=140L,则氧化产物氮气体积为140L×
=20L,故其物质的量=
=0.893mol;②NH3过量时,发生反应
,剩余混合气体为氮气、氨气,设Cl2有xL,则
,则
,
,故氧化产物氮气的物质的量=
;
答案为:
余NH3和N2为0.263mol,余HCl和N2为0.893mol。
6.三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:
HF、NO和HNO3,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素的物质的量之比为_______________。
(2)写出该反应的化学方程式,并标出电子转移的方向和数目:
____。
若反应中生成0.2molHNO3,转移的电子数目为______________________个。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。
你判断该气体泄漏时的现象是_______________________________。
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有______________(填化学式)。
【答案】2∶1
0.4NA泄漏时会看到白雾和红棕色气体,同时闻到刺激性气味NaNO3
【解析】
【分析】
由题给信息可知,三氟化氮(NF3)在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有HF、NO和HNO3,反应中氮元素的化合价从+3价分别降为+2价,升为+5价,由升降法配平可得化学方程式为3NF3+5H2O=9HF+2NO+HNO3。
【详解】
(1)由题给信息可知,反应中三氟化氮中氮元素的化合价即升高被氧化,又降低被还原,由化合价升降可知被氧化与被还原的氮元素的物质的量之比为1:
2,故答案为:
1:
2;
(2)由题给信息可知,三氟化氮(NF3)在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有HF、NO和HNO3,反应中氮元素的化合价从+3价分别降为+2价,升为+5价,由升降法配平可得化学方程式为3NF3+5H2O=9HF+2NO+HNO3,反应中生成1mol硝酸转移2mol电子,电子转移的方向和数目可表示为
,则反应中生成0.2molHNO3,则转移的电子数目为0.4NA个,故答案为:
;0.4NA;
(3)NF3在潮湿空气中泄漏由于有硝酸生成,会产生白雾,一氧化氮遇到空气被氧化成红棕色有刺激性气味的二氧化氮气体,故答案为:
泄漏时会看到白雾和红棕色气体,同时闻到刺激性气味;
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法吸收氟化氢、硝酸、一氧化氮和二氧化氮,会生成氟化钠、硝酸钠、亚硝酸钠和水,故答案为:
NaNO3。
7.将28.8g铜投入100mL浓硝酸中,最后铜有剩余,其NO3-离子物质的量变化如下图所示,请回答下列问题:
(1)开始反应时浓硝酸的物质的量浓度为____________mol/L。
(2)铜与浓硝酸反应生成的气体在标准状况下的体积(不考虑NO2与N2O4的平衡)为_____L。
(3)硝酸完全反应后消耗铜的物质的量n(Cu)是______mol。
(4)应再往此反应体系中滴加_________L2mol/L的硫酸才能使剩余的铜恰好完全溶解。
已知此过程中NO3-的还原产物为NO。
(5)ag铜全部溶于一定量的浓硝酸中,测得生成的气体在标准状况下的体积(不考虑NO2与N2O4的平衡)为bL,为消除污染,将生成的气体通入NaOH溶液中,气体被完全吸收。
已知:
NO+NO2+2NaOH→2NaNO2+H2O2NO2+2NaOH→NaNO3+NaNO2+H2O如果NO、NO2混合气体用NOx表示,被NaOH溶液完全吸收时,x的取值范围______;生成NaNO2的物质的量是_________mol;NaNO3的物质的量是_________mol。
(6)在常温下,把NO气体压缩到1.01×107Pa,再加热到500C,发现气体的压强迅速下降,压强降至略小于原压强的2/3,然后压强就不再改变。
已知其中一种产物为N2O,则上述变化的化学方程式为__________________。
气体的平均摩尔质量为M,则M的取值范围应该是_________________。
【答案】108.960.3100
;
【解析】
【分析】
(1)根据开始时硝酸根的物质的量计算硝酸的浓度;
(2)利用氮元素守恒计算气体的物质的量,再根据V=nVm计算二氧化氮的体积;
(3)反应结束,溶液中溶质为硝酸铜,根据硝酸根计算消耗n(Cu);
(4)发生反应:
,据此计算消耗硫酸的物质的量,进而计算需要硫酸的体积;
(5)由方程式
和
可知,NO单独不能被吸收,NO和NO2混合气体被NaOH溶液被完全吸收,满足
,当n(NO2):
n(NO)=1时x值最小,计算x的最小值,因为混有NO,所以x最大值<2,据此确定x取值范围;纵观整个过程,Cu失去的电子等于硝酸生成亚硝酸钠时获得的电子,根据电子转移守恒计算n(NaNO2),根据N元素守恒计算n(NaNO3);
(6)在常温下,把NO气体压缩到1.01×107Pa,再加热到50℃,发现气体的压强迅速下降,压强降至略小于原压强的
,然后压强就不再改变.已知其中一种产物为N2O,依据原子个数守恒可知该反应为:
3NO=N2O十NO2,因为存在
,即生成的NO2又双聚成N2O4,导致气体分子数减少,压强降至略小于原压强的
;若只发生反应:
3NO=N2O十NO2,气体的平均摩尔质量最小,若二氧化氮完全转化为四氧化二氮时,气体的平均摩尔质量最大,据此计算解答。
【详解】
(1)由图可知,开始时n(NO3−)=1.0mol,则n(HNO3)=n(NO3−)=1.0mol,则
,
故答案为:
10;