原子规道和能级图XPS光电子能谱分析.docx
《原子规道和能级图XPS光电子能谱分析.docx》由会员分享,可在线阅读,更多相关《原子规道和能级图XPS光电子能谱分析.docx(10页珍藏版)》请在冰豆网上搜索。
原子规道和能级图XPS光电子能谱分析
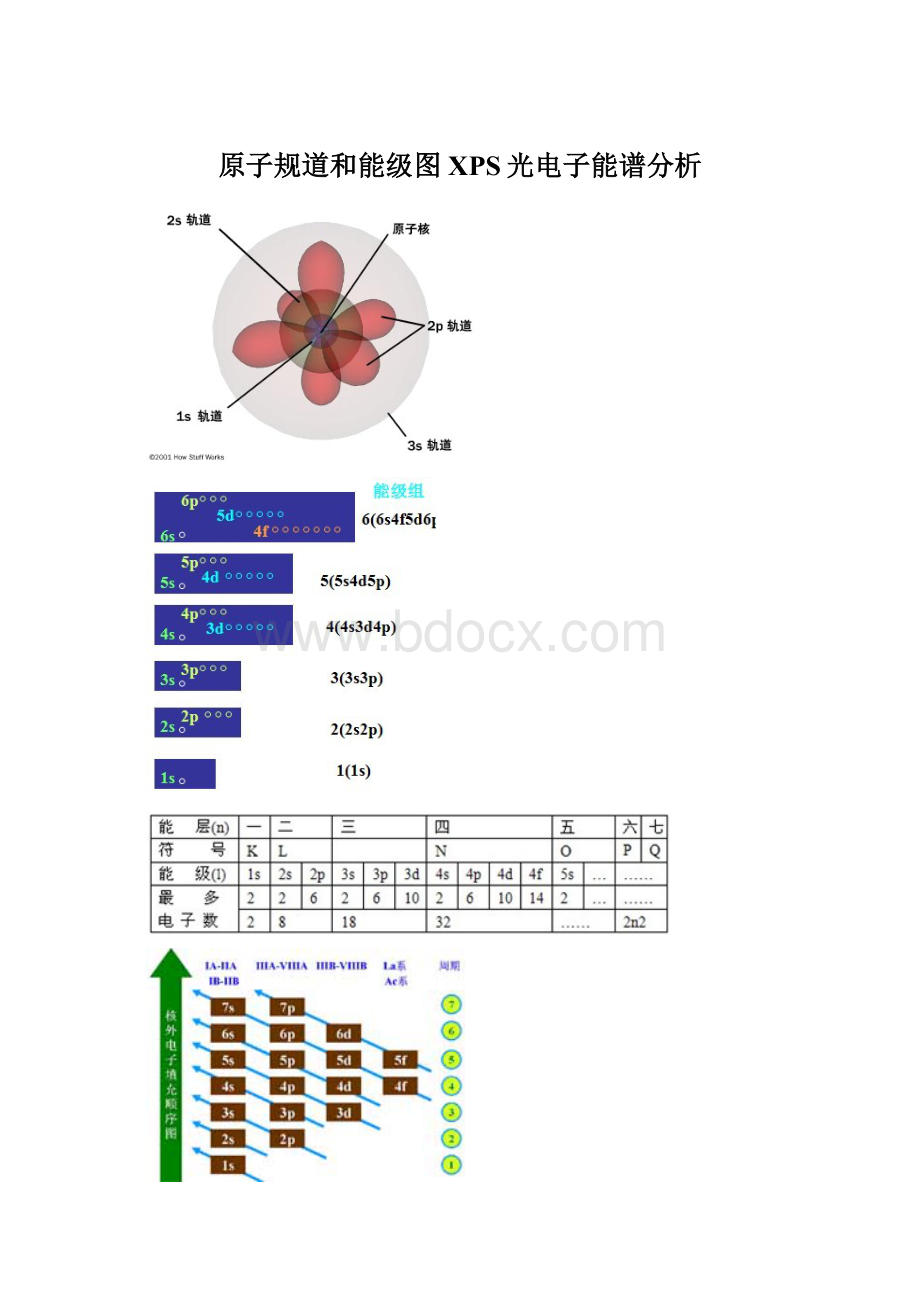
原子轨道近似能级图编辑美国化学家Pauling经过计算,将原子轨道分为七个能级组。
第一组:
1s
第二组:
2s2p
第三组:
3s3p
第四组:
4s3d4p
第五组:
5s4d5p
第六组:
6s4f5d6p
第七组:
7s5f6d7p
特点:
1、能级能量由低到高。
2、组与组之间能量差大,组内各轨道间能量差小,随n逐渐增大,这两种能量差逐渐减小。
3、第一能级组只有1s一个轨道,其余均有两个或两个以上,且以ns开始np结束。
4、能级组与元素周期相对应。
如题:
最近有人问我XPS元素的右下角数字的含义。
这是我个人的理解,请大家多多指教。
1、四个量子数的物理意义:
n为主量子数;l为角量子数;m为磁量子数;s为自旋量子数。
n=1,2,3,4…,但不等于0,并且以K(n=1),L(n=2),M(n=3),N(n=4),…表示。
l=0,1,2,3…。
并且以s(l=0),p(l=1),d(l=2),f(l=3),…表示。
s=1/2
m=0,±1,±2,…,±l
2、自旋-轨道分裂
我们知道原子中的电子既有轨道运动又有自旋运动。
量子力学的理论和光谱试验的结果都已经证实电子的轨道运动和自旋运动之间存在着电磁相互作用。
自旋-轨道耦合的结果使其能级发生分裂,这种分裂可以用总量子数j来表示,其数值为:
j=l+s,l+s-1,…,|l-s|
由上式可以知道:
s轨道:
当l=0,s=1/2时,j只有一个数值,即j=1/2;
p轨道:
当l=1,s=1/2时,j=1/2,3/2
d轨道:
当l=2,s=1/2时,j=3/2,5/2
f轨道当l=3,s=1/2时,j=5/2,7/2
3、原子和分子轨道的符号表示
原子中内层电子的运动状态可以用以描述单个电子运动状态的四个量子数来表征。
电子能谱试验通常是在无外磁场作用下进行的,磁量子数m是简并的,所以在电子能谱研究中通常用n,l,j三个量子数来表征内层电子的运动状态。
价电子用分子轨道符号来表示。
(1)原子
单个原子能级用两个数字和一个小写字母表示。
例如3d5/2,第一个数字代表主量子数n,小写英文字母角量子数l,右下角的分数代表内量子数j。
描述原子的总状态(或光谱项)用两个数和一个大写英文字母表示。
例如2D5/2,其中大写英文字母代表总角量子数(L),字母S,P,D,F,G,H,…依次表示L=0,1,2,3,4,5,…,左上角的数字表示多重性(2S+1)(其中S是总自旋量子数),右下角数字表示总量子数J值(光谱支项),J=|L+S|.
(2)分子
分子轨道和分子总状态的表征使用群论中的符号,经常用的有分子轨道理论和价键理论。
分子轨道分为σ轨道、л轨道和δ轨道。
4、原子轨道能是指和单电子波函数Ψi相应的能量Ei其近似等于这个轨道上电子的平均电离能的负值。
原子的总能量近似的等于各个电子的原子轨道能之和。
电子结合能又称为原子轨道能级。
指在中性原子中当其他电子均处在可能的最低能态时,某电子从指定的轨道上电离时所需能量的负值。
在数值上与电离能相等但是符号相反。
1.σ轨道和π轨道
如果分子轨道的电子云关于原子核的连线呈轴对称,就叫σ轨道。
如果分子轨道的电子云关于过原子核连线的平面呈镜面对称,就叫π轨道。
果分子轨道关于键轴中点的反演操作下不变,此分子轨道则是中心对称的,以下角标g表示。
如果分子轨道关于键轴中点的反演操作下改变符号,此分子轨道则是中心反对称的,以下角标u表示。
反键轨道在分子轨道符号的右上角打*号,成键轨道不打*号。
例如氢分子的Ψ1轨道和Ψ2轨道都是关于原子核的连线呈轴对称的,Ψ1在反演操作下不变,是中心对称的,Ψ2在反演操作下改变符号,是中心反对称的。
再者,Ψ1和Ψ2都是由氢原子的1s轨道生成的,因此,氢分子的Ψ1轨道以σg1s表示,Ψ2轨道以σu*1s表示。
同核双原子分子具有对称中心,异核双原子没有对称中心,因此,异核双原子不标g和u。
在σ轨道上的电子称为σ电子,在π轨道上的电子称为π电子,在成键轨道上的电子称为成键电子,在反键轨道上的电子称为反键电子。
3.分子轨道和原子轨道的能级相关图
将分子轨道以短线表示按能级高低顺序排列,并将其与相关的原子轨道连系起来就构成了分子轨道和原子轨道的相关图。
分子轨道的能量与组合的原子轨道的能量及它们的重叠程度有关。
原子轨道的能量越低,由它们组合成的分子轨道的能量也越低。
因形成σ轨道的重叠积
分比形成π轨道的重叠积分大,所以同一主壳层的原子轨道组合成的σ成键轨道比π成键轨道能量低,而σ反键轨道比π反键轨道能量高。
原因:
由于2s轨道与2p轨道能量相差不多,s与px轨道对称性相匹配,因此一个原子的2s轨道不但与另一个原子的2s轨道重叠,而且还可与其2px轨道重叠;对2p轨道亦然。
其结果是:
σ2s中包含若干2p成分,σ2p中也包含若干2s成分。
这导致σg2s和σu*2s的能量降低,σg2p和σu*2p的能量升高,这种效应随2s和2p轨道的能量差的增大而减小。
第二周期N以前元素的同核双原子分子都有这种现象。
O以后由于2s和2px轨道能级相差大而没有这种现象。
N2的分子轨道能级相关图
Be2分子Be的电子层结构为1s22s2,两个Be原子共有4个价电子,如果形成Be2分子,其电子层结构为
因σg2s2的成键作用与σu*2s2的反键作用大致抵消,净成键电子数为零,故Be是极不稳定的分子。
B2分子B的电子层结构为1s22s22p1,两个B原子共有6个价电子,B2分子的电子层结构为
B2分子的两个原子间没有σ键,只有π键。
B2分子显顺磁性。
F2分子
F原子的电子层结构为1s22s22p5,F2分子的电子层结构为
其中σg2s2的成键作用与σu*2s2的反键作用抵消,πu2py2、πu2pz2的成键作用与πg*2py2、πg*2pz2的反键作用也相互抵消,所以F2分子中实际对成键有贡献的只有一对σg2p2电子,F2分子是单键结合的。
2.异核双原子分子
异核双原子分子的两个原子的相应原子轨道(例如2sa和2sb,2pa和2pb等)具有不同的能量,只有对称性匹配且能量又相近的轨道才能有效地组合成分子轨道。
因此,异核双原子的分子轨道不一定由两个原子的相应原子轨道线性组合而成。
分子轨道记号按能量顺序分类编号
CO分子
CO分子的电子层结构为
量子化学计算和光电子能谱测量表明,1σ轨道主要由O的1s构成,2σ主要由C的1s构成,属原子轨道,不参与成键。
3σ是O原子的孤对电子,5σ是C的孤对电子,4σ和1π是成键轨道,3σ有微弱的成键特性,5σ有微弱的反键特性。
CO的分子轨道能级相关图
HF分子
HF分子的电子层结构为
式中K是内层电子,2σ是F原子的2s轨道,1π是F原子的2py和2pz轨道,3σ是H原子的1s和F原子的2px轨道组成的分子轨道,所以HF分子的电子层结构也可写做
成键轨道只有3σ(或写做σ),而2σ、1π为非键轨道,对成键没有贡献。
可见,HF分子是单键分子。
活化能是指中,由反应物分子从常态转变为容易发生化学反应的活跃状态所需要的的最小能量称为活化能。
活化能的一般认为是这样:
从原反应体系到产物的中间阶段存在一个过渡状态,这个过渡状态和原系统的差就是活化能E,而且热能RT如不大于E,反应就不能进行。
也就是原系统和生成物系统之间存在着,其高度相当于活化能。