兽药产品现场审核表.docx
《兽药产品现场审核表.docx》由会员分享,可在线阅读,更多相关《兽药产品现场审核表.docx(36页珍藏版)》请在冰豆网上搜索。
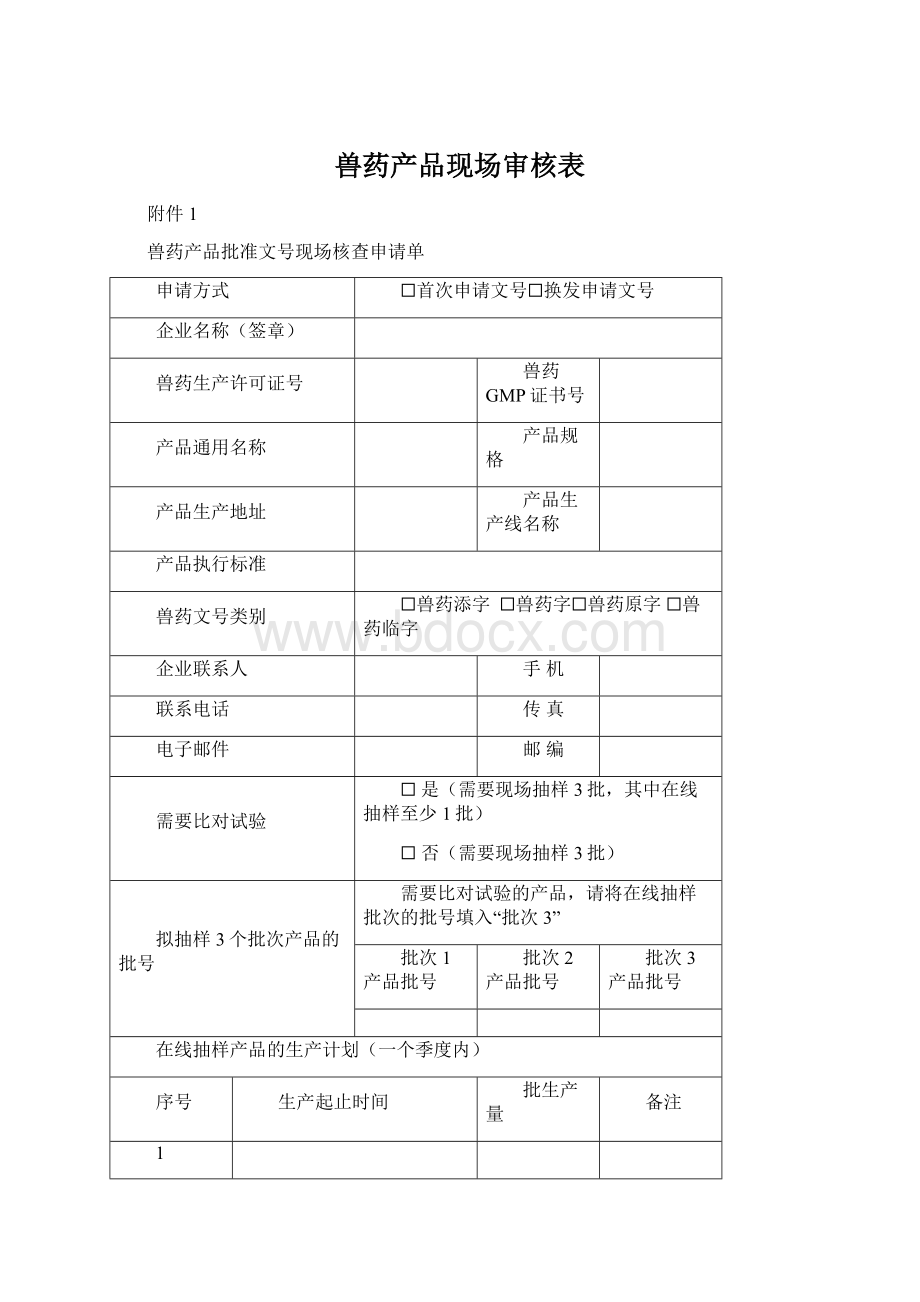
兽药产品现场审核表
附件1
兽药产品批准文号现场核查申请单
申请方式
☐首次申请文号☐换发申请文号
企业名称(签章)
兽药生产许可证号
兽药GMP证书号
产品通用名称
产品规格
产品生产地址
产品生产线名称
产品执行标准
兽药文号类别
☐兽药添字 ☐兽药字☐兽药原字☐兽药临字
企业联系人
手 机
联系电话
传 真
电子邮件
邮 编
需要比对试验
☐是(需要现场抽样3批,其中在线抽样至少1批)
☐否(需要现场抽样3批)
拟抽样3个批次产品的批号
需要比对试验的产品,请将在线抽样批次的批号填入“批次3”
批次1产品批号
批次2产品批号
批次3产品批号
在线抽样产品的生产计划(一个季度内)
序号
生产起止时间
批生产量
备注
1
2
3
备注
兽药产品批准文号现场核查申请单(续)
请按下面附表的样式提供材料,并根据填写内容自行增加表格行目:
附表1:
关键工序标准操作规程(SOP)制定情况汇总表
标准操作规程(SOP)名称
文件编号
附表2:
主要生产、检验人员情况汇总表
姓名
所在岗位
职务或职称
从业年限
附表3:
关键原料及标准物质使用情况汇总表
原料/标准物质
名称
生产单位
执行标准
附表4:
主要生产设备及检验仪器汇总表
设备/仪器名称
设备/仪器编号
型号或规格
数量
实验动物设施(是否委托检验)
□否
请将实验动物设施设备情况填入上表中。
□是
应提供委托检验协议(合同)等证明材料。
附件2
兽药产品批准文号现场核查报告(1/2)
企业名称
核查产品
通用名称
现场核查
起止时间
规格
网上申请文号
流水号
包装
《兽药抽样记录及凭证》编号
产品执行标准
产品抽样数量
需要比对试验
☐是(需要现场抽样3批,其中在线抽样至少1批)
☐否(需要现场抽样3批)
抽样3批次
产品批号
需要比对试验的产品,请将在线抽样批次的批号填入“批次3”
批次1产品批号
批次2产品批号
批次3产品批号
核查产品
生产线名称
核查产品
生产地址
核查单位名称
序号
核查内容
核查结果
(是/否)
备注
1
生产许可证和兽药GMP证书是否在有效期内
2
是否在生产许可证和兽药GMP证书批准的生产范围内生产
3
是否在已批准的兽药GMP车间生产
4
是否制定有关管理制度,并按制度执行
5
生产和检验人员的数量和资质是否符合要求
6
购进原料是否有合法来源,使用记录是否完整
7
主要生产、检验设备仪器是否能正常使用,并经检定/校验
兽药产品批准文号现场核查报告(2/2)
序号
核查内容(续)
核查结果
(是/否)
备注
8
空调/净化系统运行是否正常,记录是否完整
9
工艺用水系统运行是否正常,记录是否完整
10
批生产记录、检验记录内容是否完整、规范,并归档
11
批生产记录中工艺描述和参数与申报工艺是否一致
12
现场核查生产工艺与申报工艺是否一致
13
产品批产量应符合工艺验证批量要求,或生产的最小批量不低于配液罐或混合设备总容积的30%。
判定原则:
上述各项目如有1项及以上核查结果为否,现场核查结果为不符合要求。
结论
上述核查项目共_____项符合要求,共_____项不符合要求。
现场核查结果:
□符合要求□不符合要求
核查人员签字
日期:
企业负责人签字
日期:
省级兽医行政
管理部门意见(公章)
日期
备注
附件3
兽药产品批准文号现场核查要点
为保证兽药产品批准文号现场核查工作质量,根据《兽药管理条例》、《兽药生产质量管理规范》和《兽药产品批准文号管理办法》等有关规定,进一步明确了现场检查的重点内容,供各省级兽医行政管理部门组织开展现场核查工作时参考。
一、生产资质
生产企业应具有兽药生产许可证和兽药GMP证书,且兽药生产许可证和兽药GMP证书在有效期内。
二、管理制度制定与执行情况
1.应制定生产管理和质量管理等各项管理制度,如涉及易制毒及危险品,应有相应管理制度。
2.应按照有关管理制度执行。
三、生产、检验人员相关情况
1.应提供生产人员名单。
直接从事生产人员应具有高中以上文化程度,并经本岗位培训合格。
2.应提供检验人员名单。
检验人员应具有高中(含中专)以上文化程度,并持有省级以上兽药监察机构核发的培训合格证或相应兽药职业资格证书。
3.生产、检验人员应按培训计划进行培训和考核。
四、原料购进和使用情况
1.购进的原料应具有合法来源(如批准证明性文件或资质文件、原料购买发票复印件等)。
2.应具有原料内控质量标准及自检报告书。
购入量应满足现场核查3批产品的生产需求。
3.应具有原料出入库记录和取样记录。
五、生产、检验设备和仪器状况
1.主要设备和仪器应满足申请产品生产、检验要求。
2.主要设备和仪器应检定/校验合格,应有使用记录。
六、生产、检验条件
1.应具备与产品生产相适应的场所、设施,如生产环境的洁净级别要求。
2.应具备与产品检验相适应的场所、设施,如无菌室、实验动物房等。
七、相关生产、检验记录
1.应建立生产记录,记录项目及其内容应完整、清晰、规范、真实。
2.应建立检验记录,记录项目及其内容应完整、清晰、规范、真实,应包含检验原始记录、图谱等。
八、产品产量要求
产品批产量应符合工艺验证批量要求,或生产的最小批量不低于配液罐或混合设备总容积的30%。
九、首次申报文号产品现场核查时的包装要求
为避免企业获得兽药批准文号后,返工包装,首次申报兽药批准文号抽样产品,应采取模拟上市包装、标签。
标签应与企业申报兽药产品批准文号时报送的标签样式一致。
十、生产工艺
1.现场核查生产工艺应与文号申报工艺一致。
2.批生产记录中工艺描述和参数应与文号申报工艺一致。
附件4
兽药制剂申报生产工艺技术要求
一、概述
1.企业信息
公司名称
生产地址
2.产品信息
通用名称
剂型
规格
二、产品配方
列出原辅料种类、配方量。
粉剂、散剂、预混剂、颗粒剂、粉针剂以1000克计,片剂以1000片计,丸剂以1000丸或1000克计,液体制剂以1000毫升计为单位。
序号
类别
主要原辅料名称
配方量
1
原料
原料药1
2
原料药2
3
可根据填写内容自行增加行目
4
辅料
辅料1
5
辅料2
6
可根据填写内容自行增加行目
三、原、辅料和内包装材料
1.原辅料列表:
生产过程中需要加入的所有原料、辅料(含溶剂、活性炭、包衣材料等),包括生产过程中可能去除,在成品中不出现的辅料。
(原、辅料没有批准文号的,该项下可不填写)
序号
类别
物料名称
生产商
批准文号
执行标准
备注
1
原料
原料1
2
原料2
3
可根据填写内容自行增加行目
4
辅料
辅料1
5
辅料2
6
可根据填写内容自行增加行目
7
不出现在最终产品中的辅料
辅料1
8
辅料2
9
可根据填写内容自行增加行目
产品包衣材料(如有请填写)
序号
类别
物料名称
生产商
批准文号
执行标准
备注
1
原料
原料1
2
原料2
3
可根据填写内容自行增加行目
4
辅料
辅料1
5
辅料2
6
可根据填写内容自行增加行目
2.内包装材料列表(不需要注册的包材,可不填写注册号)
序号
包材名称
规格
生产商
注册号
质量标准
1
2
可根据填写内容自行增加行目
四、批量生产工艺
1.批生产量
经工艺验证预计最小批次量
经工艺验证预计最大批次量
2.工艺流程图(示例附后)
工艺流程图中可以运用各种图标表示工艺各个工序名称及生产区域的洁净级别、中间控制点及控制项目。
3.工艺过程描述(示例附后)
本工艺流程共包括()个工序,各个工序的主要操作叙述如下:
工序1
按实际操作流程叙述关键步骤。
工序2
按实际操作流程叙述关键步骤。
工序3
按实际操作流程叙述关键步骤。
4.关键工艺参数(至少应包括风险性高的工序)
序号
工序名称
工艺参数
控制范围
备注
1
2
可根据填写内容自行增加行目
五、主要工艺设备
1.主要生产设备一览表
序号
工序名称
设备名称
设备型号
设备产能
设备材质
设备编号
1
2
可根据填写内容自行增加行目
六、半成品检验
待检产品
工序名称
储存条件
检测项目
控制指标
半成品1
1
2
可根据填写内容自行增加行目
半成品2
1
2
可根据填写内容自行增加行目
可根据填写内容自行增加行目
七、产品检验执行的兽药国家标准
产品检验执行的兽药国家标准
示例:
兽药制剂(化药)生产工艺流程图和工艺过程描述
2.氟尼辛葡甲胺注射液工艺流程图
3.氟尼辛葡甲胺注射液工艺过程描述
本工艺流程共包括10个工序,各个工序的主要操作叙述如下。
工序1:
铝塑盖的洗涤与灭菌干燥
将铝塑盖按照规定脱包传递至铝盖清洗间,用纯化水对铝盖进行清洗,检测合格后放入灭菌柜按照规定程序进行灭菌。
关键工艺参数:
铝塑盖的清洗时间;用纯化水漂洗5分钟、冲洗3分钟。
铝塑盖的灭菌温度,灭菌时间:
121℃,20分钟。
中间控制:
最后一遍洗涤用水可见异物检查,合格标准:
取最后一遍洗涤用水200ml,检查含短于5mm的毛、点总数不得超过12个,色点、异物不得有为合格。
工序2:
胶塞的洗涤、灭菌与干燥
将胶塞按照规定脱包传递至胶塞清洗间,然后投入胶塞清洗机,纯化水粗洗,注射用水精洗,检测合格后,按照规定的灭菌程序进行灭菌。
关键工艺参数:
纯化水压力、注射用水压力:
纯化水的水压不得低于0.2MPa,注射用水水压不得低于0.2MPa;
粗洗时间、精洗时间:
纯化水粗洗,保持箱内压力-0.06Mpa,维持10分钟开始真空脱泡,脱泡完毕后恢复箱内压力至常压后,间隔15秒打开气冲阀,运行气冲喷淋,5分钟后关闭气冲阀,结束粗洗。
粗洗完毕后,使用注射用水开始精洗。
注射用水喷淋5分钟后,箱内加水至水位,间隔15秒打开气冲阀气冲喷淋,5分钟后关闭气冲阀,结束精洗。
精洗结束后,使用注射用水漂洗,注射用水喷淋5分钟后,溢流清洗10分钟,结束漂洗;
灭菌温度、灭菌时间:
121℃,30分钟。
中间控制:
纯化水和注射用水可见异物检查:
微细可见异物(如点状物、2mm以下的短纤维和块状物等)不得有,明显可见异物(色点、异物)不得有为合格;
最后一遍洗涤水可见异物检查:
取最后一次洗涤用水200ml,检查含微细可见异物(如点状物、2mm以下的短纤维和块状物等)总数不得超过1个,明显可见异物(色点、异物)不得有为合格。
工序3:
玻璃瓶的洗涤、烘干与灭菌
将脱包后玻璃瓶推至洗瓶机的上瓶盘中,启动洗瓶机,玻璃瓶经过超声波清洗、纯化水冲洗、注射用水冲洗、压缩空气吹干后进入隧道烘箱,按照规定的灭菌程序进行灭菌。
关键工艺参数:
纯化水压力、注射用水压力、压缩空气压力;冲洗用纯化水的压力为≥0.2Mpa,注射用水压力为≥0.2Mpa,压缩空气压力为≥0.2Mpa;
洗瓶速度:
洗瓶机电机速率不超过50Hz;
灭菌温度、灭菌时间:
灭菌阶段的温度为≥320℃,灭菌时间5分钟以上。
中间控制:
纯化水和注射用水可见异物检查:
微细可见异物(如点状物、2mm以下的短纤维和块状物等)不得有,明显可见异物(色点、异物)不得有为合格;
洗净瓶可见异物检查:
取洗净瓶10支,注入注射用水,在灯检仪下检测,含微细可见异物(如点状物、2mm以下的短纤维和块状物等)总数不得超过1个,明显可见异物(色点、异物)不得有为合格。
工序4:
配料
配料罐过滤器灭菌处理:
根据产品配料需要,对使用的配料罐和过滤器进行灭菌处理。
首先将配料罐和过滤器与纯蒸汽管道连接成闭合的回路,通入蒸汽使配料罐及管道内温度升至规定温度,维持规定时间,完成灭菌。
配料人员核对原辅料的品名,数量,生产厂家,生产批号、合格状态等,然后脱包传递至称量间内,双人复核称重处方量的物料,按照配料的操作规程进行配料,料液配制完毕后按照半成品的检验操作规程进行检测,合格后开始过滤。
关键工艺参数:
对原辅料进行检查核对,包括品名、批号、数量、生产厂家、合格状态;
称重及复核;
配料罐的灭菌温度、灭菌时间:
121℃,30分钟。
中间控制:
配制后料液的检测,包含性状、溶液颜色、溶液澄明度、PH值等。
工序5:
除菌过滤
料液配制完成后,将料液按照过滤操作规程通过已灭菌的过滤器过滤至灌装间的已灭菌处理过的接收容器内。
过滤完毕,对0.22µm的滤芯进行完整性测试,确定滤芯完好无损。
关键工艺参数:
除菌滤器的灭菌温度和灭菌时间:
121℃,30分钟。
中间控制:
除菌滤器通过完整性检测。
工序6:
灌装、加塞
在百级层流的保护下,安装好灌装机的各零部件,在振荡器内加满合格的胶塞,开启灌装机调试装量,调试合格后开始正式灌装,加塞,通过轨道输送至轧盖间轧盖。
关键工艺参数:
装量。
中间控制:
玻璃瓶和胶塞的可见异物检查:
随机抽取10支样品,加入过滤后的注射用水适量,在灯检仪下轻轻翻转检测,含微细可见异物(如点状物、2mm以下的短纤维和块状物等)总数不得超过1个,明显可见异物(色点、异物)不得有为合格。
装量检测:
每次抽取不同灌针下的分装半成品共6瓶,开启时注意避免损失,将内容物用适宜体积的干燥注射器抽尽,然后注入校正的相应体积的干燥标量瓶内,在室温下检视,平均装量不得低于标示装量,单个装量不得低于标示装量的98%。
加塞质量检测:
不得有胶塞扣塞不端正、扣塞深度不够。
工序7:
轧盖
开启轧盖机对灌装完毕的产品进行轧盖,主机手随时检查轧盖质量。
关键工艺参数:
无。
中间控制:
轧盖质量检测:
以三指直立拧盖不得松动,边缘平贴,不得有毛边为合格。
工序8:
灭菌
轧好盖的产品,送入灭菌柜按照规定的程序进行灭菌,灭菌完毕后进行捡漏。
关键工艺参数:
灭菌时间、灭菌温度:
121℃,20分钟。
中间控制:
无。
工序9:
灯检
灭菌后的产品送至灯检室逐一进行灯检。
关键工艺参数:
无。
中间控制:
产品可见异物检测:
每次拿取2支先静止直立,然后放倒横向,最后轻轻翻转倒立在黑色背景下,目检玻瓶中是否有色点、纤维、玻璃等,再轻轻翻转后在白色背景下目检是否有黑点,时限不少于5秒,在规定检查时限内所见微细可见异物(如点状物、2mm下的短纤维和块状物等)不得有,明显可见异物(金属屑、玻璃屑、长度或最大粒径超过2mm的纤维和块状物等)不得有为合格。
工序10:
包装
对包装材料进行检查核对,包括品名、批号、数量、生产厂家、合格状态;由双人符合标签印制内容正确无误后开始进行贴签、装盒、装箱,包装完成后入库。
关键工艺参数:
无。
中间控制:
印制内容的检查复核;
包装材料物料平衡:
标签类物料平衡为100%,其他包装材料物料平衡为98-100%。
附件5
兽用原料药申报生产工艺技术要求
一、概述
1.企业信息
公司名称
生产地址
2.产品信息
通用名称
化学名称
分子式
分子量
化学结构式
3.理化性质(可根据填写内容自行增加行目)
性状
熔点
溶解性
二、起始物料和内包装材料
1.起始物料列表(没有含量限度的原料,可不填写含量限度)
序号
起始物料名称
指标名称
含量限度
起始物料供应商
备注
1
原料1
2
原料2
可根据填写内容自行增加行目
2.内包装材料
序号
包材名称
规格
生产商
注册号
质量标准
1
2
可根据填写内容自行增加行目
三、化学反应过程和工艺流程(示例附后)
1.化学反应方程式
2.工艺流程图
3.工艺过程描述
根据生产设施、设备情况,经工艺验证预计最大批次量可能达。
发酵类原料药产品请填写:
纯度(或组分比例):
。
合成类原料药产品请填写收率(或总收率)。
4.关键工艺参数(可根据填写内容自行增加行目)
序号
工序名称
工艺参数
控制范围
备注
1
2
四、主要生产设备一览表(可根据填写内容自行增加行目)
序号
工序名称
设备名称
设备型号
设备产能
设备材质
设备编号
1
2
五、中间体、粗品质量标准及控制方法(可依据填写内容自行增加检品)
序号
检品名称
工序名称
储存条件
检测项目
控制指标
1
中间体1
1
2
(可依据填写内容增加检测项目)
2
中间体2
1
2
(可依据填写内容增加检测项目)
3
粗品
1
2
(可依据填写内容增加检测项目)
六、产品检验执行的兽药国家标准
产品检验执行的
兽药国家标准
示例:
金霉素生产化学反应过程和工艺流程图
1.金霉素生产化学反应方程式
1)生物合成机制:
2)成盐反应
C22H23ClN2O8+HClC22H23ClN2O8·HCl
2.金霉素生产工艺流程图
金霉素发酵工艺流程图
*中间控制取样
A.菌丝体形态,pH,效价,菌检
B.总糖、pH、效价
2.2提取工艺流程图
*中间控制取样
3.金霉素生产工艺过程描述
根据提取过程的生产设施、设备情况,经工艺验证预计最大批次量可能达3000kg。
纯度:
80%以上。
工艺流程共包括二个阶段,第一阶段为微生物发酵,分三个工序,第二阶段为抗生素提取,分11个工序,各阶段下各工序的主要操作叙述如下。
第一阶段:
微生物发酵
主要通过金色链丝菌经微生物发酵培养后生产出金霉素代谢产物。
工序1:
菌种来源及制备
1)母斜面/子斜面制备:
培养基配比:
如下表
原料名称
组分比例
备注
麦麸
1.5
MgCl
0.05
K2HPO4
0.05
(NH4)2HPO4
0.05-0.1
水
适量
纯化水
总体积
100
2)简要操作过程:
按照上述“孢子培养基”组成成分配制好的培养基,用10%NaOH调节pH5.0-6.0,分装于扁瓶中,在115-118℃温度下灭菌30分钟,冷却后制成斜面,斜面经无菌检查合格后,备用。
砂土孢子管:
主要用于储藏金霉素产生菌-金色链丝菌。
菌种是公司内部自然选育而得的,日常使用的砂土孢子管冷藏在冰箱中。
将砂土管孢子接到母斜面上并在30℃下培养3-5天,冷却并储藏使用。
取母斜面孢子接种(湿接)到子斜面上,在30℃下培养3-5天,冷却后,用接种针将孢子刮下,加水制成菌悬液,以备向种子罐接种。
工序2:
种子罐培养
1)种子培养基配比:
原料名称
组分比例
备注
淀粉酶
0.1-0.5
碳酸钙
0.03
葡萄糖
1.0-2.6
硫酸镁
0.01
氯化钠
0.5
豆饼粉
6.0
玉米淀粉
6.0
植物油或豆油
0.0-1.0
自来水
适量
总体积
100
2)简要操作过程:
根据种子罐大小和用量,照配方比例,将起始原料投入到罐中,加水定容并搅拌均匀后,通入蒸汽高温灭菌,冷却,备用。
在相对负压下,将孢子悬浮液接到种子罐培养液中,在29℃-34℃和其它适宜条件下培养20-30小时,达到移种指标,即可向发酵罐接种。
工序3:
发酵罐培养
1)发酵培养基配比:
原料名称
组分比例
备注
淀粉酶
0.002
玉米淀粉
6.0
碳酸钙
0.2
葡萄糖
1.0-2.0
硫酸镁
0.05
氯化钠
0.7
豆饼粉
8.0
植物油
0.0-1.0
酵母粉
4.0
自来水
适量
总体积
100
2)简要操作过程:
根据发酵罐大小和用量,照配方比例,将起始原料投入到罐中,加水定容并搅拌均匀后,通入蒸汽高温灭菌,冷却,备用。
将备好的成熟的种子培养物用移种管道接种到相应灭菌好的发酵罐培养基中。
培养基过程中,定时对发酵液总糖、氨基氮、溶解磷和pH等参数进行监测,并不断补加适量的糖液和通氨调节pH,以保持一定的营养成分完成发酵。
在发酵后期或放罐前最后10小时内不可再补料,当总糖在3.0%以下时可以放罐。
第二阶段:
抗生素提取
主要通过对上游的一个单独发酵罐的发酵液经过下游提炼生产包括酸化、沉淀和溶媒提取和结晶等步骤,最终形成盐酸金霉素,其结果符合质量标准。
工序4:
酸化和过滤
在酸化罐内加入发酵液,在搅拌下,加水稀释到原体积的2倍,加入盐酸并调pH至2.0-3.0,待pH恒定后,开始过滤,收集滤液于滤洗液贮罐中,待沉淀。
工序5:
沉淀/复盐
酸化液泵入沉淀罐中,搅拌并冷却后,取样品A检测滤洗液效价。
根据效价向罐中的滤洗液中加1.0—1.5%(W/V)氯化镁和碳酸钙。
搅拌并加入碱液使金霉素钙镁盐析出。
沉淀经过滤和水洗后,形成金霉素复盐。
工序6:
粗结晶
复盐投入粗晶罐中,据沉淀进料的总亿,加入乙醇和盐酸使复盐全部溶解,在30—40℃下保温30分钟,取样品B测镁盐液效价,应为50000-80000u/ml,得到的粗晶液经过滤后获得粗制盐酸金霉素结晶。
工序7:
抽提纯化
将粗结晶渐渐投入装有3%(w/v)氯化镁乙醇溶液的抽提罐中,加碱中和,使粗晶完全溶解。
取样品C测粗晶液效价,应在20000u/ml以上。
过滤并收集到结晶罐中。
工序8:
重结晶
取结晶罐内样品D测抽提滤液效价,应在20000u/ml以上。
在不停搅拌下加入20%(v/v)盐酸。
并在30-40℃下保温10分钟,成晶。
工序9:
离心和洗涤
重结晶液直接进入离心