全国备战高考化学钠及其化合物推断题的综合备战高考真题分类汇总附答案解析.docx
《全国备战高考化学钠及其化合物推断题的综合备战高考真题分类汇总附答案解析.docx》由会员分享,可在线阅读,更多相关《全国备战高考化学钠及其化合物推断题的综合备战高考真题分类汇总附答案解析.docx(16页珍藏版)》请在冰豆网上搜索。
全国备战高考化学钠及其化合物推断题的综合备战高考真题分类汇总附答案解析
2020-2021全国备战高考化学钠及其化合物推断题的综合备战高考真题分类汇总附答案解析
一、钠及其化合物
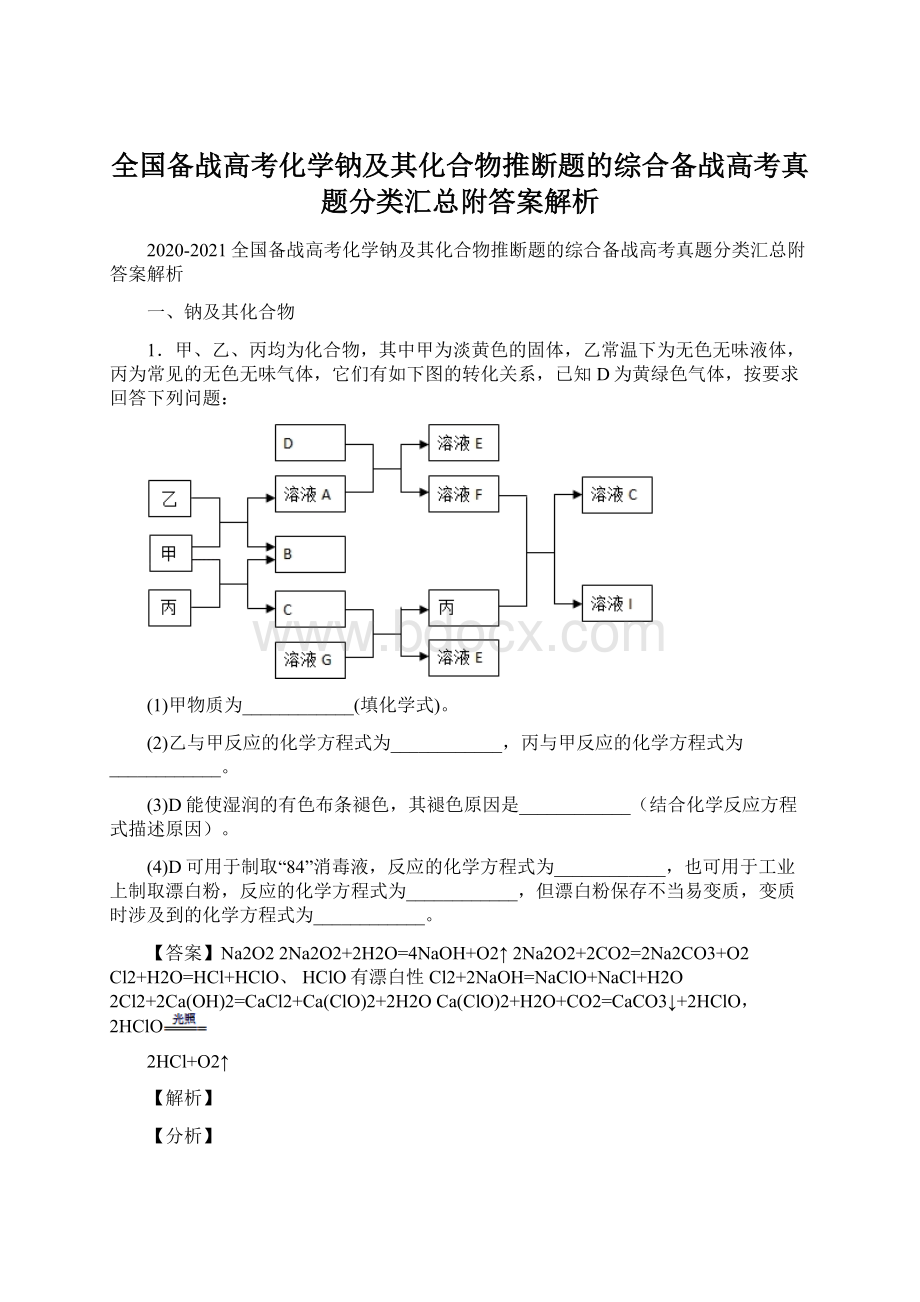
1.甲、乙、丙均为化合物,其中甲为淡黄色的固体,乙常温下为无色无味液体,丙为常见的无色无味气体,它们有如下图的转化关系,已知D为黄绿色气体,按要求回答下列问题:
(1)甲物质为____________(填化学式)。
(2)乙与甲反应的化学方程式为____________,丙与甲反应的化学方程式为____________。
(3)D能使湿润的有色布条褪色,其褪色原因是____________(结合化学反应方程式描述原因)。
(4)D可用于制取“84”消毒液,反应的化学方程式为____________,也可用于工业上制取漂白粉,反应的化学方程式为____________,但漂白粉保存不当易变质,变质时涉及到的化学方程式为____________。
【答案】Na2O22Na2O2+2H2O=4NaOH+O2↑2Na2O2+2CO2=2Na2CO3+O2Cl2+H2O=HCl+HClO、HClO有漂白性Cl2+2NaOH=NaClO+NaCl+H2O2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2OCa(ClO)2+H2O+CO2=CaCO3↓+2HClO,2HClO
2HCl+O2↑
【解析】
【分析】
甲、乙、丙均为化合物,甲为淡黄色的固体,乙常温下为无色无味液体,丙为常见的无色无味气体,甲能既能与乙反应也能与丙反应,可知甲为Na2O2,乙为H2O,丙为CO2,则A为NaOH,B为O2,C为Na2CO3,D为黄绿色气体,则D为Cl2,D(Cl2)与A(NaOH)反应生成NaCl、NaClO,F的溶液能与丙(CO2)反应C与I,则F为NaClO、E为NaCl、I为HClO,G与C(Na2CO3)反应得到E(NaCl)与丙(CO2),则G为HCl,据此解答。
【详解】
根据上述分析可知:
甲为Na2O2,乙为H2O,丙为CO2,A为NaOH,B为O2,C为Na2CO3,D为Cl2,E为NaCl,F为NaClO,G为HCl,I为HClO。
(1)甲是过氧化钠,化学式为Na2O2;
(2)甲为Na2O2,乙为H2O,丙为CO2,Na2O2与H2O反应产生NaOH和O2,反应方程式为:
2Na2O2+2H2O=4NaOH+O2↑;Na2O2与CO2反应产生Na2CO3和O2,反应方程式为:
2Na2O2+2CO2=2Na2CO3+O2;
(3)D为Cl2,氯气与水反应产生HCl和HClO,反应方程式为:
Cl2+H2O=HCl+HClO,产生的HClO由于有强氧化性而具有漂白性,能够将有色物质氧化变为无色,所以氯气能够使湿润的有色布条褪色;
(4)Cl2与NaOH溶液发生反应:
Cl2+2NaOH=NaCl+NaClO+H2O,得到的溶液为NaCl、NaClO的混合物,即为“84”消毒液,有效成分为NaClO;氯气与石灰乳发生反应制取漂白粉,反应为:
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,有效成分为Ca(ClO)2,由于酸性H2CO3>HClO,所以漂白粉在空中中露置,会发生反应:
Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO,产生的HClO不稳定,光照易分解:
2HClO
2HCl+O2↑,导致漂白粉失效,所以漂白粉要密封保存在冷暗处。
【点睛】
本题考查无机物推断,“甲为淡黄色的固体且能与无色液体反应、与无色无味气体反应”是推断突破口,熟练掌握钠、氯元素的单质及化合物性质是本题解答的关键,注意二氧化碳与次氯酸盐溶液反应。
2.A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。
请针对以下三种不同情况回答:
若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
中含有的金属元素在元素周期表中的位置为_______________________,向水中加入X物质,X对水的电离平衡的影响是_________
填“促进”、“抑制”或“无影响”
。
与C的水溶液混合后生成B,反应的离子方程式为___________________________。
若A为固态非金属单质,A与X同周期,同时A在X中燃烧,生成
和
白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
若A为该元素的白色固体单质,其结构为正四面体,分子式为
,则
单质中含共价键数目为_________
,B的电子式为_________。
与水反应的离子方程式为_______________________________________________。
若A、B、C的焰色反应呈黄色,A为淡黄色固体,B、C的水溶液均为碱性,A溶于水后可与X反应生成C,常温下,X为气态酸性氧化物。
中所含有的化学键类型是_________。
溶液中离子浓度由小到大的顺序是_________。
【答案】第三周期第ⅢA族抑制
离子键、共价键
【解析】
【分析】
A、B、C、X是中学化学常见物质,均由短周期元素组成;
(1)若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,x为氢氧化钠;
①A中含有的金属元素为Al;加入X为氢氧化钠,抑制水的电离程度;
②A与C的水溶液混合后生成B,是铝离子和偏铝酸根离子双水解反应生成氢氧化铝沉淀;
(2)①若A为固态非金属单质,A与X同为第三周期元素,常温常压下C为白色固体,B分子中各原子最外层均为8e-结构,同时A在X中燃烧,由转化关系可知,A为磷,B为三氯化磷,C为五氯化磷,x为氯气;依据磷单质分子式为P4分析共价键数,三氯化磷是共价化合物,写出电子式;
②X与水反应是氯气和水反应生成盐酸和次氯酸,次氯酸是弱电解质;
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生,则A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,x为二氧化碳;
①A为氢氧化钠使钠离子和氢氧根离子构成,据此分析化学键类型;
②C为NaHCO3,碳酸氢根离子水解大于电离,溶液呈碱性。
【详解】
若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,x为氢氧化钠。
、B、C中含有的同一种常见金属元素为Al,在周期表中位置是第三周期,ⅢA族,向水中加入X氢氧化钠是碱,对水的电离平衡的影响是抑制;
的水溶液含有铝离子,C水溶液含有偏铝酸根,混合反应生成氢氧化铝沉淀,反应离子方程式为
;
若A为固态非金属单质,A与X同为第三周期元素,常温常压下C为白色固体,B分子中各原子最外层均为
结构,由转化关系可知,A为白磷,B为三氯化磷,C为五氯化磷,x为氯气;
是白磷,是正四面体结构,所以1molA单质中含共价键数目为6NA;B为三氯化磷,各原子都满足8电子稳定结构,三氯化磷B的电子式为
;
为
,与水反应,生成次氯酸和盐酸,反应的离子方程式为:
;
若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生,则A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,x为二氧化碳;
为氢氧化钠,属于离子化合物,钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成1对共用电子对,为共价键,属于A中所含有的化学键是离子键、共价键;
为
,溶液中碳酸氢根离子水解大于电离,溶液呈碱性,溶液中离子浓度由小到大的顺序是:
。
【点睛】
解无机推断题常见思维方法:
①正向思维:
根据题设条件,结合有关的化学知识,依题目的意思,按一定的层次结构逐步推理,从而得出结论;②逆向推理:
以最终产物(或题中某一明显特征)为起点,层层逆推,以求得结论;③猜想论证:
先根据题意凭直觉猜想初步得出结论然后将结论代入到题中去验证,若与题中所给条件、题意吻合,即为答案;④综合分析:
根据题设条件、过程产物、最终产物的特征、反应规律、数据等进行综合分析,逐步得出结论。
3.先有一瓶无色澄清溶液,可能由Na+、K+、NH4+、Fe2+、SO42-、I-、CO32-、Cl-、SO32-、MnO4-中的几种组成,请根据以下实验步骤及现象回答下列问题:
步骤一:
取适量待测液,加入NaOH溶液并加热,得到溶液A,并产生刺激性气味的气体;
步骤二:
向溶液A中加入足量稀盐酸和BaCl2溶液,得到溶液B、白色沉淀及有刺激性气味的气体;
步骤三:
向溶液B中通入适量Cl2,得到黄褐色溶液C。
(1)下列有关该溶液说法正确的是________________(填字母)。
A.一定存在SO42-、I-、NH4+、SO32-
B.一定不存在Fe2+、CO32-、MnO4-
C.可能存在CO32-、Cl-、Na+、K+、
D.可用AgNO3溶液确认原溶液中是否存在Cl-
(2)步骤三得到黄褐色溶液的离子方程式是____________________。
(3)若向原溶液中先加入足量的盐酸,再加入足量的______________(填化学式)并加热,也能得出步骤一、步骤二相同的结论。
(4)对于溶液中还可能存在的阳离子,确认其存在的实验方法是__________________。
【答案】ACCl2+2I-=I2+2Cl-Ba(OH)2通过焰色反应,若呈现黄色,则含有Na+;透过蓝色钴玻璃片观察焰色反应,若呈现紫色,则含有K+
【解析】
【分析】
无色溶液可以知道一定不含Fe2+、MnO4-;
步骤一:
取适量待测液,加入NaOH溶液并加热,得到溶液A,并产生刺激性气味的气体,则气体为氨气,一定含NH4+;
步骤二:
向溶液A中加入足量稀盐酸和BaCl2溶液,得到溶液B、白色沉淀及有刺激性气味的气体,白色沉淀为BaSO4,刺激性气味的气体为SO2,则一定含有SO42-和SO32-;
步骤三:
向溶液B中通入适量Cl2,得到黄褐色溶液C,C中含碘单质,则原溶液一定含I-,以此来解答。
【详解】
无色溶液不含有紫色MnO4-、淡绿色Fe2+。
步骤一得到的刺激性气味的气体是氨气,表明原溶液含有NH4+。
步骤二得到的白色沉淀是硫酸钡,有刺激性气味的气体是二氧化硫,表明原溶液含有SO42-、SO32-。
步骤三得到的黄褐色溶液C是含有I2的溶液,表明原溶液含有I-。
(1)A.根据以上分析, 一定存在SO42-、I-、NH4+、SO32-,故A正确;
B. 根据以上分析,可能存在CO32-,故B错误;
C. 可能存在CO32-、Cl-、Na+、K+,故C正确;
D.SO42-、SO32-、Cl-均可与AgNO3溶液反应生成白色沉淀,所以不能用AgNO3溶液确认原溶液中是否存在Cl-,故D错误。
故答案为AC;
(2)步骤三得到黄褐色溶液的反应是氯气置换碘的反应,离子方程式是Cl2+2I-=I2+2Cl-,
故答案为Cl2+2I-=I2+2Cl-;
(3)向原溶液中加入足量盐酸,SO32-与盐酸反应生成有刺激性气味的气体。
再加入的物质既能与SO42-反应生成沉淀,又能与NH4+反应生成氨气,所以是氢氧化钡,化学式为Ba(OH)2,
故答案为Ba(OH)2;
(4)可通过焰色反应确定溶液中还可能存在的阳离子Na+、K+,实验方法是通过焰色反应,若呈现黄色,则含有Na+;透过蓝色钴玻璃片观察焰色反应,若呈现紫色,则含有K+,
故答案为通过焰色反应,若呈现黄色,则含有Na+;透过蓝色钴玻璃片观察焰色反应,若呈现紫色,则含有K+。
4.有关物质的转化关系如下图所示(部分物质与条件已略去)。
A、C、E、G是中学化学中常见的单质;通常状况下,E是密度最小的气体,G是黄绿色的气体,B是常见的无色液体,F是强碱且焰色反应火焰呈黄色,D是某种具有磁性的金属矿物的主要成分,K受热分解可生成红棕色固体。
请回答下列问题:
(1)D的化学式为____________。
(2)F的电子式为____________。
(3)写出J溶液中滴入稀硝酸反应的离子方程式:
________________________。
(4)写出常温下G与F的溶液反应的化学方程式:
________________________。
【答案】Fe3O4
3Fe2++4H++NO3-===3Fe3++NO↑+2H2OCl2+2NaOH===NaCl+NaClO+H2O
【解析】
【分析】
A、C、E、G是中学化学中常见的单质;通常状况下,E是密度最小的气体,为氢气,G是黄绿色的气体,为氯气,B是常见的无色液体,为水,F是强碱且焰色反应火焰呈黄色,为氢氧化钠,D是某种具有磁性的金属矿物的主要成分,为四氧化三铁,K受热分解可生成红棕色固体,为氢氧化铁。
则A为钠。
【详解】
E是密度最小的气体,为氢气,G是黄绿色的气体,为氯气,B是常见的无色液体,为水,F是强碱且焰色反应火焰呈黄色,为氢氧化钠,D是某种具有磁性的金属矿物的主要成分,为四氧化三铁,K受热分解可生成红棕色固体,为氢氧化铁。
则A为钠,C为铁。
I为氯化铁,J为氯化亚铁。
(1)D为四氧化三铁,化学式为Fe3O4。
(2)F为氢氧化钠,电子式为
。
(3)氯化亚铁滴入稀硝酸反应,生成铁离子和一氧化氮,离子方程式:
3Fe2++4H++NO3-===3Fe3++NO↑+2H2O。
(4)常温下氯气和氢氧化钠反应生成氯化钠和次氯酸钠和水,方程式为:
Cl2+2NaOH===NaCl+NaClO+H2O。
5.A、B、C、W均为中学常见的物质,它们之间有如图所示的转化关系(其他产物及反应条件已略去,反应可以在水溶液中进行)。
(1)若A、B、C三种物质的焰色反应均为黄色,A俗称苛性钠,W为无色无味气体,C受热分解可转化为B。
①向B溶液中通入W生成C的离子方程式为_______________。
②A溶液与C溶液反应的化学方程式为________________。
(2)若A、B、C、W四种物质均为气体,其中A、W为单质,C的摩尔质量为46g·mol-1.
①B的化学式为________________。
②实验室制取B时,_____________(填“能”或“不能”)用向上排空气法收集B。
③C与水反应的化学方程式为_____________________________。
(3)若A为淡黄色固体单质,W为气体单质,B、C均为酸性氧化物。
①由B生成C时,每生成1molC,消耗W的物质的量为_________________。
②C溶于水形成化合物D,在加热的情况下,D的浓溶液与A反应的化学方程式为__________。
【答案】CO32-+H2O+CO2=2HCO3-NaOH+NaHCO3=Na2CO3+H2ONO不能3NO2+H2O=2HNO3+NO0.5molS+2H2SO4(浓)=3SO2↑+2H2O
【解析】
【分析】
(1)若A、B、C的焰色反应均为黄色,则A、B、C中均含有钠元素,A俗称苛性钠,则A为NaOH,W为无色气体,C受热分解可以转化为B,由转化关系可知W为CO2,B为碳酸钠,C为碳酸氢钠,据此分析;
(2)若A、B、C、W均为气体,其中A、W为单质,C的摩尔质量为46g/mol,则C为NO2,由转化关系可知A为N2、W为O2、B为NO,据此分析;
(3)若A为淡黄色固体单质,则A为硫,W为气体单质,B、C为酸性氧化物,由转化关系可知W为O2、B为SO2、C为SO3,据此分析。
【详解】
(1)若A、B、C的焰色反应均为黄色,则A、B、C中均含有钠元素,A俗称苛性钠,则A为NaOH,W为无色气体,C受热分解可以转化为B,由转化关系可知W为CO2,B为碳酸钠,C为碳酸氢钠,据此分析:
①向碳酸钠溶液中通入CO2生成碳酸氢钠的离子方程式为:
CO32-+H2O+CO2=2HCO3-;
②NaOH溶液和碳酸氢钠溶液反应的化学方程式为:
NaOH+NaHCO3=Na2CO3+H2O。
故答案为CO32-+H2O+CO2=2HCO3-;NaOH+NaHCO3=Na2CO3+H2O;
(2)若A、B、C、W均为气体,其中A、W为单质,C的摩尔质量为46g/mol,则C为NO2,由转化关系可知A为N2、W为O2、B为NO,据此分析:
①B的化学式为NO;
②因为NO和空气中的O2反应生成NO2,则实验室制取B(NO)时,不能用向上排气法收集B;
③NO2与水反应的化学方程式为:
3NO2+H2O=2HNO3+NO。
故答案为①NO;②不能;③3NO2+H2O=2HNO3+NO;
(3)若A为淡黄色固体单质,则A为硫,W为气体单质,B、C为酸性氧化物,由转化关系可知W为O2、B为SO2、C为SO3,据此分析:
①由SO2生成SO3的化学方程式为2SO2+O2
2SO3,每生成1molC(SO3),消耗W(O2)的物质的量为0.5mol;
②SO3溶于水生成化合物D(H2SO4),在加热条件下,浓硫酸与硫发生氧化还原反应,生成二氧化硫和水,化学方程式为:
S+2H2SO4(浓)
3SO2↑+2H2O。
故答案为0.5mol;S+2H2SO4(浓)
3SO2↑+2H2O。
【点睛】
本题考查元素化合物的推断,涉及Na、N、S元素单质及其化合物性质与转化,需要学生熟练掌握元素化合物知识,把握反应的规律,注意相关基础知识的积累。
6.如图中的每一方框内表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且A与C物质的量之比为1:
1,B为常见液体,F为红棕色气体。
试回答下列问题:
(1)X是_____;F是_____。
(写化学式)
(2)写出G→E反应的化学方程式并用双线桥标出电子转移的方向和数目_________。
(3)G与Cu的反应中,G表现__________性质。
(4)写出X→A的离子方程式:
__________。
(5)以C、B、D为原料可生产G,若使amolC的中心原子完全转化到G中,理论上至少需要D______mol。
【答案】NH4HCO3NO2
酸性和氧化性H++HCO3-=H2O+CO2↑2a
【解析】
【分析】
X能与盐酸、氢氧化钠反应都生成气体,应为弱酸铵盐,与盐酸反应得到气体A,A能与过氧化钠反应生成气体D,则A为CO2、D为O2,X与氢氧化钠反应得到气体C为NH3,A与C物质的量之比为1:
1,且B为常见液体,可以推知X为NH4HCO3、B为H2O,C(NH3)与D(O2)反应生成E为NO,E与氧气反应生成F为NO2,F与水反应得到G能与Cu反应生成NO、NO2,则G为HNO3,据此解答。
【详解】
X能与盐酸、氢氧化钠反应都生成气体,应为弱酸铵盐,与盐酸反应得到气体A,A能与过氧化钠反应生成气体D,则A为CO2、D为O2,X与氢氧化钠反应得到气体C为NH3,A与C物质的量之比为1:
1,且B为常见液体,可以推知X为NH4HCO3、B为H2O,C(NH3)与D(O2)反应生成E为NO,E与氧气反应生成F为NO2,F与水反应得到G能与Cu反应生成NO、NO2,则G为HNO3。
(1)由上述分析可知,X是NH4HCO3;F是NO2;
(2)稀HNO3与Cu反应产生Cu(NO3)2、NO、H2O,反应方程式为:
3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O,用双线桥法表示电子转移为:
(3)Cu与硝酸反应生成硝酸铜与氮的氧化物,反应中N元素的化合价部分为不变化,部分降低,故硝酸表现酸性、氧化性;
(4)NH4HCO3与HCl溶液反应生成NH4Cl、H2O、CO2,反应的离子方程式为:
H++HCO3-=H2O+CO2↑;
(5)以NH3、H2O、O2为原料可生产HNO3,使amolNH3完全转化为HNO3,根据电子转移守恒,理论上至少需要氧气的物质的量=n(O2)=
=2amol。
【点睛】
本题考查无机物推断,注意根据X既能与盐酸又能与氢氧化钠反应生成气体及A能与过氧化钠反应生成气体进行推断,在反应过程中要注意利用电子转移守恒解答。
7.下图是由短周期元素组成的一些单质及其化合物之间的转化关系图。
各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。
(1)物质G的化学式:
__________________。
(2)物质B的名称:
____________________。
(3)写出A→D的化学方程式:
_______________________________________________;
F→G的化学方程式:
______________________________________________________;
G→E的离子方程式:
______________________________________________________。
【答案】HNO3氮气2CO2+2Na2O2=2Na2CO3+O23NO2+H2O=2HNO3+NO3Cu+8H++2NO3–=3Cu2++2NO↑+4H2O
【解析】
【分析】
根据题中各物质转化关系可以知道,无色无味气体A与过氧化钠反应的得到气体D,则A为CO2,D为O2,C是使湿润的红色石蕊试纸变蓝的气体,则C为NH3,故B为N2,E为NO,F为NO2,M是最常见的无色液体,应为H2O,由转化关系可以知道G为HNO3,据此答题。
【详解】
(1)由上述分析可以知道,物质G的化学式为:
HNO3,
因此,本题正确答案是:
HNO3;
(2)物质B为N2,其名称为:
氮气,
因此,本题正确答案是:
氮气;
(3)A为CO2,D为O2,CO2和过氧化钠反应生成碳酸钠和氧气,化学方程式:
2CO2+2Na2O2=2Na2CO3+O2,
因此,本题正确答案是:
2CO2+2Na2O2=2Na2CO3+O2;
F为NO2,NO2和水反应生成硝酸和一氧化氮,化学方程式为3NO2+H2O=2HNO3+NO,
因此,本题正确答案是:
3NO2+H2O=2HNO3+NO;
G为HNO3,稀硝酸可与铜反应生成NO,反应的离子方程式为3Cu+8H++2NO3–=3Cu2++2NO↑+4H2O,
因此,本题正确答案是:
3Cu+8H++2NO3–=3Cu2++2NO↑+4H2O。
【点睛】
本题考查无机物的推断,涉及N、Na元素化合物知识,C和M的性质及A能与过氧化钠反应是推断突破口,解题时要注意离子方程式的书写原则和方法。
8.Ⅰ.A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
(1)若A为短周期的金属单质,D为气态单质,0.1mol/LC溶液的pH=13。
该反应的离子方程式为_______________________________。
(2)若A的溶液能使淀粉溶液变蓝,C为非金属氧化物,能使品红溶液褪色,该反应的化学方程式为_____________________________。
(3)若A、C、D、E均为化合物,E为白色沉淀,且A、C、E含有同