专题20 化学技术 工艺流程届高三名校化学试题解析分项汇编上海版解析版.docx
《专题20 化学技术 工艺流程届高三名校化学试题解析分项汇编上海版解析版.docx》由会员分享,可在线阅读,更多相关《专题20 化学技术 工艺流程届高三名校化学试题解析分项汇编上海版解析版.docx(29页珍藏版)》请在冰豆网上搜索。
专题20化学技术工艺流程届高三名校化学试题解析分项汇编上海版解析版
名校联考试题分类汇编(上海版)
填空题:
专题二十化学技术工艺流程
1、(本题共12分)
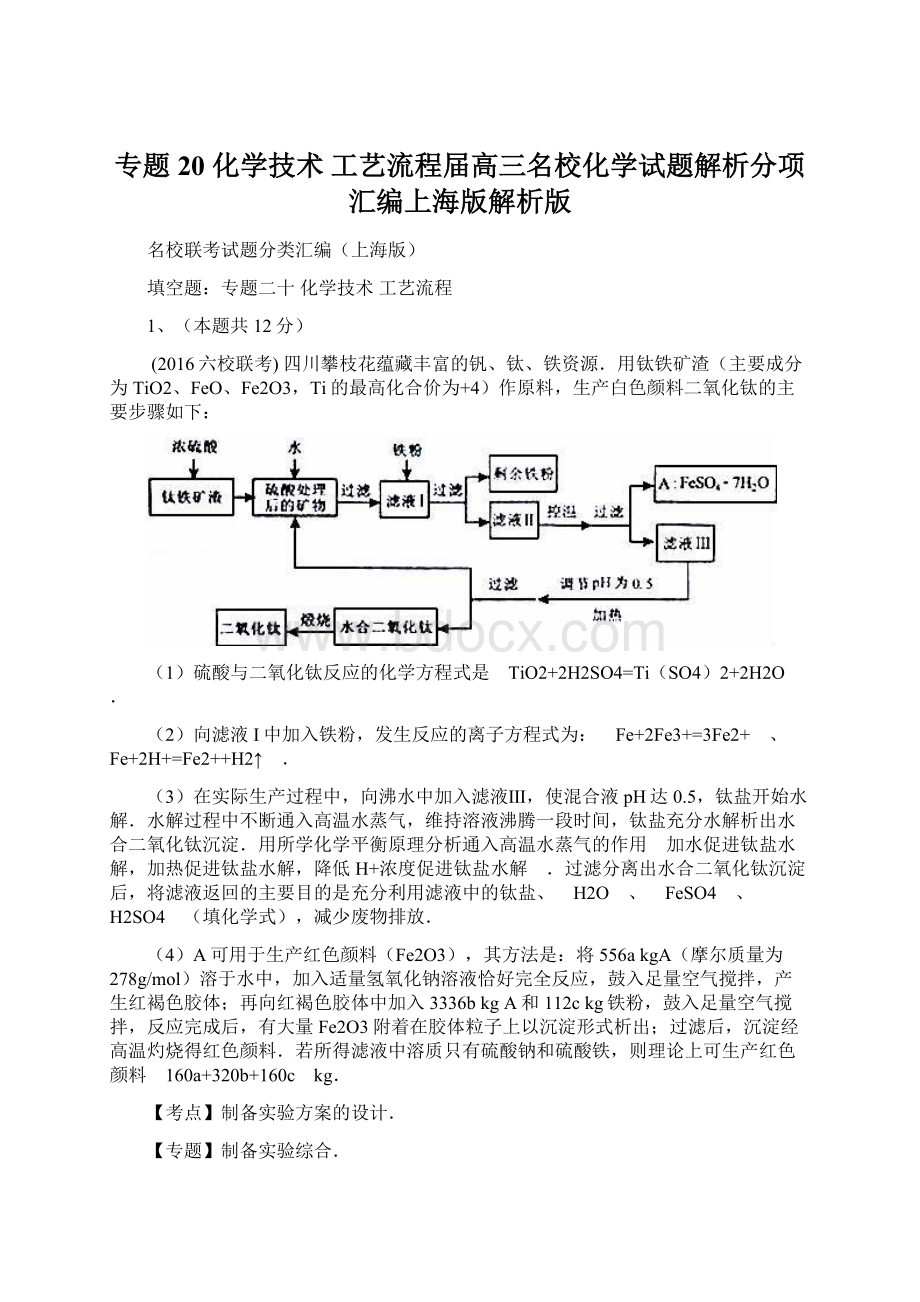
(2016六校联考)四川攀枝花蕴藏丰富的钒、钛、铁资源.用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如下:
(1)硫酸与二氧化钛反应的化学方程式是 TiO2+2H2SO4=Ti(SO4)2+2H2O .
(2)向滤液I中加入铁粉,发生反应的离子方程式为:
Fe+2Fe3+=3Fe2+ 、 Fe+2H+=Fe2++H2↑ .
(3)在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解.水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀.用所学化学平衡原理分析通入高温水蒸气的作用 加水促进钛盐水解,加热促进钛盐水解,降低H+浓度促进钛盐水解 .过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、 H2O 、 FeSO4 、 H2SO4 (填化学式),减少废物排放.
(4)A可用于生产红色颜料(Fe2O3),其方法是:
将556akgA(摩尔质量为278g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中加入3336bkgA和112ckg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料.若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料 160a+320b+160c kg.
【考点】制备实验方案的设计.
【专题】制备实验综合.
【分析】
(1)依据流程分析,硫酸与二氧化钛反应是发生的复分解反应;
(2)钛铁矿渣(主要成分为TiO2、FeO、Fe2O3,Ti的最高化合价为+4)作原料溶解于硫酸过滤后得到滤液中含有铁离子、亚铁离子、过滤的硫酸,加入铁粉和铁离子反应,和酸反应;
(3)影响钛盐水解的因素有浓度、温度等,由Ti(SO4)2水解呈酸性,知沸水、高温水蒸气、维持溶液沸腾等均为升温,沸水、高温水蒸气即加水且降低H+浓度,故高温水蒸气使水解平衡移动的作用是:
加水、加热、降低H+浓度均可促进钛盐水解;
(4)考虑最后溶质是只有硫酸钠和硫酸铁,根据开始加入A为2a×103mol加入适量氢氧化钠溶液恰好完全反应.,说明加入氢氧化钠的物质的量为4a×103mol,后来又加入12b×103mol的A,和2c×103mol的铁.根据电荷守恒,溶质中硫酸钠消耗硫酸根离子为2a×103mol,.而溶液中加入的硫酸根离子物质的量共计为(2a+12b)×103mol,这样剩下的硫酸根就与铁离子结合.可知消耗铁离子为8b×103mol,根据铁元素守恒;
【解答】解:
(1)依据酸的通性,可以与金属氧化物反应,又知道TI的化合价,可以写出化学方程式为:
TiO2+2H2SO4=Ti(SO4)2+2H2O,
故答案为:
;
(2)加入浓硫酸后,浓硫酸可以氧化亚铁离子,再加入铁粉,铁粉可以还原铁离子,铁粉还可以与溶液中的H+反应,反应的离子方程式为:
Fe+2Fe3+=3Fe2+;Fe+2H+=Fe2++H2↑,
故答案为:
Fe+2Fe3+=3Fe2+;Fe+2H+=Fe2++H2↑;
(3)影响钛盐水解的因素有浓度、温度等,由Ti(SO4)2水解呈酸性,知沸水、高温水蒸气、维持溶液沸腾等均为升温,沸水、高温水蒸气即加水且降低H+浓度,故高温水蒸气使水解平衡移动的作用是:
加水、加热、降低H+浓度均可促进钛盐水解.根据该工艺流程知:
滤液Ⅲ的主要成分为大量的钛盐、溶解的硫酸亚铁、少量的硫酸(混合液pH达0.5)等,钛盐水解后过滤去水合二氧化钛,得到的滤液中含有未水解的钛盐及FeSO4、H2SO4、H2O等.
故答案为:
加水促进钛盐水解,加热促进钛盐水解,降低H+浓度促进钛盐水解;H2O;FeSO4;H2SO4;
(4)依题意A与适量氢氧化钠溶液恰好完全反应,FeSO4+2NaOH=Na2SO4+Fe(OH)2↓,根据开始加入A为2a×103mol,可知加入氢氧化钠为4a×103mol;后来又加入12b×103mol的A和2c×103mol的铁,由Na2SO4、FeSO4、Fe2(SO4)3、Fe2O3等化学式的定量组成和守恒思想分别可求得以下各量:
利用Na+离子守恒,n(NaOH)=2n(Na2SO4),可知Na2SO4物质的量为2a×103mol;利用SO42﹣离子守恒,n(FeSO4)=n(Na2SO4)+3n[Fe2(SO4)3],可知Fe2(SO4)3物质的量为(2a+12b﹣2a)×103mol×
=4b×103mol;利用Fe元素守恒,n(FeSO4)+n(Fe)=2n[Fe2(SO4)3]+2n(Fe2O3),可知n(Fe2O3)=(2a+12b+2c﹣4b×2)×103mol×
=(a+2b+c)×103mol,计算得m(Fe2O3)=(160a+320b+160c)kg,
故答案为:
160a+320b+160c.
【点评】本题考查制备方案的设计,题目难度中等,注意解答化工工艺流程题要全面分析理解流程中各个步骤各有何作用(即各工艺流程的目的是什么)、依次涉及何种反应原理、原料、产品、杂质、副产品等成分是什么、这些物质间如何进行转化等,在此基础上,根据各设问,步步深入,进行快速解答,试题培养了学生的分析能力及化学实验能力.
2、(本题共12分)
(2016虹口二模)(12分)无水硫酸铜在加热至650℃时开始分解生成氧化铜和气体.某活动小组通过实验,探究不同温度下气体产物的组成.实验装置如下:
每次实验后均测定B、C质量的改变和E中收集到气体的体积.实验数据如下(E中气体体积已折算至标准状况):
实验组别
温度
称取CuSO4质量/g
B增重质量/g
C增重质量/g
E中收集到气体/mL
①
T1
0.640
0.320
0
0
②
T2
0.640
0
0.256
V2
③
T3
0.640
0.160
Y3
22.4
④
T4
0.640
X4
0.192
33.6
(1)实验过程中A中的现象是 白色固体变黑 .D中无水氯化钙的作用是 吸收水蒸气,防止影响C的质量变化 .
(2)在测量E中气体体积时,应注意先 冷却至室温 ,然后调节水准管与量气管的液面相平,若水准管内液面高于量气管,测得气体体积 偏小 (填“偏大”、“偏小”或“不变”).
(3)实验①中B中吸收的气体是 SO3 .实验②中E中收集到的气体是 O2 .
(4)推测实验②中CuSO4分解反应方程式为:
2CuSO4
2CuO+2SO2↑+O2↑ .
(5)根据表中数据分析,实验③中理论上C增加的质量Y3= 0.128 g.
(6)结合平衡移动原理,比较T3和T4温度的高低并说明理由 T4温度更高,因为SO3分解为SO2和O2是吸热反应,温度高有利于生成更多的O2 .
考点:
性质实验方案的设计..
专题:
实验设计题.
分析:
(1)根据无水硫酸铜在加热至650℃时开始分解生成氧化铜和气体分析A中的现象,根据碱石灰和无水氯化钙的作用分析;
(2)气体温度较高,气体体积偏大,应注意先冷却至室温,若水准管内液面高于量气管,说明内部气压大于外界大气压,测得气体体积偏小;
(3)实验中B中浓硫酸的作用是吸收三氧化硫气体,C的作用是吸收二氧化硫,E的作用是收集到氧气;
(4)0.64g硫酸铜的物质的量为
=0.004mol,分解生成氧化铜的质量为:
0.004mol×80g/mol=0.32g;SO2的质量为:
0.256g,物质的量为:
=0.004mol,氧气的质量为:
0.64﹣0.32﹣0.256=0.064g,物质的量为:
=0.002mol,CuSO4、CuO、SO2、O2的物质的量之比等于2:
2:
2;1,则实验②中CuSO4分解反应方程式为2CuSO4
2CuO+2SO2↑+O2↑;
(5)0.64g硫酸铜的物质的量为
=0.004mol,分解生成氧化铜的质量为:
0.004mol×80g/mol=0.32g;SO3的质量为:
0.16g,氧气的质量为:
32=0.032g,根据质量守恒实验③中理论上C增加的质量Y3=0.64﹣0.32﹣0.16﹣0.032=0.128g;
(6)根据表中实验③④的数据可知,T4温度生成氧气更多,因为SO3分解为SO2和O2是吸热反应,温度高有利于生成更多的O2.
解答:
解:
(1)因为无水硫酸铜在加热至650℃时开始分解生成氧化铜和气体,故实验过程中A中的现象是白色固体变黑,因为碱石灰能够吸水,D中无水氯化钙的作用是吸收水蒸气,防止装置E中的水进入装置C,影响C的质量变化,故答案为:
白色固体变黑;吸收水蒸气,防止影响C的质量变化;
(2)加热条件下,气体温度较高,在测量E中气体体积时,应注意先冷却至室温,若水准管内液面高于量气管,说明内部气压大于外界大气压,测得气体体积偏小,故答案为:
冷却至室温偏小;
(3)实验中B中浓硫酸的作用是吸收三氧化硫气体,C的作用是吸收二氧化硫,E的作用是收集到氧气,故答案为:
SO3;O2;
(4)0.64g硫酸铜的物质的量为
=0.004mol,分解生成氧化铜的质量为:
0.004mol×80g/mol=0.32g;SO2的质量为:
0.256g,物质的量为:
=0.004mol,氧气的质量为:
0.64﹣0.32﹣0.256=0.064g,物质的量为:
=0.002mol,CuSO4、CuO、SO2、O2的物质的量之比等于2:
2:
2;1,则实验②中CuSO4分解反应方程式为2CuSO4
2CuO+2SO2↑+O2↑,故答案为:
2CuSO4
2CuO+2SO2↑+O2↑;
(5)0.64g硫酸铜的物质的量为
=0.004mol,分解生成氧化铜的质量为:
0.004mol×80g/mol=0.32g;SO3的质量为:
0.16g,氧气的质量为:
32=0.032g,实验③中理论上C增加的质量Y3=0.64﹣0.32﹣0.16﹣0.032=0.128g.故答案为:
0.128;
(6)根据表中实验③④的数据可知,T4温度生成氧气更多,因为SO3分解为SO2和O2是吸热反应,温度高有利于生成更多的O2,故T4温度更高,故答案为:
T4温度更高,因为SO3分解为SO2和O2是吸热反应,温度高有利于生成更多的O2.
点评:
本题考查物质的组成和实验数据的处理,做题时注意把握实验基础知识,充分利用有关数据进行计算,本题具有一定难度.
3、(本题共12分)
(2016虹口二模)(12分)活性氧化锌是一种多功能性的新型无机材料.某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如下:
已知各相关氢氧化物沉淀pH范围如下表所示:
Zn(OH)2
Fe(OH)2
Fe(OH)3
Cu(OH)2
开始沉淀pH
5.4
7.0
2.3
4.7
完全沉淀pH
8.0
9.0
4.1
6.7
完成下列填空
(1)步骤I中所需25%稀硫酸可用98%浓硫酸(密度为1.84g/mL)配制,所需的仪器除玻璃棒、烧杯外,还需要 bd (选填编号)
A.电子天平B.量筒C.容量瓶D.胶头滴管
(2)步骤II中通过加入KMnO4氧化,并用ZnO调节pH,可以除去含铁杂质.检验沉淀是否完全的实验操作是 取少量溶液,滴加KSCN溶液,无颜色变化 .调节pH的适宜范围是 4.1~4.7 .
(3)步骤III中加入Zn粉的作用是:
① 除去溶液中的Cu2+ ;②进一步调节溶液pH.
(4)步骤IV中使用热NH4HCO3溶液能促进Zn2+转化为沉淀,但温度不宜过高,其原因可能是 NH4HCO3分解导致损失 .
(5)步骤V在 坩埚 (填仪器名称)中进行,已知碱式碳酸锌的化学式为Zn5(OH)6(CO3)2,请写出发生反应的化学方程式:
Zn5(OH)6(CO3)2
5ZnO+2CO2↑+3H2O .判断已分解完全的操作是 恒重操作 .
(6)用如下方法测定所得活性氧化锌的纯度:
①取1.000g活性氧化锌,用15.00mL1.000mol/L硫酸溶液完全溶解
②用浓度为0.500mol/L的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL.
假设杂质不参与反应,则所得活性氧化锌的纯度为 97.2% .
若在滴定时,实际操作中过量半滴(1mL溶液为25滴),则本次滴定的相对误差为 0.17% .
考点:
制备实验方案的设计;物质分离和提纯的方法和基本操作综合应用..
专题:
实验设计题.
分析:
粗氧化锌(含铁、铜的氧化物)加入稀硫酸溶解过滤得到溶液中含有硫酸亚铁、硫酸铜、硫酸锌,加入高锰酸钾溶液氧化亚铁离子为铁离子,加入氧化锌调节溶液PH沉淀铁离子和铜离子,加入锌还原铜离子为铜单质,过滤得到硫酸锌,碳化加入碳酸氢铵沉淀锌离子生成碱式碳酸锌,加热分解生成活性氧化锌;
(1)依据溶液配制过程分析需要的仪器有玻璃棒、烧杯、量筒、胶头滴管等;
(2)检验沉淀是否完全可以利用铁离子遇到硫氰酸钾溶液变红色设计验证,依据沉淀PH范围调节溶液PH使铁离子和铜离子沉淀;
(3)步骤III中加入Zn粉的作用是含有铜离子,调节溶液PH除净铜离子;
(4)碳酸氢铵受热易分解分析;
(5)固体分解再坩埚中进行;碱式碳酸锌的化学式为Zn5(OH)6(CO3)2,分解生成氧化锌、二氧化碳和水,结合原子守恒配平书写得到反应的化学方程式;
(6)依据滴定所需氢氧化钠溶液物质的量计算剩余硫酸物质的量,计算得到与氧化锌反应的硫酸物质的量计算得到氧化锌物质的量,计算纯度;1mL溶液为25滴,半滴的体积为
mL;相对误差=
计算得到;
解答:
解:
粗氧化锌(含铁、铜的氧化物)加入稀硫酸溶解过滤得到溶液中含有硫酸亚铁、硫酸铜、硫酸锌,加入高锰酸钾溶液氧化亚铁离子为铁离子,加入氧化锌调节溶液PH沉淀铁离子和铜离子,加入锌还原铜离子为铜单质,过滤得到硫酸锌,碳化加入碳酸氢铵沉淀锌离子生成碱式碳酸锌,加热分解生成活性氧化锌;
(1)步骤I中所需25%稀硫酸可用98%浓硫酸(密度为1.84g/mL)配制,是粗略配制在烧杯内稀释配制,所需的仪器除玻璃棒、烧杯外,还需要仪器有量筒、胶头滴管等;
故答案为:
bd;
(2)检验沉淀是否完全可以利用铁离子遇到硫氰酸钾溶液变红色设计验证,取少量溶液,滴加KSCN溶液,无颜色变化说明沉淀完全,依据沉淀PH范围调节溶液PH使铁离子和铜离子沉淀,调节溶液PH为4.1~4.7;
故答案为:
取少量溶液,滴加KSCN溶液,无颜色变化,4.1~4.7;
(3)步骤III中加入Zn粉的作用是含有铜离子,进一步调节溶液pH除净铜离子;
故答案为:
除去溶液中的Cu2+;
(4)步骤IV中使用热NH4HCO3溶液能促进Zn2+转化为沉淀,但温度不宜过高,其原因可能是碳酸氢铵受热易分解;
故答案为:
NH4HCO3分解导致损失;
(5)固体分解在坩埚中进行;碱式碳酸锌的化学式为Zn5(OH)6(CO3)2,分解生成氧化锌、二氧化碳和水,结合原子守恒配平书写得到反应的化学方程式为:
Zn5(OH)6(CO3)2
5ZnO+2CO2↑+3H2O;判断已分解完全的操作是称量至恒重;
故答案为:
坩埚、Zn5(OH)6(CO3)2
5ZnO+2CO2↑+3H2O,恒重操作;
(6)依据滴定所需氢氧化钠溶液物质的量计算剩余硫酸物质的量,计算得到与氧化锌反应的硫酸物质的量计算得到氧化锌物质的量,与氧化锌反应的氢离子物质的量=0.0150L×1.000mol/L×2﹣0.500mol/L×0.0120L=0.024mol,ZnO+2H+=Zn2++H2O
计算纯度=
×100%=97.2%;
1mL溶液为25滴,半滴的体积为
mL;相对误差=
×100%=0.17%;
故答案为:
97.2%;0.17%;
点评:
本题考查了物质制备和分离的实验过程分析判断,实验操作和定量计算式解题关键,题目难度中等.
4、(2016长宁一模)活性炭吸附法是工业提碘的主要方法之一,其流程如下:
完成下列填空:
(1)酸性条件下,NaNO2溶液只能将I﹣氧化为I2,同时生成NO.写出反应①的离子方程式 2NO2﹣+4H++2I﹣═2NO+I2+2H2O .
(2)氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中的I﹣选择了价格并不便宜的亚硝酸钠,可能的原因是 氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质 .
(3)反应②发生时,溶液底部有紫黑色固体生成,有时溶液上方产生紫色气体,产生这种现象的原因是 碘在水中的溶解度不大,且易升华 .
(4)流程中,碘元素经过了I﹣→I2→I﹣、IO3﹣→I2的变化过程,这样反复操作的目的是 富集碘元素 .
(5)流程中所用的NaHSO3溶液显弱酸性,源于NaHSO3存在以下两种程度不同的平衡体系:
①水解 HSO3﹣+H2O⇌H2SO3+OH﹣ 和电离 HSO3﹣⇌SO32﹣+H+ (用离子方程式表示)
②如向0.1mol/L的NaHSO3溶液中分别加入以下物质,回答问题:
加入少量Ba(OH)2固体,水解平衡向 逆反应方向 移动;加入少量NaClO固体,溶液的pH 减小 (选填:
增大、减小、不变).
【考点】物质分离和提纯的方法和基本操作综合应用;性质实验方案的设计.
【专题】无机实验综合.
【分析】1)亚硝酸钠具有氧化性,碘离子具有还原性,酸性条件下,二者发生氧化还原反应生成一氧化氮和碘和水;
(2)氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质;
(3)碘在水中的溶解度不大,且易升华;
(4)流程中,碘元素经过了I2→I﹣、IO3﹣→I2的变化过程,这样反复的原因是富集碘元素;
(5)①NaHSO3溶液存在以下的平衡:
①水解:
HSO3﹣+H2O⇌H2SO3+OH﹣和②电离:
HSO3﹣⇌SO32﹣+H+;
②加入Ba(OH)2,OH﹣浓度增大,平衡逆向移动,加入少量NaClO固体,发生氧化还原反应生成硫酸和氯化钠,溶液pH减小.
【解答】解:
(1)亚硝酸钠具有氧化性,碘离子具有还原性,酸性条件下,二者发生氧化还原反应生成一氧化氮和碘和水,离子反应方程式为:
2NO2﹣+4H++2I﹣═2NO+I2+2H2O,
故答案为:
2NO2﹣+4H++2I﹣═2NO+I2+2H2O;
(2)氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质,故工业上氧化卤水中I﹣选择了价格并不便宜的亚硝酸钠;
故答案为:
氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质;
(3)反应②发生时,溶液底部有紫黑色的固体生成,有时溶液上方产生紫色的气体.解释产生这种现象的原因碘在水中的溶解度不大,且易升华,所以,反应②需要在水浴加热条件下进行;
故答案为:
碘在水中的溶解度不大,且易升华;
(4)流程中,碘元素经过了I2→I﹣、IO3﹣→I2的变化过程,这样反复的原因是富集碘元素;
故答案为:
富集碘元素;
(5)①NaHSO3溶液显弱酸性,是因为该溶液中存在以下的平衡:
①水解:
HSO3﹣+H2O⇌H2SO3+OH﹣和②电离:
HSO3﹣⇌SO32﹣+H+,电离程度大于水解程度;
故答案为:
HSO3﹣+H2O⇌H2SO3+OH﹣;HSO3﹣⇌SO32﹣+H+;
②加入Ba(OH)2,OH﹣浓度增大,平衡逆向移动,加入少量NaClO固体,发生氧化还原反应生成硫酸和氯化钠,溶液pH减小,
故答案为:
逆反应方向;减小.
【点评】本题考查卤素、含硫物质的性质和应用、氧化还原反应、电解质溶液,涉及弱电解质的电离和盐类的水解、守恒关系的应用,平衡分析和溶液中离子浓度关系判断是解题关键,题目难度中等.
5.(2014静安二模)(12分)最近有科学家提出“绿色自由”的构想:
把含有CO2的空气吹入K2CO3溶液中,然后再用高温水气分解出CO2,经与H2化合后转变为甲醇燃料.
(1)在整个生产过程中饱和K2CO3溶液的作用是 富集CO2 ;不用KOH溶液的理由是 生成的K2CO3难分解产生CO2 .
(2)在合成塔中,每44gCO2与足量H2完全反应生成甲醇时,可放出49.5kJ的热量,试写出合成塔中发生反应的热化学方程式 CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=﹣49.5KJ/mol ;转化过程中可循环利用的物质除了K2CO3外,还有 水蒸气 .
(3)请评述合成时选择2×105Pa的理由 适当加压有利于提高反应速率和原料利用率,但压强太高增大成本 .
(4)BaCO3的溶解平衡可以表示为BaCO3(s)⇌Ba2++CO32﹣
①写出平衡常数表达式 K=c(Ba2+)c(CO32﹣) ;
②用重量法测定空气中CO2的体积分数时,选用Ba(OH)2而不是Ca(OH)2为沉淀剂,原因之一是:
25℃时,BaCO3的溶解平衡常数K=2.58×10﹣9,而CaCO3的溶解平衡常数K=4.96×10﹣9;原因之二是 BaCO3的式量大,相对误差小 .
(5)某同学很快就判断出以下中长石风化的离子方程式未配平:
4Na0.5Ca0.5Al1.5Si2.5O6+6CO2+17H2O→2Na++2Ca2++5HCO3﹣+4H4SiO4+3Al2SiO5(OH)4
该同学判断的角度是 未配平两边电荷数 .
(6)甲醇可制成新型燃料电池,总反应为:
2CH3OH+3O2+4KOH→2K2CO3+6H2O该电池负极的电极反应式为:
CH3OH﹣6e+8OH﹣→CO32﹣+6H2O则正极的电极反应式为:
O2+2H2O+4e→4OH﹣ .
考点:
物质分离和提纯的方法和基本操作综合应用;化学电源新型电池;难溶电解质的溶解平衡及沉淀转化的本质;制备实验方案的设计..
专题:
实验设计题;基本概念与基本理论.
分析:
(1)碳酸氢钾不稳定,加热时分解生成碳酸钾和二氧化碳、水,碳酸钾不分解;
(2)4.4kgCO2的物质的量是100mol,100mol二氧化碳和足量氢气反应放出4947KJ热量,据此计算1mol二氧化碳与足量氢气反应放出的热量,从而写出其热化学反应方程式;根据合成甲醇的方程可知,反应生成甲醇和水蒸气,水蒸气可以给碳酸氢钾分解提供能量;
(3)合成甲醇的反应为体积减小的反应,增大压强平衡正移;
(4)①溶解平衡方程式书写平衡常数表达式;
②重量法测定空气中CO2的体积分数,要求称量准确,误差小;
(5)书写离子方程式要注意原子守恒和电荷守恒;
(6)碱性甲醇燃料电池中,甲醇在负极失电子,氧气在正极得电子.
解答:
解:
(1)在整个生产过程中饱和K2CO3溶液的作用是富集二氧化碳,二氧化碳和饱和的碳酸钾溶液反应生成碳酸氢钾,碳酸氢钾不稳定,加热时分解生成碳酸钾、二氧化碳和水,KOH溶液与二氧化碳是碳酸钾,K2CO3难分解产生CO2,
故答案为:
富集CO2;生成的K2CO3难分解产生CO2;
(2)44gCO2的物质的量是1mol,1mol二氧化碳和足量氢气反应放出49.5KJ热量,所以其热化学反应方程式为:
CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=﹣49.5KJ/mol;根据合成甲醇的方程可知,反应生成甲醇和水蒸气,水蒸气可以给碳酸氢钾分解提供能量,所以转化过程中可循环利用的物质除了K2CO3外,还有水蒸气;
故答案为:
CO2(g)+3H2(g)=CH3