物理化学第五版第三章答案.docx
《物理化学第五版第三章答案.docx》由会员分享,可在线阅读,更多相关《物理化学第五版第三章答案.docx(21页珍藏版)》请在冰豆网上搜索。
物理化学第五版第三章答案
物理化学第五版第三章答案
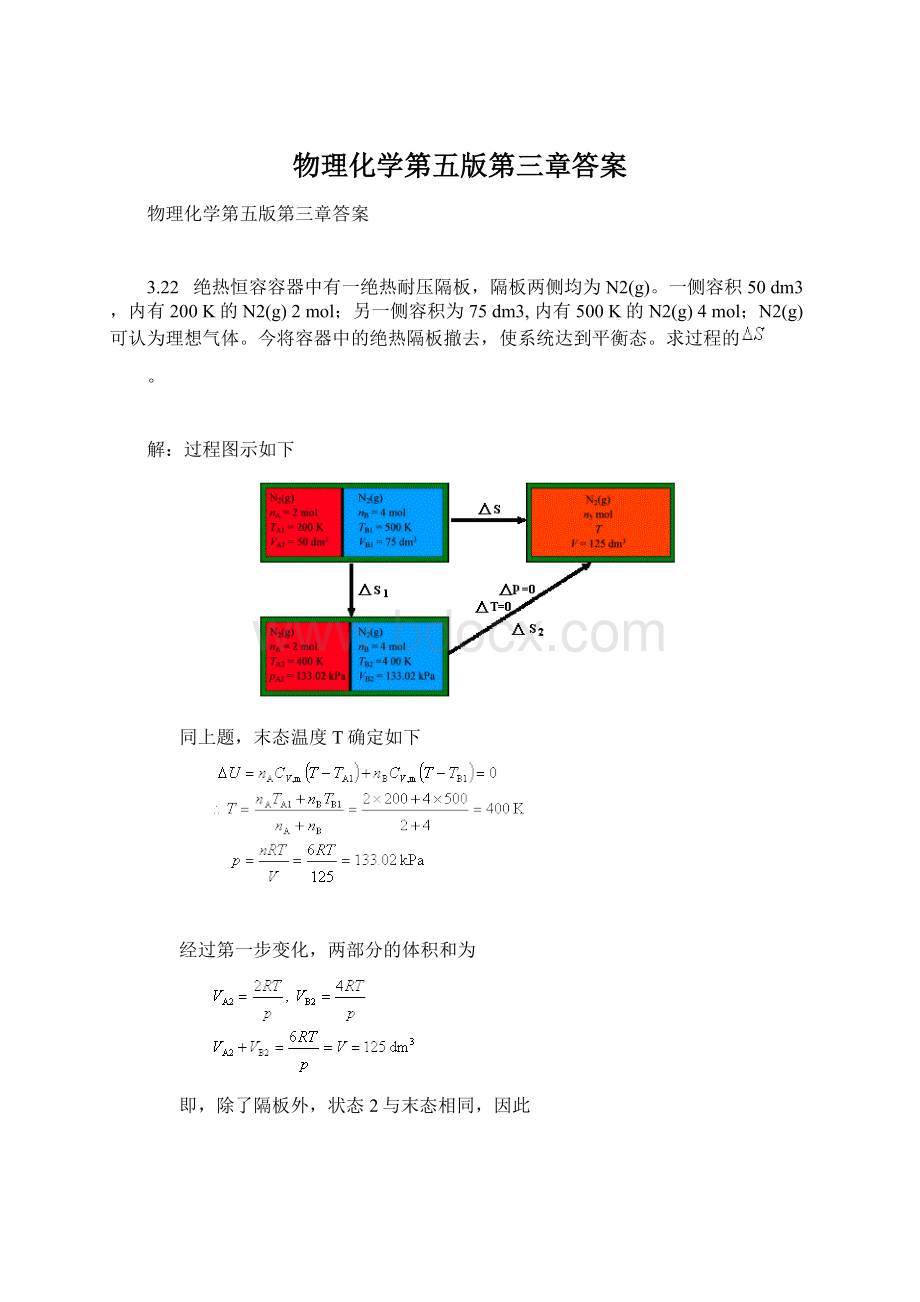
3.22 绝热恒容容器中有一绝热耐压隔板,隔板两侧均为N2(g)。
一侧容积50dm3,内有200K的N2(g)2mol;另一侧容积为75dm3,内有500K的N2(g)4mol;N2(g)可认为理想气体。
今将容器中的绝热隔板撤去,使系统达到平衡态。
求过程的
。
解:
过程图示如下
同上题,末态温度T确定如下
经过第一步变化,两部分的体积和为
即,除了隔板外,状态2与末态相同,因此
注意21与22题的比较。
3.23 甲醇(
)在101.325KPa下的沸点(正常沸点)为
,在此条件下的摩尔蒸发焓
,求在上述温度、压力条件下,1Kg液态甲醇全部成为甲醇蒸汽时
。
解:
3.24 常压下冰的熔点为0℃,比熔化焓
,水的比定压热熔
。
在一绝热容器中有1kg,25℃的水,现向容器中加入0.5kg,0℃的冰,这是系统的始态。
求系统达到平衡后,过程的
。
解:
过程图示如下
将过程看作恒压绝热过程。
由于1kg,25℃的水降温至0℃为
只能导致
克冰融化,因此
3.27 已知常压下冰的熔点为0℃,摩尔熔化焓
,苯的熔点为5.51℃,摩尔熔化焓
。
液态水和固态苯的摩尔定压热容分别为
及
。
今有两个用绝热层包围的容器,一容器中为0℃的8molH2O(s)与2molH2O(l)成平衡,另一容器中为5.510℃的5molC6H6(l)与5molC6H6(s)成平衡。
现将两容器接触,去掉两容器间的绝热层,使两容器达到新的平衡态。
求过程的
。
解:
粗略估算表明,5molC6H6(l)完全凝固将使8molH2O(s)完全熔化,因 此,过程图示如下
总的过程为恒压绝热过程,
,
忽略液态乙醚的体积
3.30. 容积为20dm3的密闭容器中共有2molH2O成气液平衡。
已知80℃,100℃下水的饱和蒸气压分别为
及
,25℃水的摩尔蒸发焓
;水和水蒸气在25~100℃间的平均定压摩尔热容分别为
和
。
今将系统从80℃的平衡态恒容加热到100℃。
求过程的
。
解:
先估算100℃时,系统中是否存在液态水。
设终态只存在水蒸气,其物质量为n,则
显然,只有一部分水蒸发,末态仍为气液平衡。
因此有以下过程:
设立如下途径
第一步和第四步为可逆相变,第二步为液态水的恒温变压,第三步为液态水的恒压变温。
先求80℃和100℃时水的摩尔蒸发热:
3.31. O2(g)的摩尔定压热容与温度的函数关系为
已知25℃下O2(g)的标准摩尔熵
。
求O2(g) 在100℃,50kPa下的摩尔规定熵值
。
解:
由公式
3.32. 若参加化学反应的各物质的摩尔定压热容可表示为
试推导化学反应
的标准摩尔反应熵
与温度T的函数关系式,并说明积分常数
如何确定。
解:
对于标准摩尔反应熵,有
式中
3.34. 100℃的恒温槽中有一带有活塞的导热圆筒,筒中为2molN2(g)及装与小玻璃瓶中的3molH2O(l)。
环境的压力即系统的压力维持120kPa不变。
今将小玻璃瓶打碎,液态水蒸发至平衡态。
求过程的
。
已知:
水在100℃时的饱和蒸气压为
,在此条件下水 的摩尔蒸发焓
。
3.35. 已知100℃水的饱和蒸气压为101.325kPa,此条件下水的摩尔蒸发焓
。
在置于100℃恒温槽中的容积为100dm3的密闭容器中,有压力120kPa的过饱和蒸气。
此状态为亚稳态。
今过饱和蒸气失稳,部分凝结成液态水达到热力学稳定的平衡态。
求过程的
。
解:
凝结蒸气的物质量为
热力学各量计算如下
3.36 已知在101.325kPa下,水的沸点为100℃,其比蒸发焓
。
已知液态水和水蒸气在100~120℃范围内的平均比定压热容分别为:
及
。
今有101.325kPa下120℃的1kg过热水变成同样温度、压力下的水蒸气。
设计可逆途径,并按可逆途径分别求过程的
及
。
解:
设计可逆途径如下
3.39 若在某温度范围内,一液体及其蒸气的摩尔定压热容均可表示成
的形式,则液体的摩尔蒸发焓为
其中
,
为积分常数。
试应用克劳修斯-克拉佩龙方程的微分式,推导出该温度范围内液体的饱和蒸气压p的对数lnp与热力学温度T的函数关系式,积分常数为I。
解:
克—克方程为
不定积分:
3.40 化学反应如下:
(1)利用附录中各物质的Sθm,△fGθm数据,求上述反应在25℃时的△rSθm,△rGθm;
(2)利用附录中各物质的△fGθm数据,计算上述反应在25℃时的
;
(3)25℃,若始态CH4(g)和H2(g)的分压均为150kPa,末态CO(g)和H2(g)的分压均为50kPa,求反应的
。
解:
3.41 已知化学反应
中各物质的摩尔定压热容与温度间的函数关系为
这个反应的标准摩尔反应熵与温度的关系为
试用热力学基本方程
推导出该反应的标准摩尔反应吉布斯函数
与温度T的函数关系式。
说明积分常数
如何确定。
解:
根据方程热力学基本方程
4.42汞Hg在100kPa下的熔点为-38.87℃,此时比融化焓
;液态汞和固态汞的密度分别为
和
。
求:
(1)压力为10MPa下汞的熔点;
(2)若要汞的熔点为-35℃,压力需增大之多少。
解:
根据Clapeyron方程,蒸气压与熔点间的关系为
3.43 已知水在77℃时的饱和蒸气压为41.891kPa。
水在101.325kPa下的正常沸点为100℃。
求
(1)下面表示水的蒸气压与温度关系的方程式中的A和B值。
(2)在此温度范围内水的摩尔蒸发焓。
(3)在多大压力下水的沸点为105℃。
解:
(1)将两个点带入方程得
(2)根据Clausius-Clapeyron方程
(3)
3.44 水(H2O)和氯仿(CHCl3)在101.325kPa下的正常沸点分别为100℃和61.5℃,摩尔蒸发焓分别为
和
。
求两液体具有相同饱和蒸气压时的温度。
解:
根据Clausius-Clapeyron方程
设它们具有相同蒸气压时的温度为T,则
3.45 因同一温度下液体及其饱和蒸汽压的摩尔定压热容
不同
故液体的摩尔蒸发焓是温度的函数
,试推导液体饱和蒸汽压与温度关系的克劳修斯——克拉佩龙方程的不定积分式。
解:
克—克方程
不定积分得:
3.46 求证:
(2)对理想气体
证明:
由H=f(H,P)可得
对理想气体,
3.50证明
(1)焦耳-汤姆逊系数
(2)对理想气体
证明:
由H=f(T,P)
麦克斯韦关系式
代入上式
(2)对于理想气体