有机化学反应机理画法剖析汇编.docx
《有机化学反应机理画法剖析汇编.docx》由会员分享,可在线阅读,更多相关《有机化学反应机理画法剖析汇编.docx(17页珍藏版)》请在冰豆网上搜索。
有机化学反应机理画法剖析汇编
有机化学反应机理
弯箭头代表一对电子的转移,弯钩意味着一个电子的转移,后者适用于自由基反应
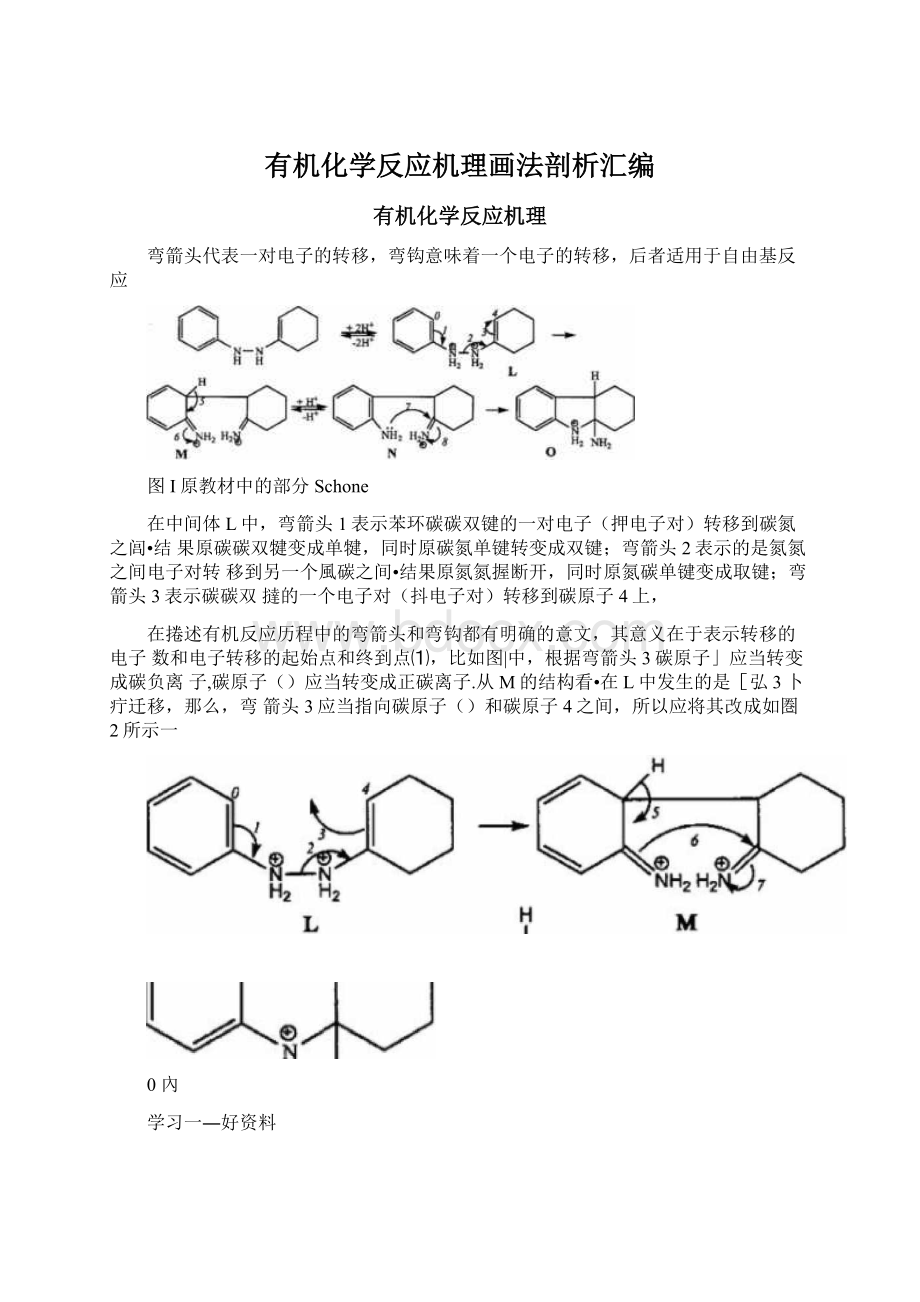
图I原教材中的部分Schone
在中间体L中,弯箭头1表示苯环碳碳双键的一对电子(押电子对)转移到碳氮之闾•结果原碳碳双犍变成单犍,同时原碳氮单键转变成双键;弯箭头2表示的是氮氮之间电子对转移到另一个風碳之间•结果原氮氮握断开,同时原氮碳单键变成取键;弯箭头3表示碳碳双撻的一个电子对(抖电子对)转移到碳原子4上,
在捲述有机反应历程中的弯箭头和弯钩都有明确的意文,其意义在于表示转移的电子数和电子转移的起始点和终到点⑴,比如图|中,根据弯箭头3碳原子」应当转变成碳负离子,碳原子()应当转变成正碳离子.从M的结构看•在L中发生的是[弘3卜疔迁移,那么,弯箭头3应当指向碳原子()和碳原子4之间,所以应将其改成如圏2所示一
0內
学习一―好资料
图|中间体M中的弯箭头5和6表示的是芳香化的发生,、中的弯箭头7意味着氮原子的孤对电子进攻烯胺碳原子形成毗咯环,这令描述法没有错误,但是可以简化成图2所示,可以理解为碳滅键的电子对沿看弯箭头5-6-7转移到氨基氮原子上,在这个过程中发主了闭环.
Scheme1表示的是丙稀的澳化氢加成反应历程,弯箭头8表示电子是从富有电子的碳碳双键转移到质子;弯箭头9表示电子是从漠负离子向正磯离子转移,
Schema1丙烯的澳化氢加成反应历程
Scheme?
表示的是环戊酮和盐酸瓮胺反应生成环戊酮躬的历程⑴•弯箭头山表示氧原子的孤对电子转移到质子上;弯箭头11表示氮原子的孤对电子转移到接基疏原子上;弯箭头12表示碳氧双键的电子对移向带正电荷的氧原子;弯箭头口表示氮氢间的电子对移向碳氮之间,因而氢以质子形式离去;弯箭头M表示餐基带着一对电子以氢氧根员离子离去,结果失去水分子形成环戊酮肪.
Schemes是2,2^二甲基丙醇在浓硫酸作用下形成2-甲基丁烯・2的反应历程.很显然首先羟基被质子化转化成易离去基团,接着发生离去形成正碳离子和甲基的迁移,弯箭头戸表示甲基负离子的迁特即甲基带着电子对转移,因而形成新的、更加稳定的正勝离子.
SclicnwJ2-2-—基丙障转址成2-甲基丁烯-2的反应历程
回顾近几年的本科生和硕士生的有机化学教学,感到学生最难学习的和聂难拿握的是反应历程的描述,尤其是不会画出弯箭头,为此,教师可先通过一些习题给学生讲解在不同情况下的弯箭头的去向及其结果.然后训练像图3中的那些简单物质的共振极限式的写法,熟悉弯箭头的正确使用.之后再给出如Scheme4所示的列出中间体的习题,让学生画出电子的走向■在这些基础上■再进行很据电子的转移,写出相应的中间体的训练,通过这些阶段的训练学生能拿握写反应历程的最基础的常识*旧由于有机化学反应种类繁多而复亲,因而历程也很复杂,这就需要学生做大量的习题,积累经验、领会技巧,
图?
用于共振极限式写法训练的例子
0H
SchcnxJ锥酸氧化环乙薛的反宜焉程
1有机反应机理入门
1.1画路易斯结构式
先画出分子的骨架,环和pi键应准确无误,然后用氢原子完成其余的化学键。
对于有机分子,骨架有时以简化形式给出。
画出孤对电子,使每个原子核外满足充满电子的结构:
氢2个;硼、铝和傢6
个;其它原子8个。
最后结构式中的每个原子总的成键电子数可以通过数其核外的成键电子获得(包括共享电子)。
提示:
画路易斯结构式可参考以下结构特征:
(1)氢原子永远在构的外围,因为它只能成一个共价键;
(2)碳、氮和氧有特定的键合模式。
在以下的示例中R代表氢、烷基、芳基或它们的组合,这种变化并不影响成键模式。
1中性的碳原子为4键。
这4个键可以都是sigma键,也可以是sigma键与pi键的组合(如双键和三键)。
2带有单个正电荷或负电荷的碳有3个键。
3中性的氮原子(氮烯除外)有3个键和一对未成对电子。
4正电荷的氮成4键,带有一个正电荷。
5负电荷的氮成2键,带有一个负电荷和2对未成键电子。
6中性的氧原子成2键,带有2对孤对电子。
7带正电荷的氧成3键,带有1对孤对电子。
(3)有时磷原子和硫原子可有10个成键电子,这是因为磷和硫具有d轨道,可以扩展而容纳10个电子。
Lewis结构式是价键理论的重要内容,也是学习反应机理的基础。
1.2电负性
多数有机反应依赖于带有正电荷(或部分正电荷)的分子与带有负电荷(或部分负电荷)的分子的相互作用而发生。
在中性有机分子中,部分电荷的产生依赖于电负性的差异。
电负性的数值最初由LinusPauling在1960年确定。
其数值越大,表明其吸电子能力越强,所以氟是吸电子能力最强的元素,见表:
成键后,电负性大的元素的原子拥有部分负电荷,而且,双键结构的部分电荷比单键结构的部分电荷密度更大,这是因为双键上的pi电子受原子核的束缚小,更易于流动。
电负性是很基础的知识,但很有用,很重要。
通过电负性,可以解释为什么硼烷加成到烷基取代的不对称烯烃上不服从Markovnikov规则,为什么含活泼氢
的羰基化合物去质子后主要以烯醇式存在…
1.3共振结构
当分子中成键电子的分布不能用一个路易斯结构充分表达时,可由若干个仅仅在电子的位置上有差别的路易斯结构的组合来表达。
这种仅仅在电子的位置上有差别的路易斯结构称为共振结构。
共振结构表达了分子中电子的离域。
画共振结构
对于给定的分子或中间体,画共振结构的简单方法是先画出一个路易斯结构,然后用箭头表示电子的流动,画出一个仅仅是电子分布不同的结构。
这种电子流动只是形式上的,而分子中并没有真正的流动发生。
实际的分子就是这些共振结构的某些特征的杂化体。
所以,共振结构并不代表分子或中间体的实际结构,而只是一种帮助我们预测实际分子中电子分布的形式结构。
例如:
提示:
化学家常用以下几种箭头:
①双向箭头用来联结共振结构:
②两个单箭头表示平衡:
③弯箭头表示一对电子沿箭头方向从起点流动到终点
④半弯箭头表示一个电子沿箭头方向从起点流动到终点:
(h3c)3c—d^b—C(CH3)3
亠2(H3C)3C—O
共振结构的规则
1所有参与离域的电子都是pi电子或孤对电子,因为它们很容易进入p轨道。
2每个参加离域的电子一定要与其它电子有一定程度的交盖。
这意味着如果轨
道之间是90o定向的,将不会交盖,最好的交盖发生在0度定向的情况下。
3每个共振结构必须要有相同的pi电子数。
双键计2个;三键计2个,因为
三键中只有一个pi键可与相邻的pi体系交盖;pi体系带有电荷时,负电荷计2个,正电荷计0个。
4每个结构中必须具有相同数目的成对pi电子。
以下两个结构不是共振结构,第一个结构中有两对pi电子:
一对pi键电子和一对负离子的孤对电子;在第二个结构中没有成对的pi电子而只有未成对电子(图中点所示)。
5所有的共振结构必须具有一致的几何构型,否则它们就不能代表相同的分子。
例如以下结构(杜瓦苯)就不是苯的共振结构,因为它不是平面构型,而且少2个pi电子。
由于几何构型是同杂化状态联系在一起的,这意味这所有的共振结构中的原子的杂化状态不能变。
⑦通常,负电荷集中在电负性大的原子上,正电荷集中在电负性小的原子上,
这样的结构对共振结构贡献大
muchmoreimportantthan©
CH2
所以说含活泼氢的羰基化合物去质子产物主要以烯醇式为主,称其为碳负离子有失严密。
单个共振结构并不代表真正存在的化学实体,重要性在于可以帮助阐明化学物种(分子、中间体、过渡态等)的电子分布;一般而言,共振结构越多,其化学物种就越稳定,据此可以解释为什么在芳环的亲电取代中硝基钝化芳环,并成为第二类定位基。
1.4互变异构体与平衡
互变异构体是那些仅在单、双键及小原子(通常为氢)的安排上不同的异构体。
适当条件下,上述异构体可通过简单的机理达到平衡。
平衡存在于正、逆反应速率相等的过程中。
提示:
以下因素可帮助区分共振结构与互变异构体:
1互变异构体是容易互相转化的异构体。
它们仅在单、双键及氢的安排上不同。
互变异构体间的平衡用一对半箭头表示。
2不同的共振结构代表不同的sigma键模式,而不是不同的化学物种。
共振结构用双箭头联结。
3对于给定的化合物,所有的共振结构都有一致的sigma键键合模式和一致的几何构型。
而在互变异构体中,sigma键模式则不同。
1.5酸和碱
(1)布朗斯太德(Bronsted)酸和碱
布朗斯太德酸是质子供体;而布朗斯太德碱是质子受体:
如果上述反应可逆,反过来定义也一样:
CH3NH3++CH3COO^-^=-CHaCOOH+CH3NH2
acidbaseconjugateconjugate
acidbase
⑵路易斯(Lewis)酸和碱
路易斯酸是孤对电子或pi电子的受体,是缺电子体。
换言之,路易斯酸上的原子由于与一个或多个电负性较大的原子相连而具有正电荷或部分正电荷。
路易斯碱是孤对电子或pi电子的供体。
具有负电荷的路易斯碱的碱性较没有负电荷的路易斯碱的碱性强。
因此,有机反应也被认为是路易斯酸碱之间的反应:
1.6亲核试剂与亲电试剂
亲核试剂是寻找缺电子中心的反应物种。
它们含有带有负电荷或部分负电荷的原子(亲核性原子)
缺电子中心称为亲电试剂,这些缺电子中心通常带有正电荷或部分正电荷,但缺电子物种也可以是中性分子。
提示:
一些基本概念
1共价键断裂时,如果原来由两个原子共享的电子保留在一个碎片上,这种方式称为共价键的异裂。
尽管异裂过程常常与离子中间体有关,但也有例外
2对多数反应而言,称其中的一个反应物为底物而另一个为进攻试剂常常比较方便。
为新键提供碳原子的分子常被指定为底物。
而形成碳碳键时,则需要主观指定哪个是底物哪个是进攻试剂。
3在异裂反应过程中,进攻试剂有时带给底物一对电子,有时从底物带走一对电子。
带来一对电子的称为亲核试剂,这样的反应称为亲核反应;带走一对电子的称为亲电试剂,这样的反应称为亲电反应。
4对于底物分子被异裂切断的反应,其断裂的一部分通常称为离去基团。
带着一对电子离去的称为离核基团,而留下一对电子的离去基团称为离电基团。
这些概念看来枯燥,但若能熟练运用,对于讨论问题十分方便。
1.7反应机理的表达
反应机理应一步一步地给出反应过程中化学键(电子)重新组合、安排的过程这些机理并没有真正的实体存在,只是为了表达反应是如何发生的一种尝试。
尽管实验可以证明某些机理合理而另一些不合逻辑,但对多数反应而言,并没有证据支持其机理。
因此,在遵从公认的准则的情况下,我们可以任意地描述一个反应的机理。
1.7.1配平方程式
从有机化学的观点来看,只要碳和电荷平衡,就可以认为一个反应方程式已经配平了。
不必配平反应过程中的无机物。
1.7.2用弯箭头表示电子的流动
在表达机理时,旧键的断裂和新键的形成一般用弯箭头表示。
这些箭头是表达反应过程中电子的重新分布的方便的工具。
这些说明电子重新分布的箭头是从电子云密度高的位点画向缺电子(电子云密
度低)的位点。
也就是从负电荷或部分负电荷(孤对电子)的位点画向正电荷或部分正电荷的位点(偶极矩的正极点)。
换言之,是从亲核试剂(路易斯碱)画向亲电试剂(路易斯酸)。
而且一般只是一些在非常反应中才会出现两个箭头从同一原子同出(或同
入)的情况。
例酰氯和氨生成酰胺的反应机理:
附:
弯箭头简史
弯箭头的发明者被认为是RobertRobinson(1886-1975),1947年Nobel化学
奖得主
ThefirstuseofcurlyarrowstorepresentthemovementofelectronsisinapaperentitledAnExplanationofthePropertyofInducedPolarity
ofAtomsandanInterpretationoftheTheoryofPartialValencesonan
ElectronicBasis,byWilliamOgilvyKermackandRobertRobinson,
publishedinTheJournaloftheChemicalSociety,1922,121:
427.
4/CH2|CH:
CH:
ch:
CH:
CH2(V.)
…并匚酸、碱介质中的
反应机理
对于酸性介质中进行的反应,首先在反应物中找到碱性最强的原子,然后使其质子化,再给这个正离子寻找合适的反应。
对于碱性介质中的反应,先在反应物中找到酸性最强的质子,去质子后得到一个负离子,再给这个负离子寻找合适的反应。
如果这个负离子有合适的离去集团,就可以发生消除反应。
如果形成的负离子是良好的亲核试剂,就寻找亲电物种使之反应。
例Claisen缩合的反应机理:
1.7.3化学反应的推动力
化学反应可以由焓减、熵增或这两个过程联合推动。
由少数分子生成多数分子的反应是熵增推动的;而生成更稳定分子的过程则主要是焓减推动的。
考虑一个化学反应的机理时,应提出这样的问题:
反应为什么这样进行?
什么因素有助于反应进行?
(1)离去基团
对于亲核取代反应,离去基团的性质常常成为该反应能否发生的关键。
一般而
言,离去基团的离去能力与其碱性的强弱相反。
例如水(H20)是比羟基(0H-)更
好的离去基团;碘离子(I-)是比氟离子(F-)更好的离去基团。
离去基团能力:
非常好
NrF^CSOjO-ltrlflate),H3CSO2O
nosylate
brosytste=Bstosylate=TosorTs
(mesylate=Ms)
好
中等
差
hBr,Cl:
SR2
0H21NH3IAcO-
OH-,OR'
NH2;RNH',R2N\H-,Ar
如果反应涉及到差的离去基团,要使反应发生,常常需要很强的亲核试剂
(2)生成稳定的小分子
生成稳定的小分子既是焓减过程也是熵增过程,因此成为化学反应的很好的推动力。
这些稳定的小分子包括:
氮、二氧化碳、一氧化碳、水、二氧化硫和无机盐等。
例在四苯基环戊二烯酮和顺丁烯二酸酐的反应中,生成一氧化碳成为反应的推动力:
1.7.4反应原料与产物间的结构关系:
标号法
给反应原料和生成物的原子标号,可以帮助我们确定产物分子中原子与原料分子中原子之间的关系,并由此了解反应是如何进行的。
方法:
首先给原料分子中的原子编号;然后通过寻找原子的共同序列和键合模式,确定产物分子中与原料分子中原子相对应的原子,并依原编号进行相应编号;最后用尽可能少的化学键变化来补足剩余的编号。
例用标号法写出以下反应的反应机理
通过对原料和产物的原子进行编号,可以清楚地看到,是氮-6原子进攻碳-1原
〜EtsN-Fh
PhMeOlT
子。
子间的连接建立起来以后,可以写出机理:
画机理时的常见错误
⑴使用五键的碳(过渡态除外);
(2)错误的箭头方向;(3)丢失箭头;(4)丢失形式电荷;(5)在关键步骤丢失孤对电子;(6)不能正确识别中间体的共振结构;(7)不能正确使用共振或平衡箭头;(8)不能正确识别可逆或不可逆的步骤;(9)不能正确标识速度决定步骤;(10)不正确的物种/介质识别:
①在酸性介质中使用羟基(0H-)、②在碱性介质中使用质子(H+)、③当质子供体很重要时使用自由(游离)质子;(11)忽略碳正离子重排;(12)丢失反应步骤,或多步合一;(13)忽略表达中间体;(14)忽略立体化学因素,或使用立体化学含糊的结构;(15)不能确定产物的内消旋、对映体和外消旋。
起点落在某一原子上:
表示该原子在反应中给岀电子
学习一―好资料
起点落在某化学键中间:
表示该化学键在反应中断裂,电荷按箭头所下的方向转移
(3)终点位置
终点落在某一原子上:
表示电荷转移至该原子上或由起点原子提供电子,在两原子间形成新的化学键
终点落在某两原子中间:
表示反应中电荷转移到这两个原子之间’形成新的化学键
学习一―好资料
与判别Lewis结构稳定性的原则相同
1B,CN,O等满足八隅体规则的共振结构更稳定
2电中性共振结构较电荷分离的共振结构稳定
3电负性原子带负电荷,电正性原子带正电荷较稳定
注意不是所有带正电荷的原子都能接受一对电子,
例如硝基化合物的氮原子带正电但己达到八隅体结构,不能接受电子
判断以下共振结构的稳定性
Me
右边的共振结构所有原子都满足八隅律(规则①)更稳定
八隅律的影响较电荷是否分离的影响大
学习一―好资料
芳杂环的共振
孤电子对处于Sp2杂化轨道,与芳环的大兀键垂直
芳杂环的共振
孤电子对处于P轨道,参与形成芳环的大兀键