有机化学反应机理整理版.docx
《有机化学反应机理整理版.docx》由会员分享,可在线阅读,更多相关《有机化学反应机理整理版.docx(31页珍藏版)》请在冰豆网上搜索。
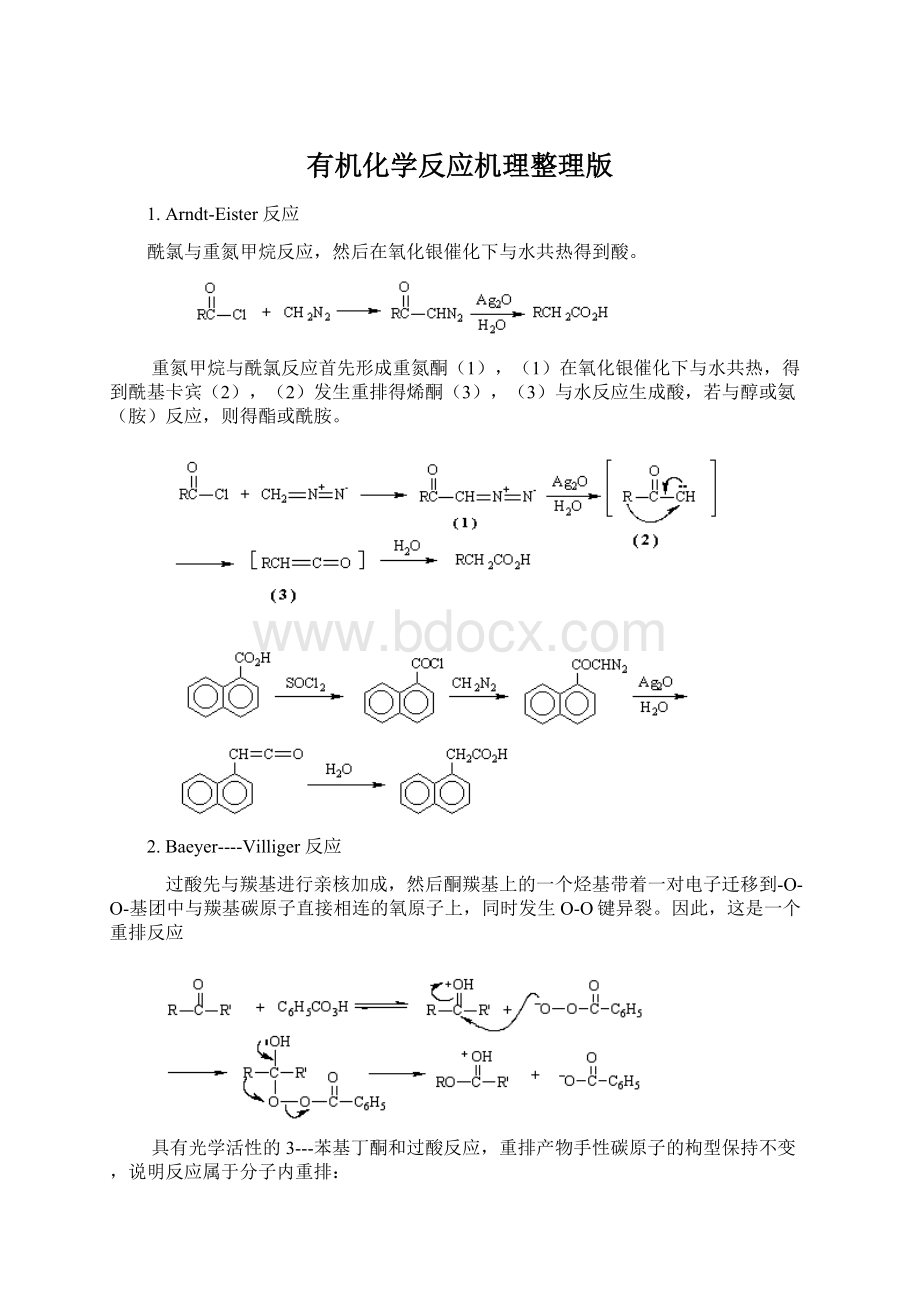
有机化学反应机理整理版
1.Arndt-Eister反应
酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
重氮甲烷与酰氯反应首先形成重氮酮
(1),
(1)在氧化银催化下与水共热,得到酰基卡宾
(2),
(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
2.Baeyer----Villiger反应
过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应
具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:
不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:
醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。
3.Beckmann 重排
肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:
在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:
例
4.Birch还原
芳香化合物用碱金属(钠、钾或锂)在液氨与醇(乙醇、异丙醇或仲丁醇)的混合液中还原,苯环可被还原成非共轭的1,4-环己二烯化合物。
首先是钠和液氨作用生成溶剂化点子,然后苯得到一个电子生成自由基负离子(Ⅰ),这是苯环的л电子体系中有7个电子,加到苯环上那个电子处在苯环分子轨道的反键轨道上,自由基负离子仍是个环状共轭体系,(Ⅰ)表示的是部分共振式。
(Ⅰ)不稳定而被质子化,随即从乙醇中夺取一个质子生成环己二烯自由基(Ⅱ)。
(Ⅱ)在取得一个溶剂化电子转变成环己二烯负离子(Ⅲ),(Ⅲ)是一个强碱,迅速再从乙醇中夺取一个电子生成1,4-环己二烯。
环己二烯负离子(Ⅲ)在共轭链的中间碳原子上质子化比末端碳原子上质子快,原因尚不清楚。
取代的苯也能发生还原,并且通过得到单一的还原产物。
例如
5.Bouveault---Blanc还原
脂肪族羧酸酯可用金属钠和醇还原得一级醇。
α,β-不饱和羧酸酯还原得相应的饱和醇。
芳香酸酯也可进行本反应,但收率较低。
本法在氢化锂铝还原酯的方法发现以前,广泛地被使用,非共轭的双键可不受影响。
首先酯从金属钠获得一个电子还原为自由基负离子,然后从醇中夺取一个质子转变为自由基,再从钠得一个电子生成负离子,消除烷氧基成为醛,醛再经过相同的步骤还原成钠,再酸化得到相应的醇。
醛酮也可以用本法还原,得到相应的醇:
6.Cannizzaro反应
凡α位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作用时,不发生醇醛缩合或树脂化作用而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。
此反应的特征是醛自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇:
脂肪醛中,只有甲醛和与羰基相连的是一个叔碳原子的醛类,才会发生此反应,其他醛类与强碱液,作用发生醇醛缩合或进一步变成树脂状物质。
具有α-活泼氢原子的醛和甲醛首先发生羟醛缩合反应,得到无α-活泼氢原子的β-羟基醛,然后再与甲醛进行交叉Cannizzaro反应,如乙醛和甲醛反应得到季戊四醇:
醛首先和氢氧根负离子进行亲核加成得到负离子,然后碳上的氢带着一对电子以氢负离子的形式转移到另一分子的羰基不能碳原子上。
7.Claisen酯缩合反应
含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯。
如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。
二元羧酸酯的分子内酯缩合见Dieckmann缩合反应。
乙酸乙酯的α-氢酸性很弱(pKa-24.5),而乙醇钠又是一个相对较弱的碱(乙醇的pKa~15.9),因此,乙酸乙酯与乙醇钠作用所形成的负离子在平衡体系是很少的。
但由于最后产物乙酰乙酸乙酯是一个比较强的酸,能与乙醇钠作用形成稳定的负离子,从而使平衡朝产物方向移动。
所以,尽管反应体系中的乙酸乙酯负离子浓度很低,但一形成后,就不断地反应,结果反应还是可以顺利完成。
常用的碱性缩合剂除乙醇钠外,还有叔丁醇钾、叔丁醇钠、氢化钾、氢化钠、三苯甲基钠、二异丙氨基锂(LDA)和Grignard试剂等。
如果酯的α-碳上只有一个氢原子,由于酸性太弱,用乙醇钠难于形成负离子,需要用较强的碱才能把酯变为负离子。
如异丁酸乙酯在三苯甲基钠作用下,可以进行缩合,而在乙醇钠作用下则不能发生反应:
两种不同的酯也能发生酯缩合,理论上可得到四种不同的产物,称为混合酯缩合,在制备上没有太大意义。
如果其中一个酯分子中既无α-氢原子,而且烷氧羰基又比较活泼时,则仅生成一种缩合产物。
如苯甲酸酯、甲酸酯、草酸酯、碳酸酯等。
与其它含α-氢原子的酯反应时,都只生成一种缩合产物。
实际上这个反应不限于酯类自身的缩合,酯与含活泼亚甲基的化合物都可以发生这样的缩合反应,这个反应可以用下列通式表示:
8.Claisen—Schmidt反应
一个无α-氢原子的醛与一个带有α-氢原子的脂肪族醛或酮在稀氢氧化钠水溶液或醇溶液存在下发生缩合反应,并失水得到α,β-不饱和醛或酮:
9.Claisen重排
烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:
Claisen重排是分子内的重排。
采用g-碳14C标记的烯丙基醚进行重排,重排后g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
Claisen重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s迁移到邻位(Claisen重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s迁移(Cope重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
Claisen重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen重排。
10.Clemmensen还原
醛类或酮类分子中的羰基被锌汞齐和浓盐酸还原为亚甲基:
此法只适用于对酸稳定的化合物。
对酸不稳定而对碱稳定的化合物可用Wolff-Kishner-黄鸣龙反应还原。
11.Cope消除反应
叔胺的N-氧化物(氧化叔胺)热解时生成烯烃和N,N-二取代羟胺,产率很高。
实际上只需将叔胺与氧化剂放在一起,不需分离出氧化叔胺即可继续进行反应,例如在干燥的二甲亚砜或四氢呋喃中这个反应可在室温进行。
此反应条件温和、副反应少,反应过程中不发生重排,可用来制备许多烯烃。
当氧化叔胺的一个烃基上二个β位有氢原子存在时,消除得到的烯烃是混合物,但是Hofmann产物为主;如得到的烯烃有顺反异构时,一般以E-型为主。
例如:
这个反应是E2顺式消除反应,反应过程中形成一个平面的五员环过度态,氧化叔胺的氧作为进攻的碱:
要产生这样的环状结构,氨基和β-氢原子必须处于同一侧,并且在形成五员环过度态时,α,β-碳原子上的原子基团呈重叠型,这样的过度态需要较高的活化能,形成后也很不稳定,易于进行消除反应。
12.Cope重排
1,5-二烯类化合物受热时发生类似于O-烯丙基重排为C-烯丙基的重排反应(Claisen重排)反应称为Cope重排。
这个反应30多年来引起人们的广泛注意。
1,5-二烯在150—200℃单独加热短时间就容易发生重排,并且产率非常好。
Cope重排属于周环反应,它和其它周环反应的特点一样,具有高度的立体选择性。
例如:
内消旋-3,4-二甲基-1,5-己二烯重排后,得到的产物几乎全部是(Z,E)-2,6辛二烯:
Cope重排是[3,3]s-迁移反应,反应过程是经过一个环状过渡态进行的协同反应:
在立体化学上,表现为经过椅式环状过渡态:
13.Friedel-Crafts 烷基化反应
芳烃与卤代烃、醇类或烯类化合物在Lewis催化剂(如AlCl3,FeCl3,H2SO4,H3PO4,BF3, HF等)存在下,发生芳环的烷基化反应。
卤代烃反应的活泼性顺序为:
RF>RCl>RBr>RI;当烃基超过3个碳原子时,反应过程中易发生重排。
首先是卤代烃、醇或烯烃与催化剂如三氯化铝作用形成碳正离子:
所形成的碳正离子可能发生重排,得到较稳定的碳正离子:
碳正离子作为亲电试剂进攻芳环形成中间体s-络合物,然后失去一个质子得到发生亲电取代产物:
14.Friedel-Crafts 酰基化反应
芳烃与酰基化试剂如酰卤、酸酐、羧酸、烯酮等在Lewis酸(通常用无水三氯化铝)催化下发生酰基化反应,得到芳香酮:
这是制备芳香酮类最重要的方法之一,在酰基化中不发生烃基的重排。
15.Gattermann-Koch反应
芳香烃与等分子的一氧化碳及氯化氢气体在加压和催化剂(三氯化铝及氯化亚铜)存在下反应,生成芳香醛:
16.Hell-Volhard-Zelinski反应
羧酸在催化量的三卤化磷或红磷作用下,能与卤素发生a-卤代反应生成a-卤代酸:
本反应也可以用酰卤作催化剂。
17.Hinsberg反应
伯胺、仲胺分别与对甲苯磺酰氯作用生成相应的对甲苯磺酰胺沉淀,其中伯胺生成的沉淀能溶于碱(如氢氧化钠)溶液,仲胺生成的沉淀则不溶,叔胺与对甲苯磺酰氯不反应。
此反应可用于伯仲叔胺的分离与鉴定。
18.Hofmann 烷基化
卤代烷与氨或胺发生烷基化反应,生成脂肪族胺类:
由于生成的伯胺亲核性通常比氨强,能继续与卤代烃反应,因此本反应不可避免地产生仲胺、叔胺和季铵盐,最后得到的往往是多种产物的混合物。
用大过量的氨可避免多取代反应的发生,从而可得到良好产率的伯胺。
反应为典型的亲核取代反应(SN1或SN2)
19.Hofmann 消除反应
季铵碱在加热条件下(100--200°C)发生热分解,当季铵碱的四个烃基