完整word版BD FACSCalibur流式细胞仪简易操作步骤corrZYH0520.docx
《完整word版BD FACSCalibur流式细胞仪简易操作步骤corrZYH0520.docx》由会员分享,可在线阅读,更多相关《完整word版BD FACSCalibur流式细胞仪简易操作步骤corrZYH0520.docx(16页珍藏版)》请在冰豆网上搜索。
完整word版BDFACSCalibur流式细胞仪简易操作步骤corrZYH0520
BDFACSCalibur流式细胞仪
简易操作步骤
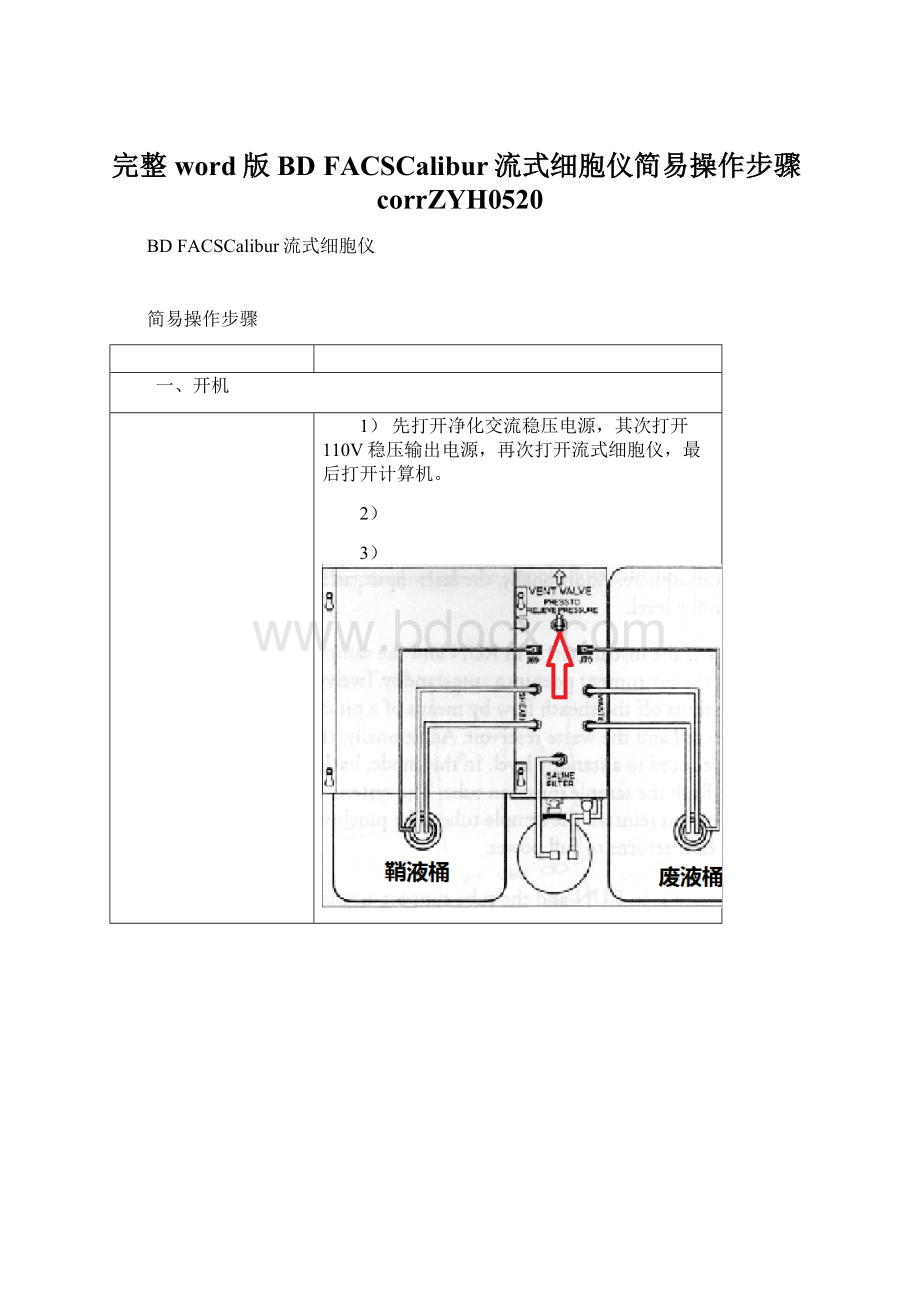
一、开机
1)先打开净化交流稳压电源,其次打开110V稳压输出电源,再次打开流式细胞仪,最后打开计算机。
2)
3)
向前拉开储液箱抽屉,检查鞘液筒、废液筒水量,如需充填鞘液,先将减压阀(红色箭头所示)方向调在VENT位置(箭头方向),再加入超纯水,保持水位在鞘液桶的3/4左右,加好后拧紧桶盖并将减压阀方向调在RUN位置。
4)
二、开启CellQuest软件、编辑实验文件
1)在屏幕下方点击CELLQuest(第四个图标)启动软件。
桌面会出现一’Untitled’实验文件,可点击实验文件的左上角的放大钮(绿色),将实验文件窗口放大。
2)从工具板中点击散点图图示。
在实验文件的空白区点击,拖曳对角线至适当大小,然后放开鼠标。
出现散点图对话方框(当所要编辑的图窗口被选中时,会在其四角出现四个小黑块)。
3)在出现的散点图对话方框中点击PlotSource,选择AcquisitionandAnalysis(收取、分析),确认X和Y轴参数预设为FSC-H1024、SSC-H1024。
4)从屏幕上方Plots菜单中选择DotPlot功能,可复制一个同样大小的散点图,在出现的对话方框内选择X轴:
FL1-H1024;如果是双标,Y轴选择:
FL2-H1024(根据实验检测样品确定所选通道,本步骤选FL1/FL2来说明),如果是单标,Y轴选择:
SSC-H。
点击OK,FL1/FL2的散点图出现。
完成后可将重制图移至原图右方。
说明:
散点图(Dotplot),又称二维散点图是流式分析最常用图谱,它可以显示两个独立参数的相互关系。
在图中,横坐标X轴和纵坐标Y轴参数分别设为FSC-H1024、SSC-H1024;双荧光标记时,第二图X和Y轴参数分别设为FL1-H1024、FL2-H1024,X轴为为荧光1强度的相对值,单位是道数,Y轴则通常表示荧光2或光散射强度的相对值。
仪器使用者可因实验需求来修改所有图谱中显示之参数。
修改动作为轻击图谱上X和Y轴参数,并依需要选择之(FSC:
细胞大小,SSC:
细胞折射率,FL1:
FITC绿色荧光,FL2:
PE橙色荧光,FL3:
PerCP红色荧光)。
5)在工具板中选择四象限工具,在FL1/FL2散点图上拖动Quadrant的中心将它设定在(x,y)=(101,101)处,这些象限将指定阴性/阳性区域。
6)从工具板中点击直方图图示,在实验文件的空白区点击,拖曳对角线至适当大小,然后放开鼠标。
单色荧光只需一个直方图,和第二个散点图一样,横坐标选择FL-1,纵坐标默认为Counts;若是双色荧光,需画2个直方图,一个横坐标选择FL-1-1024,另一个横坐标选择FL-2-1024;
7)在上面直方图中画出M1和M2,其中M1代表隐性数目(一般标示是101),M2代表阳性数目(除M1以外所有的部分)。
8)从Stats菜单中选择QuadrantStats(象限统计),5)步骤中的点图将分为四个象限。
三、建立仪器和计算机之间通讯
从Acquire菜单中选择ConnecttoCytometer(快捷键Win+b),此时会出现AcquisitionControl对话方框。
四、仪器设置文件
注意:
实验数据质量,取决于最适化仪器设定文件。
仪器设定文件不能在数据收取后再更改,研究人员必须在第一次就使用正确的仪器设定文件。
仪器设定文件(Instrumentsettings),含信号器高压(Detector/Amps),阈值(Threshold),荧光补偿(Compensation)等仪器条件的组合。
一般而言,仪器设定的顺序为Detector/Amps--Threshold--Compensation。
1)检查现有仪器条件,从Cytometer菜单中选择Detectors/Amps。
出现Detectors/Amps窗口。
在Detectors/Amps窗口确认FSC与SSC(根据实验样品确定,一般细胞选择LIN,细菌选择LOG),其它FL1-3为LOG(对数放大),将其拖至空白区。
2)从Cytometer菜单中选择Threshold,出现Threshold窗口在Threshold窗口:
确认FSC为设阈参数,初步确认预设阈值52。
将其拖至空白区。
3)从Cytometer菜单中选择Compensation,确认所有预设数值皆为零。
将其拖至空白区。
五、上样品、设置仪器
使仪器处于HighRUN,样品管支撑架左移,上阴性对照管样品,支撑架回位。
确认AcquisitionControl窗口中Setup前需打叉或打勾(即不储存数据,用于仪器设置),点击Acquire。
1、调节FSC/SSC探测器(电压)
观察FSC/SSC图的变化。
FSC电压(Voltage)预设为E00,可调节AmpGain从1.00—9.99使主要细胞群得以清楚显示(如细胞较大,将FSC电压设置于E-1;较小细胞,将FSC电压设置于E01)。
调节SSC电压使主要细胞群得以清楚呈现。
调节FSC/SSC图的原则,在于能得到一独立离散的细胞族群,该细胞群不与其它族群、细胞碎片有重迭现象。
调整定位后,点击AcquisitionControl窗口中的Pause。
2、Gating圈选
细胞检品中,常含有大小不同、性质相异的细胞群体。
我们常用前方散射(FSC)与侧方散射(SSC)的二维位图,即散射光图谱(ScatterPlot),来圈选出不同细胞群的范围,选择性显示出有意义的细胞群体,如下图圈选白血球之淋巴细胞族群。
1)在工具板中选择多边形的Region,在FSC/SSC散点图上划定淋巴细胞R1区域(如下图)。
分析样品时,区域内细胞应会呈现成红色,可移动或改变形状来圈选有意义的细胞。
如果要删除R1区域,您可以在工具列中点选Gates→Regionlist,以鼠标点选R1,再按Delete键删除R1区域。
删除R1区域后,可用绘图工具板,重画R1。
2)选取希望Gate的FL1/FL2散点图,从Plots菜单中选择Formatdotplot。
在出现的对话方框内,将NoGate改选G1=R1。
点击OK。
3)
3、调节FL1、FL2的探测器(电压)
1)点击AcquisitionControl窗口中的Restart。
在Detector/Amps窗口中调节FL1、FL2的电压,使NegativeControl细胞群着落在所选直方图或散点图之100--101处。
2)在Threshold窗口,适当地提高FSC阈值>52,以去除碎片或低阶噪音。
唯需注意不要切掉主要细胞族群。
3)点击AcquisitionControl窗口中的Pause、Abort。
移去阴性对照管,我们已设定好有意义细胞群之自体荧光,不要再改动Detector/Amps、Threshold等数值。
4、调节荧光补偿
说明:
最适化的最后一步是调节光谱重迭。
(如是单色荧光实验可跳过此步骤)如是2色样本,必要时需调节FL2-%FL1,FL1-%FL2(若3色样本,必要时需调节FL2-%FL1、FL1-%FL2、FL3-%FL2、FL2-%FL3的补偿)。
1)HighRUN,换上单染CD3-FITC管。
点击AcquisitionControl窗口中的Acquire。
调节FL2-%FL1使FITC阳性细胞在FL1/FL2散点图的右下象限。
补偿调节可通过点击来选择或直接拖动滑标上下移动。
调节完毕,点击AcquisitionControl窗口中的Pause。
2)移去单染CD3,换上单染CD19-PE管。
点击AcquisitionControl窗口中的Restart。
调节FL1-%FL2使PE+细胞在FL1/FL2散点图的左上象限。
调节完毕,点击AcquisitionControl窗口中的Pause。
3.)最后以CD3-FITC/CD19-PE双染样本上机,点击AcquisitionControl窗口中的Restart,确定三群细胞工整垂直。
当您已完成2色荧光之光谱重迭时,点击AcquisitionControl窗口中的Pause、Abort。
4)移去样本管,换上dH2O管,让仪器暂且处于Standby状态。
关闭Compensation窗口。
您已完成2色荧光之最适化。
六、收集实验数据
1)决定储存细胞总数:
预设之「储存细胞总数」为10000。
如需修改,从Acquire菜单中选择Acquisition&Storage,并在出现的窗口功,确认「CollectionCriteria」从10000ofAll,再点击OK。
2)
找个档案匣准备储存数据,本机所有数据都贮存在D盘data盘中,按实验日期编排。
从Acquire菜单中选择ParameterDescription,出现ParameterDescription对话方框。
点击Folder,并在随后出现之对话方框,选择「YourFolder」或新建活页夹,点击此对话方框的Select’YourFolder’(一般用实验日期来命名Folder)。
3)命名即将储存之文件名:
点击ParameterDescription对话方框的File,出现文件名编辑窗口,输入文件名(根据实验来决定),点击此对话方框的OK。
4)Optional:
如有需要,可选择或在P1-P5后的空格中输入相关参数名。
如P1:
Size,P2:
Granularity,P3:
CD3FITC。
输入参数名会存入实验档案中,显示在图谱上。
5)计数器Counters:
从Acquire菜单中选择Counters.窗口会显示样品分析速率、与总数进度
6)开始收集实验数据。
LOWRUN(根据Counters来调节速度,一般保持在700-800/Second),将第一管样品放到检测区,在AcquisitionControl窗口中,将Setup改成Setup,此时CellQuest会自动显示YourFolder文件名为资料文件名。
点击“Acquire”便可启动样品之分析测定与数据储存。
当计算机成功地收取足够数据,会自动储存数据文件文件名.001,并会以“嘟”声告知,CellQuest会自动升幂附加档名成文件名.002。
等待下一指示。
7)换上超纯水,清洗管路,直到Counters持续显示0/Second30s(约为10-20s),换上下一管样品,点击“Acquire”启动样品之分析测定与数据储存。
可继续分析直到所有检品都分析完毕。
七、退出软件并关机
1).检品分析完毕后,记得从屏幕上方File指令栏选择SaveAs,储存实验文件,以备日后使用,不需每次重新编辑。
2)检品分析完毕后,用鼠标从屏幕上方Acquire指令栏中,选取DisconnecttoCytometer以断绝计算机与仪器间之联机。
之后如不分析数据,您可退出软件“File”“Quit”(遇有选项永远选择“Don‘tsave”),进行关机程序。
3)以2ml10%漂白水取代样品,将样品架置于左位以外管吸除约1ml,再将样品架置于中位HIRUN十分钟。
改用2mlDIwater。
重复上述程序,样品架上留约1mlDIwater。
按STANDBY五分钟。
4)先关闭计算机,其次关闭流式细胞仪,再次关闭110V稳压输出电源,先打开净化交流稳压电源。
5)向前拉开储液箱抽屉,先将减压阀方向调在VENT位置(箭头方向),再取出废液桶,将废液倒进预先装有84的烧杯中,灭菌处理,装好废液桶,将减压阀方向调在RUN位置。