超全官能团的性质及有机知识总结.docx
《超全官能团的性质及有机知识总结.docx》由会员分享,可在线阅读,更多相关《超全官能团的性质及有机知识总结.docx(23页珍藏版)》请在冰豆网上搜索。
超全官能团的性质及有机知识总结
有机物官能团与性质
[知识归纳]
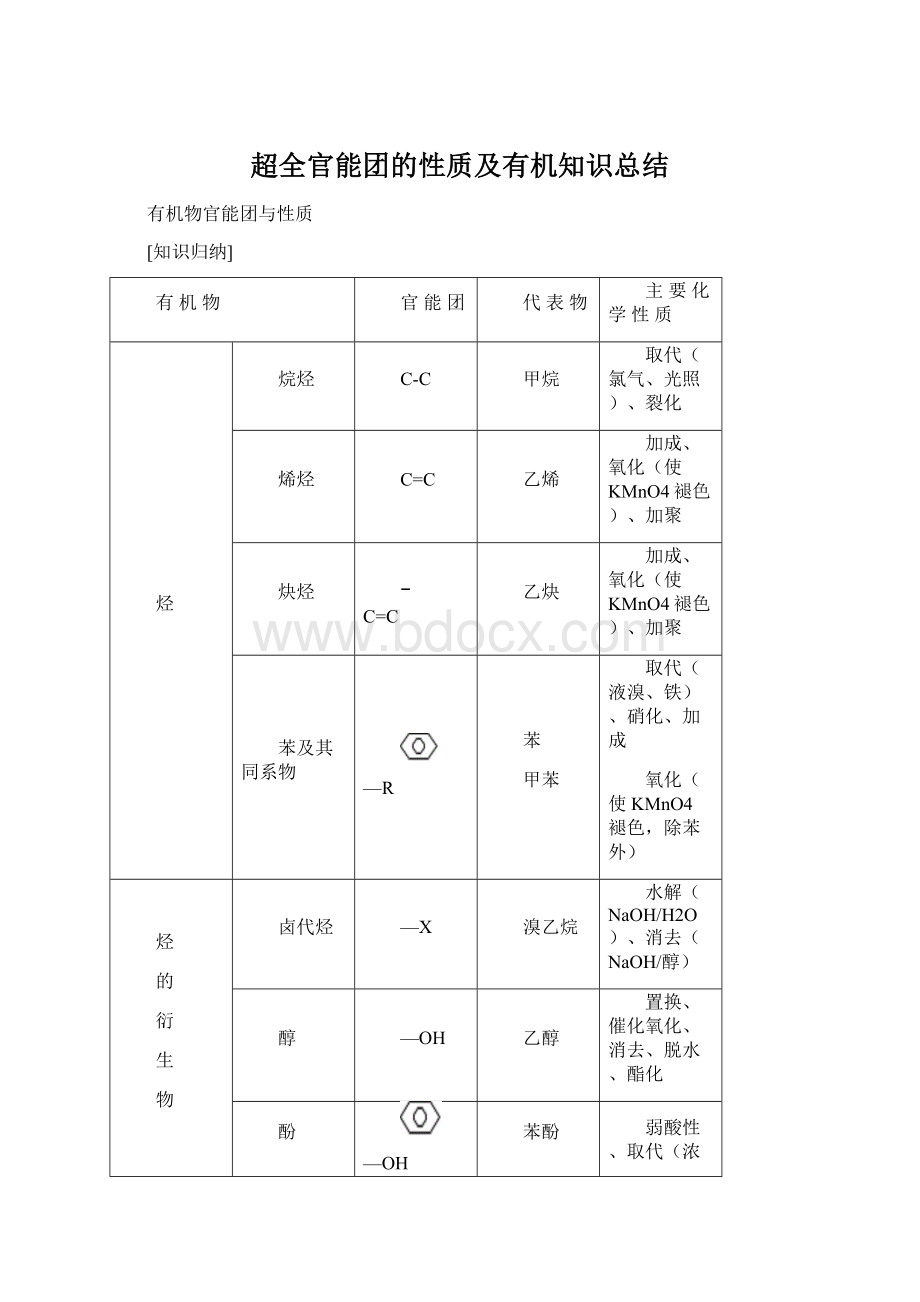
有机物
官能团
代表物
主要化学性质
烃
烷烃
C-C
甲烷
取代(氯气、光照)、裂化
烯烃
C=C
乙烯
加成、氧化(使KMnO4褪色)、加聚
炔烃
C=C
乙炔
加成、氧化(使KMnO4褪色)、加聚
苯及其同系物
—R
苯
甲苯
取代(液溴、铁)、硝化、加成
氧化(使KMnO4褪色,除苯外)
烃
的
衍
生
物
卤代烃
—X
溴乙烷
水解(NaOH/H2O)、消去(NaOH/醇)
醇
—OH
乙醇
置换、催化氧化、消去、脱水、酯化
酚
—OH
苯酚
弱酸性、取代(浓溴水)、显色、
氧化(露置空气中变粉红色)
醛
—CHO
乙醛
还原、催化氧化、银镜反应、斐林反应
羧酸
—COOH
乙酸
弱酸性、酯化
酯
—COO—
乙酸乙酯
水解
重
要
的
营
养
物
质
葡萄糖
—OH、—CHO
/
具有醇和醛的性质
蔗糖
麦芽糖
前者无—CHO
前者有—CHO
/
无还原性、水解(产物两种)
有还原性、水解(产物单一)
淀粉
纤维素
(C6H10O5)n
后者有—OH
/
水解
水解
油脂
—COO—
/
氢化、皂化
氨基酸
蛋白质
NH2-、-COOH
—CONH—
/
两性、酯化
水解
其中:
1、能使KMnO4褪色的有机物:
烯烃、炔烃、苯的同系物、醇、酚、醛、葡萄糖、麦芽糖、油脂
2、能使Br2水褪色的有机物:
烯烃、炔烃、酚、醛、葡萄糖、麦芽糖、油脂
3、能与Na反应产生H2的有机物:
醇、酚、羧酸、氨基酸、葡萄糖
4、具有酸性(能与NaOH、Na2CO3反应)的有机物:
酚、羧酸、氨基酸
5、能发生银镜反应或与新制Cu(OH)2反应的有机物:
醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖
6、既有氧化性,又有还原性的有机物:
醛、烯烃、炔烃
7、能发生颜色(显色)反应的有机物:
苯酚遇FeCl3显紫色、淀粉遇I2变蓝、蛋白质遇浓硝酸变黄、葡萄糖遇Cu(OH)2显绛蓝
有机物的物理性质
1、状态:
固态:
饱和高级脂肪酸、脂肪、葡萄糖、果糖、蔗糖、麦芽糖、淀粉、维生素、醋酸(16.6℃以下);
气态:
C4以下的烷、烯、炔烃、甲醛、一氯甲烷、新戊烷;
液态:
油状:
乙酸乙酯、油酸;
粘稠状:
石油、乙二醇、丙三醇。
2、气味:
无味:
甲烷、乙炔(常因混有PH3、H2S和AsH3而带有臭味);
稍有气味:
乙烯;
特殊气味:
甲醛、乙醛、甲酸和乙酸;
香味:
乙醇、低级酯;
3、颜色:
白色:
葡萄糖、多糖
黑色或深棕色:
石油
4、密度:
比水轻:
苯、液态烃、一氯代烃、乙醇、乙醛、低级酯、汽油;
比水重:
溴苯、乙二醇、丙三醇、CCl4。
5、挥发性:
乙醇、乙醛、乙酸。
6、水溶性:
不溶:
高级脂肪酸、酯、溴苯、甲烷、乙烯、苯及同系物、石油、CCl4;
易溶:
甲醛、乙酸、乙二醇;
与水混溶:
乙醇、乙醛、甲酸、丙三醇。
有机化学知识点总结
1.需水浴加热的反应有:
(1)、银镜反应
(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解
(5)、酚醛树脂的制取(6)固体溶解度的测定
凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:
温度变化平稳,不会大起大落,有利于反应的进行。
2.需用温度计的实验有:
(1)、实验室制乙烯(170℃)
(2)、蒸馏?
?
(3)、固体溶解度的测定
(4)、乙酸乙酯的水解(70-80℃)?
?
(5)、中和热的测定
(6)制硝基苯(50-60℃)
[说明]:
(1)凡需要准确控制温度者均需用温度计。
(2)注意温度计水银球的位置。
3.能与Na反应的有机物有:
?
醇、酚、羧酸等——凡含羟基的化合物。
4.能发生银镜反应的物质有:
醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖——凡含醛基的物质。
5.能使高锰酸钾酸性溶液褪色的物质有:
(1)含有碳碳双键、碳碳叁键的烃和烃的衍生物、苯的同系物
(2)含有羟基的化合物如醇和酚类物质
(3)含有醛基的化合物
(4)具有还原性的无机物(如SO2、FeSO4、KI、HCl、H2O2等)
6.能使溴水褪色的物质有:
(1)含有碳碳双键和碳碳叁键的烃和烃的衍生物(加成)
(2)苯酚等酚类物质(取代)
(3)含醛基物质(氧化)
(4)碱性物质(如NaOH、Na2CO3)(氧化还原――歧化反应)
(5)较强的无机还原剂(如SO2、KI、FeSO4等)(氧化)
(6)有机溶剂(如苯和苯的同系物、四氯甲烷、汽油、已烷等,属于萃取,使水层褪色而有机层呈橙红色。
)
7.密度比水大的液体有机物有:
溴乙烷、溴苯、硝基苯、四氯化碳等。
?
?
?
8、密度比水小的液体有机物有:
烃、大多数酯、一氯烷烃。
9.能发生水解反应的物质有:
卤代烃、酯(油脂)、二糖、多糖、蛋白质(肽)、盐。
10.不溶于水的有机物有:
烃、卤代烃、酯、淀粉、纤维素
11.常温下为气体的有机物有:
分子中含有碳原子数小于或等于4的烃(新戊烷例外)、一氯甲烷、甲醛。
12.浓硫酸、加热条件下发生的反应有:
苯及苯的同系物的硝化、磺化、醇的脱水反应、酯化反应、纤维素的水解
13.能被氧化的物质有:
含有碳碳双键或碳碳叁键的不饱和化合物(KMnO4)、苯的同系物、醇、醛、酚。
大多数有机物都可以燃烧,燃烧都是被氧气氧化。
14.显酸性的有机物有:
含有酚羟基和羧基的化合物。
15.能使蛋白质变性的物质有:
强酸、强碱、重金属盐、甲醛、苯酚、强氧化剂、浓的酒精、双氧水、碘酒、三氯乙酸等。
16.既能与酸又能与碱反应的有机物:
具有酸、碱双官能团的有机物(氨基酸、蛋白质等)?
17.能与NaOH溶液发生反应的有机物:
(1)酚:
(2)羧酸:
(3)卤代烃(水溶液:
水解;醇溶液:
消去)
(4)酯:
(水解,不加热反应慢,加热反应快)
(5)蛋白质(水解)?
?
?
18、有明显颜色变化的有机反应:
(1).苯酚与三氯化铁溶液反应呈紫色;
(2).KMnO4酸性溶液的褪色;
(3).溴水的褪色;
(4).淀粉遇碘单质变蓝色。
(5).蛋白质遇浓硝酸呈黄色(颜色反应)
[有机物间的相互转化关系]
图1:
图2:
[有机合成的常规方法]
1.引入官能团:
①引入-X的方法:
烯、炔的加成,烷、苯及其同系物的取代
②引入-OH的方法:
烯加水,醛、酮加氢,醛的氧化、酯的水解、卤代烃的水解、糖分解为乙醇和CO2
③引入C=C的方法:
醇、卤代烃的消去,炔的不完全加成,*醇氧化引入C=O
2.消除官能团
①消除双键方法:
加成反应
②消除羟基方法:
消去、氧化、酯化
③消除醛基方法:
还原和氧化
3.有机反应类型
常见的有机反应类型有取代(包括酯化、水解)、加成、加聚、消去、氧化、还原等。
能够发生各种反应类型的常见物质如下:
①烷烃、芳香烃与X2的反应
(1)取代反应②羧酸与醇的酯化反应
③酯的水解反应
①不饱和烃与H2、X2、HX
(2)加成反应的反应
②醛与H2的反应
(3)加聚反应:
烯烃、炔烃在一定条件下的聚合反应。
(4)消去反应:
某些醇在浓H2SO4作用下分子内脱水生成烯烃的反应。
(5)还原反应:
含C=C、—C≡C—、
有机物与H2的加成反应。
①任何有机物的燃烧
(6)氧化反应
KMnO4与烯烃的反应
③醇、醛的催化氧化
一.考点梳理
1.各类烃的衍生物的结构与性质
类别
饱和一元
物的通式
官能团
代表物
主要化学性质
醇
CnH2n+2O
(n≥1)
-OH
乙醇
CH3CH2OH
与Na反应生成H2、催化氧化生成醛、分子内脱水发生消去反应生成烯、与羧酸发生酯化反应。
酚
-OH
苯酚
具有弱酸性,与NaOH溶液发生中和反应。
醛
CnH2nO
(n≥1)
O
‖
—C—H
乙醛
O
‖
CH3—C—H
与H2发生加成反应生成醇,可被O2、银氨溶液、新制Cu(OH)2悬浊液氧化成羧酸。
羧酸
CnH2nO2
(n≥1)
O
‖
—C—OH
乙酸
O
‖
CH3—C—OH
具有酸的通性、能与醇发生酯化反应。
酯
CnH2nO2
(n≥2)
O
‖
—C—O—
乙酸乙酯
O
‖
CH3—C—OC2H5
酸性条件下不彻底水解,生成羧酸和醇。
碱性条件下彻底水解,生成羧酸盐和醇。
二.方法归纳
有机物中羟基(—OH)上的氢电离难易程度:
羧酸>酚>醇
Na
NaOH
Na2CO3
NaHCO3
醇
C2H5OH
生成H2
不反应
不反应
不反应
酚
生成H2
中和反应
反应,不生成CO2
不反应
羧酸
CH3COOH
生成H2
中和反应
反应生成CO2
反应生成CO2
有机化学中几个小规律总结
一、烃类物燃烧规律
1、烃或烃的衍生物的燃烧通式:
2、有机物完全燃烧时,C、H的耗氧关系为C~O2~CO2,4H~O2~2H2O
3、燃烧反应的有关问题,可抓住以下规律
(1)同温同压下烃完全燃烧前后气体体积变化规律
a、若燃烧后生成液态水:
根据:
可得:
规律之一,燃烧前后气体体积一定减小,且减小值只与烃分子中的氢原子数有关,与碳原子数无关。
b、若燃烧后生成气态水:
则烃分子中氢原子数得:
规律之二,燃烧后生成气态水时,总体积只与氢原子数有关,可能增大,不变或减小。
(2)耗氧量规律
C~O2~CO24H~O2~2H2O
质量12g32g44g4g32g36g
物质的量1mol1mol1mol4mol1mol2mol
可得:
规律一,等物质的量的各有机物烃类物质(CxHy)完全燃烧时,耗氧量与的值与(X+Y/4)成正比;相同质量的有机物中,烷烃中CH4耗氧量最大;炔烃中,以C2H2耗氧量最少;苯及其同系物中以C6H6的耗氧量最少;具有相同最简式的不同有机物完全燃烧时,耗氧量相等。
规律二,等物质的量的各种有机物(只含C、H、O)完全燃烧时,分子式中相差若干个“CO2”部分或“H2O”部分,其耗氧量相等。
规律三,烃或烃的含氧衍生物
CxHy或CxHyOz
耗氧量相等
生成CO2量相等
生成H2O量相等
等质量
最简式相同
含碳量相同
含氢量相同
等物质的量
等效分子式
碳原子数相同
氢原子数相同
注释:
“等效分子式”是指等物质的量的两种有机物耗氧量相同,如:
CxHy与CxHy(CO2)m(H2O)n或CxHy(CO2)a(H2O)b
推论:
①最简式相同的两种有机物,总质量一定,完全燃烧,耗氧量一定,生成的CO2量一定,生成的水的量也一定;
②含碳量相同的两种有机物,总质量一定,则生成的CO2的量也一定;
③含氢量相同的两种有机物,总质量一定,则生成的水的量也一定;
④两种分子式等效的有机物,总物质的量一定,完全燃烧,耗氧量一定;
⑤两种有机物碳原子数相同,则总物质的量一定,生成的CO2的量也一定;
⑥两种有机物氢原子数相同,则总物质的量一定,生成的水的量也一定
D
二、烃类熔沸点、密度规律
(1)分子结构相似(同系列中的同系物)随分子量的增大(或C原子数增多);分子间作用力增大,熔沸点增高。
(2)分子式相同的烃,支链越多,熔沸点越低(如戊烷的3种同分异构体的沸点:
正戊烷>异戊烷>新戊烷)C原子5个以上的烷烃唯独新戊烷为气态。
(3)在每一烃的系列中,C原子多的密度大;在同分异构体中,支链少的密度大。
三、一卤代烃同分异构体种类的规律
(1)一个特定结构的烃分子中有多少中结构不同的氢原子,
一般来说,其一卤代烃就有多少种同分异构体。
等效氢法:
正确而迅速地判断出某有机物的一元取代物同分异构体数目,关键在于找出分子中有多少种“等效氢原子”“等效氢原子”可按下述原则进行判断。
a同一碳原子上的氢原子是等效的
b同一碳原子所连甲基上的氢是的效的(如新戊烷分子中的12
个氢原子是等效的)
c处于镜面对称位置上的氢原子是等效的(相当于平面镜成像时,物与像的关系)。
(2)烃的分子结构越不对称(指支链的排列),则其一卤代物的种类(同分构体)就越多,如果烃的分子结构很对称,则一卤代物种数最少。
如分子式为C5H12的烃,一氯代物最多的为异戊烷一氯代物有四种,一氯代物最少的为新戊烷一氯代物只有一种
(3)多卤代物符合互补规律:
若某有机物分子中总共含a个氢原子,
则m元取代物和n元取代物的种类当m+n=a时相等。
专题二官能团与有机物类别、性质的关系
【考纲解读】
学习有机化学就是学习官能团,考纲中对官能团的要求是:
掌握官能团的名称和结构,了解官能团在化合物中的作用,掌握主要官能团的性质和主要化学反应,并能结合同系物的概念加以应用。
【知识梳理】
1、官能团
(1)定义:
(2)常见官能团:
官能团与有机物性质的关系
官能团
化学性质(写方程式)
-C=C-
以乙烯为例
1.加成反应:
(与H2、X2、HX、H2O等)
2.氧化反应:
能燃烧、使酸性KMnO4褪色
3.加聚反应:
-C≡C-
以乙炔为例
1.加成反应:
(与H2、X2、HX、H2O等)如:
乙炔使溴水褪色
2.氧化反应:
能燃烧、使酸性KMnO4褪色
-OH(醇)
以乙醇为例
1.与活泼金属(Na)的反应
2.取代反应:
(1)与HX
(2)分子间脱水:
3.氧化反应:
①燃烧:
②催化氧化:
4.消去反应:
5.酯化反应:
〔O〕
注意:
醇氧化规律(和消去规律)
(1)R-CH2OH→R-CHO
(2)-OH所连碳上连两个烃基,氧化得酮
(3)-OH所连碳上连三个烃基,不能被催化氧化
-OH(酚)
以苯酚为例
1.弱酸性:
(1)与活泼金属反应放H2
(2)与NaOH:
(酸性:
H2CO3>苯酚>HCO3-)
2.取代反应:
3.与FeCl3的显色反应:
4、强还原性,可以被氧化。
5、可以和氢气加成。
-X
以溴乙烷为例
1取代反应:
2消去反应:
-CHO
以乙醛为例
1.加成反应:
2.氧化反应:
(1)能燃烧
(2)催化氧化:
(3)被新制Cu(OH)2、银氨溶液氧化:
-COOH
以乙酸为例
1.弱酸性:
(酸性:
R-COOH>H2CO3)
RCOOH
RCOO-+H+具有酸的通性。
2.酯化反应:
R-OH+R,-COOH
R,COOR+H2O
-COO—
以乙酸乙酯为例
水解反应:
酸性条件
碱性条件
—CONH—
水解反应
知识网络
2、三羟基对比
羟基种类
代表物
Na
NaOH
NaHCO3
Na2CO3
-OH活泼性
酸性
醇羟基
C2H5OH
增
强
中性
酚羟基
C6H5OH
羧羟基
CH3COOH
>H2CO3
3、重要有机物的物理性质归纳
(1)溶解性:
有机物一般溶于有机溶剂。
能溶于水的有机物为:
低级醇、醛、酸
微溶于水:
①苯酚②苯甲酸③C2H5-O-C2H5
(2)密度:
比水轻的:
①烃(含苯及其同系物、矿物油)②酯(含油脂)③一氯烷烃
比水重:
①溴苯②溴乙烷③四氯化碳④硝基苯⑤苯酚
(3)有毒的物质:
苯、硝基苯、甲醇、甲醛
(4)常温下呈气态:
①分子中含碳原子数小于或等于4的烃(新戊烷除外)②CH3Cl、CH3CH2Cl③HCHO
(5)有特殊气味或香味:
①苯②甲苯③CH3COOC2H5④CH3CH2OH
4、几类重要的有机物
(1)糖类:
又叫碳水化合物,一般符合Cn(H2O)m的通式,但是符合该通式的不一定就属于糖类,不符合该通式的也可以属于糖类。
葡萄糖:
HOCH2(CHOH)4CHO既含醛基,又含多个羟基。
故葡萄糖既有醛的通性,又有
多元醇的通性:
单糖
(1)氧化反应:
能发生银镜反应和与新制Cu(OH)2悬浊液反应,也能在体内完全氧化(C6H12O6)
(2)加成反应(醛基与H2)(3)酯化反应(4)分解制乙醇
果糖:
结构、性质不要求,但要掌握葡萄糖与果糖互为同分异构体。
二糖蔗糖:
(1)非还原性糖,即不含醛基
(2)水解得到一葡一果
糖(C12H22O11麦芽糖:
(1)还原性糖,即含有醛基
(2)水解得到两分子葡萄糖。
蔗糖和麦芽糖互为同分异构体。
类淀粉:
(1)非还原性糖
(2)水解最终得到葡萄糖(3)遇I2变蓝色
多糖纤维素:
含有几千个单糖单元,每个单糖单元含有三个羟基。
(C6H10O5)n
(1)非还原性糖
(2)水解最终得到葡萄糖,但水解比淀粉困难。
(3)酯化
淀粉、纤维素的通式都为(C6H10O5)n,但两者并非同分异构体
(2)氨基酸和蛋白质
(1)两性
两性←氨基酸蛋白质
(2)盐析(可逆)
(含-COOH、(3)变性(不可逆)
-NH2)含肽键(4)颜色反应
(5)灼烧有烧焦羽毛气味
(6)水解得氨基酸
【典型例题】
[例1]乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是①属于芳香族化合物;②不能发生银镜反应;③分子式为C12H20O2;④它的同分异构体中可能有酚类;⑤1mol该有机物水解时只能消耗1molNaOH。
A.②③⑤B.②③④C.①②③D.①④⑤
[例2]丁子香酚可做香味剂,萨罗可做消毒剂,二者的结构简式如下图所示,下列说法不正确的是
A.萨罗的分子式为C13H10O3
B.丁子香酚与浓溴水只发生取代反应
C.萨罗和丁子香酚均能发生氧化反应
D.丁子香酚和萨罗均能与氯化铁溶液发生显色反应
[例3]下列三种有机物是某些药物中的有效成分:
对羟基桂皮酸布洛芬阿司匹林
以下说法正确的是
A.三种有机物都能与浓溴水发生反应
B.三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
C.将等物质的量的三种物质加入氢氧化钠溶液中,阿司匹林消耗氢氧化钠最多
D.使用FeCl3溶液和稀硫酸不能鉴别出这三种有机物
专题二官能团与有机物类别、性质的关系
【强化训练】单选题
1、食品香精菠萝酯的生产路线(反应条件略去)如下:
下列叙述错误的是
A.步骤
(1)产物中残留的苯酚可用FeCl3溶液检验B.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
C.苯氧乙酸和菠萝酯均可与NaOH溶液发生反应D.步骤
(2)产物中残留的烯丙醇可用溴水检验
2、胡椒粉是植物挥发油的成分之一。
它的结构式为HO—
—CH2CH=CH2,下列叙述中不正确的是
A.1mol胡椒粉最多可与4mol氢气发生反应B.1mol胡椒粉最多可与4mol溴发生反应
C.胡椒粉可与甲醛发生反应,生成聚合物D.胡椒粉在水中的溶解度小于苯酚在水中的溶解度
3、咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下所示:
关于咖啡鞣酸的下列说法不正确的是()
A.分子式为C16H18O9
B.与苯环直接相连的原子都在同一平面上
C.咖啡鞣酸水解时可消耗8molNaOH
D.与浓溴水既能发生取代反应又能发生加成反应
4、莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。
下列关于这两种有机化合物的说法正确的是()
A.两种酸都能与溴水反应B.两种酸遇三氯化铁溶液都显色
C.鞣酸分子与莽草酸分子相比多了两个碳碳双键
D.等物质的量的两种酸与足量金属钠反应产生氢气的量不相同
5、霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物。
下列关于MMF的说法正确的是()
A.MMF能溶于水B.MMF能发生取代反应和消去反应
C.1molMMF能与6mol氢气发生加成反应D.1molMMF能与含3molNaOH溶液完全反应
6、茉莉醛具有浓郁的茉莉花香,其结构如图所示:
关于茉莉醛的下列叙述错误的是()
A.在加热和催化剂的作用下,能被氧气还原B.能被高锰酸钾酸性溶液氧化
C.在一定条件下能与溴发生取代反应D.能与氢溴酸发生加成反应
7、胡椒酚是植物挥发油中的一种成分。
关于胡椒酚的下列说法:
①该化合物属于芳香烃;②分子中至少有7个碳原子处于同一平面;③它的部分同分异构体能发生银镜反应;
④1mol该化合物最多可与2molBr2发生反应。
其中正确的是()
A.①③B.①②④C.②③D.②③④
8、已知碳碳单键可以绕键轴自由旋转,结构简式为如下图所示的烃,下列说法中正确的是()
A.分子中至少有9个碳原子处于同一平面上
B.分子中至少有10个碳原子处于同一平面上
C.分子中至少有11个碳原子处于同一平面上
D.该烃属于苯的同系物
9、“诺龙”属于国际奥委会明确规定的违禁药品中合成代谢类的类固醇,其结构简
式如图下列关于“诺龙”的说法中不正确的是()
A、分子式是C18H26O2B、能在NaOH醇溶液中发生消去反应
C、既能发生加成反应,也能发生酯化反应D、既能发生氧化反应,也能发生还原反应
10某有机物的结构简式如下图,该物质1mol与足量的NaOH溶液反应,消耗NaOH的物质的量为()
A.5molB.6molC.5nmolD.6nmol.
11、邻羟基苯甲酸,俗名水杨酸,其结构简式为
,当与物质A的溶液反应生成化学式为C7H5O3Na的盐,A可以是下列中的()
A.NaClB.Na2SO4C.NaOHD.NaHCO3
12、中草药秦皮中含有的七叶树内酯(每个折点表示一个碳原子,氢原子未画出),具有抗菌作用。
若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为
A.2molBr22molNaOHB.2molBr23molNaOH
C.3molBr24molNaOHD.4molBr24molNaOH
13、对如图所示有机物的叙述中不正确的是
A.常温下,与Na2CO3溶液反应放出CO2
B.能发生水解反应,lmol该有机物能与8mol的NaOH反应
C.与稀硫酸共热能生成两种有机物
D.该物质的化学式是C14H10O9
14、维生素C的结构简式如右图:
有关它的叙述错误的是
A.是一个环状的酯类化合物B.易起氧化及加成反应
C.可以溶解于水D.在碱性溶液中能稳定地存在
15、右图是某有机物分子的简易球棍模型,该有机物中只含C、H、O、N四种元素。
下列关于该有机物的说法中错误的是
A.分子式为C3H7O2NB.能发生取代反应
C.能通过聚合反应生成高分子化合物D.不能跟NaOH溶液反应
16、最近,在市场上的某些辣椒油中,人们发现了一种工业染料苏丹红(一号)。
苏丹红(一号)的结构筒式为:
,下列关于它的说法不正确的是
A.苏丹红(一号)的分子式为C16H12N2OB