高中化学 化学方程式复习素材 新人教版必修1.docx
《高中化学 化学方程式复习素材 新人教版必修1.docx》由会员分享,可在线阅读,更多相关《高中化学 化学方程式复习素材 新人教版必修1.docx(18页珍藏版)》请在冰豆网上搜索。
高中化学化学方程式复习素材新人教版必修1
必修1化学方程式复习
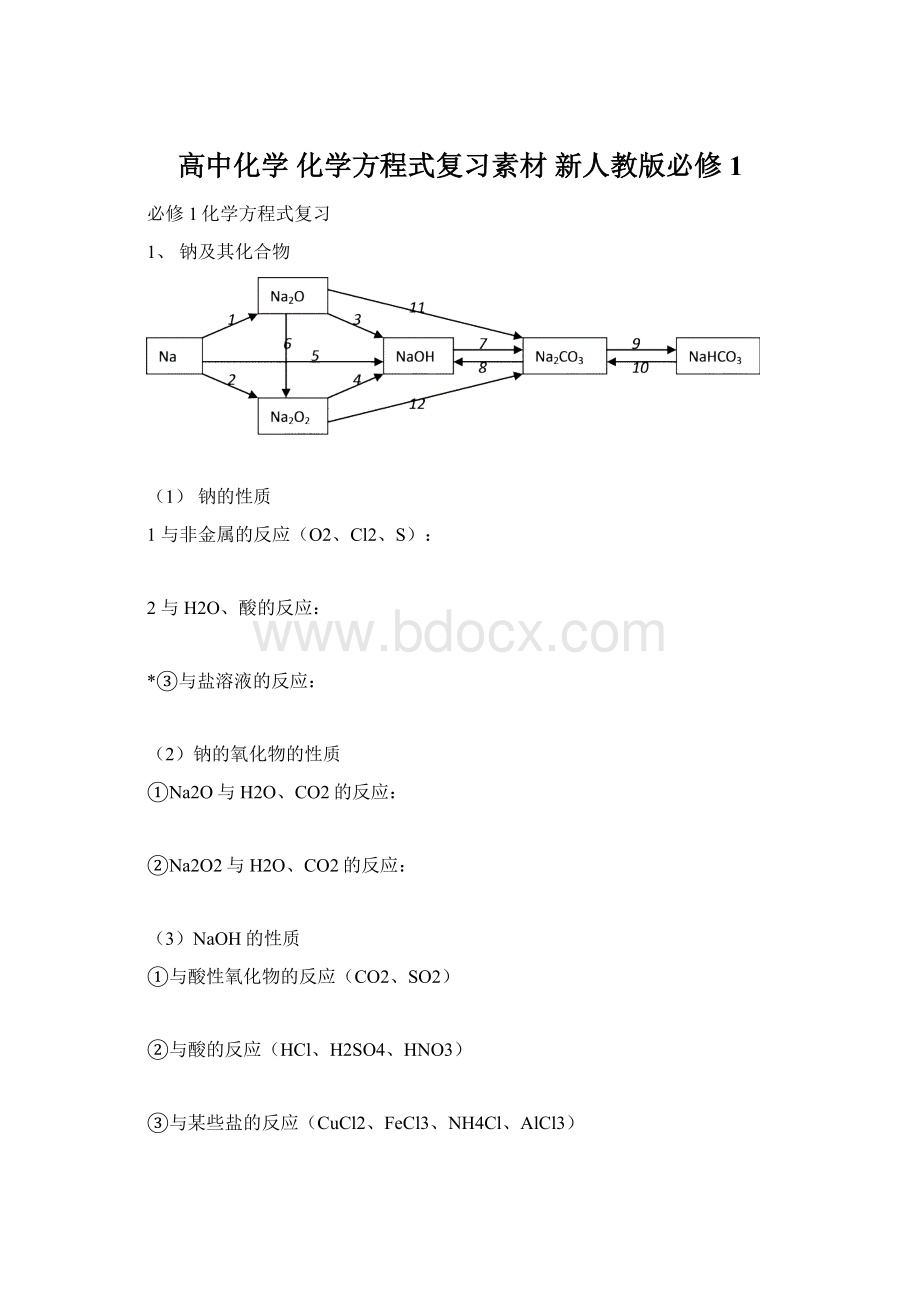
1、钠及其化合物
(1)钠的性质
1与非金属的反应(O2、Cl2、S):
2与H2O、酸的反应:
*③与盐溶液的反应:
(2)钠的氧化物的性质
①Na2O与H2O、CO2的反应:
②Na2O2与H2O、CO2的反应:
(3)NaOH的性质
①与酸性氧化物的反应(CO2、SO2)
②与酸的反应(HCl、H2SO4、HNO3)
③与某些盐的反应(CuCl2、FeCl3、NH4Cl、AlCl3)
(4)Na2CO3的化学性质
①与酸的反应(HCl、H2SO4、HNO3)
②与某些碱的反应【Ca(OH)2、Ba(OH)2】
③与某些盐的反应【CaCl2、Ba(NO3)2】
④与CO2、H2O的反应
(5)NaHCO3的化学性质
①与酸的反应(HCl、H2SO4、HNO3)
②与某些碱的反应【Ca(OH)2、Ba(OH)2、NaOH】
③与某些盐的反应(NaHSO4)
④热不稳定性
2、
Al3+
铝及其化合物
Al(OH)3
Al
Al2O3
AlO2—
(1)Al的化学性质(还原性)
①与非金属反应(Cl2、O2):
②与强酸的反应(HCl、H2SO4):
3与强碱的反应【NaOH、KOH、Ba(OH)2】:
4置换反应【CuCl2、Hg(NO3)2、AgNO3、Fe2O3】:
(2)Al2O3的的化学性质
①电解熔融的Al2O3制取Al
②与强酸的反应(HCl、H2SO4、HNO3)
③与强碱的反应【NaOH、KOH、Ba(OH)2】
(3)Al(OH)3的化学性质
①热分解:
②与强酸的反应(HCl、H2SO4、HNO3):
③与强碱的反应【NaOH、KOH、Ba(OH)2】:
(4)铝盐的化学性质(AlCl3)
①与弱碱的反应(NH3·H2O)
②与强碱的反应【NaOH、KOH、Ba(OH)2】
(5)偏铝酸盐的化学性质(NaAlO2)
①与弱酸的反应(CO2溶液)
②与强酸的反应(HCl)
3、铁及其化合物
(1)Fe的化学性质(还原性)
①与非金属单质的反应(O2、Cl2、*S)
②与水、酸的反应(H2O、HCl、稀H2SO4)
③与盐溶液的反应【CuSO4、Hg(NO3)2、AgNO3】
④与其它氧化剂的反应(FeCl3、*稀HNO3)
(2)FeO、Fe2O3、Fe3O4的化学性质
①FexOy与C、CO、H2的反应
②与酸的反应(HCl、稀H2SO4、*稀HNO3)
(3)Fe(OH)2、Fe(OH)3的化学性质
①制备(可溶铁盐、亚铁盐与NaOH、NH3·H2O)
②热分解
③与酸反应(HCl、稀H2SO4、*稀HNO3)
④Fe(OH)2被氧化成Fe(OH)3
(4)铁盐、亚铁盐的【FeCl2、FeCl3、FeSO4、Fe(SO4)3】的化学性质
①与碱反应(可溶铁盐、亚铁盐与NaOH、NH3·H2O)
见前铁的氢氧化物制备
②Fe2+、Fe3+的检验(沉淀法、显色法)
③Fe2+与氧化剂反应(Cl2、稀HNO3)生成Fe3+
④Fe3+与还原剂反应(Fe、Cu、*S2—、*I—)生成Fe2+
4、硅及其化合物的性质
1
(1)Si的化学性质
1与HF、NaOH水溶液反应制取H2
②与氧化剂F2、O2、Cl2、C化合
(2)SiO2的化学性质
1与碳酸盐高温制取硅酸盐(Na2CO3、CaCO3)
2与碱性氧化物反应(Na2O、CaO)
3
与强碱的反应(NaOH)
4
与HF的反应
5被还原的反应(+C高温)
(3)H2SiO3的化学性质
①热分解
2弱酸性(与NaOH、KOH反应)
③制取反应(Na2SiO3溶液与盐酸或通入CO2)
5、氮及其化合物
(1)氮气的化学性质
①与O2反应(体现还原性)
②与H2反应(体现氧化性)
(2)氨气的化学性质
①与水反应
②与酸反应(HCl、H2SO4、HNO3)
③还原性(与O2、*CuO、*NO、*NO2、*Cl2)
(3)铵盐的化学性质【NH4Cl、NH4NO3、NH4HCO3、(NH4)2SO4】
①NH4Cl、NH4HCO3的热不稳定性
②NH4Cl与强碱【NaOH、Ca(OH)2、*CaO】反应(制取氨气)
(4)氮氧化物的性质
①NO与O2的反应(体现还原性)
②NO2与H2O(*与NaOH)的反应(歧化反应)
*③NO与H2O、O2的反应
*④NO2与H2O、O2的反应
(5)HNO3的化学性质
①HNO3的酸性(与酸碱指示剂、碱性氧化物、碱、某些盐)
②HNO3的氧化性(与金属Cu、非金属C)
*③与其它还原剂的反应(Fe2+、S2—、I—)
6、硫及其化合物
①
②
③
④硫酸的化学性质
Ⅰ.稀硫酸的酸性(与指示剂、活泼金属、碱性氧化物、碱、某些盐)
Ⅱ.浓硫酸的强氧化性(与Cu、C、*S、*H2S反应)
*⑥FeS+H2SO4=H2S↑+FeSO4
*⑦H2S+2NaOH=Na2S+2H2O
*⑧2H2S+3O2点燃2H2O+2SO2(O2充分)
*⑨2H2S+O2点燃2H2O+2S↓(O2不充分)
2H2S2H2+2S↓
镁、铝图象题
1.铝盐与强碱的反应(以AlCl3与NaOH的反应为例)
(1)反应:
向AlCl3溶液中滴加NaOH溶液时,发生的反应依次为
Al3++3OH—=Al(OH)3↓Al(OH)3+OH—=AlO2—+2H2O
(2)图象:
成的Al(OH)3与加入的NaOH的量的关系可用图象表示,如右图:
(3)有关计算
①根据AlCl3和NaOH的量计算生成Al(OH)3的量
②根据AlCl3和Al(OH)3的量计算需要NaOH的量
NaOH的量
n(NaOH)
当NaOH不足时
n(NaOH)=3n[Al(OH)3]
当NaOH过量时
n(NaOH)=3n(Al3+)+{n(Al3+)-n[Al(OH)3]}=4n(Al3+)-n[Al(OH)3]
例1:
向30mL1mol/L的AlCl3溶液中逐渐加入浓度为4mol/L的NaOH溶液,若产生0.78g白色沉淀,则加入的NaOH溶液的体积可能为()
A.3mLB.7.5mLC.15mLD.17.5mL
解析:
已知n(AlCl3)=0.03mol,n[Al(OH)3]=0.01mol,由沉淀的物质的量小于氯化铝的物质的量可推知此题可能有两个答案:
一是氢氧化钠不足,二是氢氧化钠过量。
由两者反应的离子方程式Al3++3OH—=Al(OH)3↓,Al(OH)3+OH—=AlO2—+2H2O知,当碱的量不足时,则n(NaOH)=3n[Al(OH)3]=0.03mol,V(NaOH)=7.5mL;当碱过量时,则n(NaOH)=4n(Al3+)-n[Al(OH)3]=0.11mol,V(NaOH)=0.0275L=27.5mL。
答案:
B.
2.偏铝酸盐与强酸的反应(以NaAlO2和HCl的反应为例)
(1)反应:
向NaAlO2溶液中滴加稀盐酸时,发生的反应依次为
AlO2—+H++H2O=Al(OH)3↓Al(OH)3+3H+=Al3++3H2O
(2)图象:
生成的Al(OH)3与加入的稀盐酸的量的关系可用图象表示,如右下图:
(3)有关计算:
①根据NaAlO2和HCl计算生成Al(OH)3的量
②根据Al(OH)3和NaAlO2的量计算需要加入的HCl的量
HCl的量
n(HCl)
当HCl不足时
n(HCl)=n[Al(OH)3]
当HCl过量时
n(HCl)=n(AlO2—)+3{n(AlO2—)-n[Al(OH)3]}
=4n(AlO2—)-3n[Al(OH)3]
3.向Mg2+与Al3+的酸性溶液中逐滴加入强碱溶液
(1)现象:
无明显现象→出现沉淀→渐多→最多→减少→不变
(2)反应:
依次为①H++OH—=H2O②Al3++3OH—=Al(OH)3↓
③Mg2++2OH—=Mg(OH)2↓④Al(OH)3+OH—=AlO2—+2H2O
(3)图象如右:
例2:
右下图是向MgCl2、AlCl3混合液中依次加入M和N
时生成沉淀的物质的量与加入的M和N的体积关系图(M、
N各表示盐酸或氢氧化钠溶液中的一种),以下结论不正
确的是()
A.混合溶液中c(AlCl3)∶c(MgCl2)=1∶1
B.混合溶液中c(AlCl3)∶c(MgCl2)=3∶1
C.点V之前加NaOH溶液,点V之后加盐酸
D.所加盐酸与NaOH溶液中溶质的物质的量浓度相同
解析:
V后加碱时沉淀溶解不完,故C正确;设AlCl3物质的量为1mol,则生成Al(OH)3为1mol,A~B段溶解过程消耗NaOH也是1mol(据反应式),由图推知O~V段每等份相当于NaOH物质的量为1mol,那么O~A段生成Al(OH)3消耗NaOH应是3mol,即3等份,则余下两等份即2mol应为生成Mg(OH)2所消耗NaOH的物质的量,故Mg(OH)2为1mol,MgCl2也应是1mol,由此可判断A选项是正确的,B错误;对于D选项,可分析图象A~B,B~C两段,前者消耗沉淀后者生成沉淀,从而有关系式:
Al(OH)3~OH—~AlO2—~H+,故可推知n(OH—)=n(H+),又因两段耗溶液体积相等,因此易得D选项也是正确的。
答案:
B
氮氧化物与水反应的计算
有关NO、NO2、O2、惰性气体(不与它们和水反应的气体)混合通入水的计算,可能的组合情况有:
①NO2;②NO2、惰性气体;③NO2、O2;④NO2、NO;⑤NO2、NO、O2;⑥NO、O2...
解题思维:
不论是什么组合,有NO2的就先根据方程式:
3NO2+H2O=2HNO3+NO,算出NO体积(有时可利用气体体积差量求解),然后根据方程:
4NO+3O2+2H2O=4HNO3,先判断过量情况再计算;没有NO2的直接依据方程:
4NO+3O2+2H2O=4HNO3先判断过量情况再计算。
计算时要注意最后剩余的无色气体有两种可能性:
可能是NO、也可能是O2,即可得到两组答案,应考虑全面,防止漏解。
1.一定条件下将盛有等体积的NO2和N2的试管倒立于水槽中,反应后剩余气体的体积为原体积的。
3.一定条件下,将盛有15mLNO和NO2的试管倒立于水槽中,反应后剩余气体的体积为8mL,则原来气体体积中NO的体积为多少?
4.一定条件下,将50mLO2与160mLNO2的混和气体通入倒立于水槽中并盛满水的量筒中,最后剩余气体的体积为多少?
5.一定条件下,将100mLNO通入一个盛满水且倒立于水槽中的大量筒中,然后,再通入60mLO2,则最后的气体体积应为多少?
6.先后分别将50mLNO、80mLNO2、60mLO2通入一个盛满水且倒立于水槽中的大量筒中,求最终剩余气体的体积为多少?
8.将容积为50mL的量筒内充满二氧化氮和氧气的混合气体,倒置量筒在盛满水的水槽里,一段时间后,量筒里剩余气体体积为5mL。
则原混合气体中NO2和O2体积比可能是或。
9.在标准状况下,将NO2、NO、O2混合后充满容器,倒置于水中,完全溶解,无气体剩余,若产物也不扩散,则所得溶液物质的量浓度c的数值范围是()。
答案:
1、2/3;3、4.5L;4、10mL氧气;5、过量20mLNO;6、10mLNO;8、18:
7或43:
7;9、1/39.2<c<1/28
综合应用
【例1】“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,如溶液中的氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如下所示:
附:
4FeS2+15O2+2H2O=2Fe2(SO4)3+2H2SO4
(1)100t含FeS2质量分数为60%的硫铁矿,原料在氧化中的总利用率为90%,石最多可以制得硫酸铁t。
(2)人们可利用Fe2(SO4)3作氧化剂溶解铜矿石Cu2S),然后加入铁屑得到铜,该过程中发生的离子反应方程式(请将①补充完整并完成②):
①Cu2S+Fe3++H2O→Cu2++Fe2++()+SO42—;
②。
(3)请评价细菌冶金的优点:
。
(说出一点即可)
解析:
(1)二硫化亚铁转化成硫酸铁的关系式为:
2FeS2~Fe2(SO4)3,m(FeS2)=100t×60%=60t,硫酸铁质量为60t×90%×(400/200)=90t。
(2)根据电荷守恒、元素守恒配平该离子方程式,由原子守恒知,①缺项为H+。
(3)细菌冶金的优点主要有节约能源、减少污染。
【例2】铝用途广泛,用铝土矿(主要成分为Al2O3·nH2O、少量SiO2和Fe2O3)制取Al有如下途径:
(1)滤液A可用于净水,其净水原理用离
子方程式表示为:
、
。
(2)灼烧时盛放药品的仪器名称是:
(3)步骤Ⅴ中发生反应的化学方程式是:
(4)步骤Ⅲ中生成固体C的离子反应方程式为:
;
滤液C中c(Na+)=2c(SO42—)+2c(CO32—-)+c(HCO3—)+c(OH—)-c(H+)(用电荷守恒式表达)。
(5)取滤液B100mL加入1mol/L盐酸200mL,沉淀量达最大且质量为11.7g。
则滤液B中
c(AlO2—)=;c(Na+)2mol/L(填“>”、“=”或“<”)。
解析
(1)铝土矿溶解在过量稀硫酸溶液中,过滤后得到的滤渣是SiO2,滤液为Al2(SO4)3、H2SO4、
Fe2(SO4)3的混合液。
因Al3+、Fe3+能水解产生具有吸附作用的Al(OH)3、Fe(OH)3胶体,具有净水作用。
向Al2(SO4)3、H2SO4、Fe2(SO4)3的混合液中加入过量NaOH时,Al2(SO4)3转化为NaAlO2,Fe2(SO4)3转化为Fe(OH)3,经过滤后得到滤渣Fe(OH)3。
滤液B中含有NaAlO2,向滤液B中通入过量CO2时,生成Al(OH)3和NaHCO3,经过滤后得到固体C[Al(OH)3]和含有NaHCO3、Na2SO4的滤液C。
(2)在坩埚中灼烧Al(OH)3得到Al2O3。
(3)电解熔融的Al2O3得到Al和O2。
(4)NaHCO3、Na2SO4的混合溶液中,根据电荷守恒有:
c(Na+)=2c(SO42—-)+2c(CO32—-)+c(HCO3—)+c(OH—-)-c(H+)。
(5)滤液B为含有NaOH、NaAlO2、Na2SO4的混合溶液,加入盐酸生成Al(OH)311.7g,即n(NaAlO2)=0.15mol,c(AlO2—)=1.5mol/L。
NaOH、NaAlO2都转化为NaCl,再加上Na2SO4的量,故c(Na+)>2mol/L。
【例3】已知实验室制取SO2的反应原理为:
Na2SO3+H2SO4(浓)△Na2SO4+SO2↑+H2O。
请用下列装置设计一个“制取SO2并将其转化为SO3”的实验,且测定其转化率。
(附:
SO3熔点16.8℃)
(1)这些装置的连接顺序(按气体从左至右的方向)是→→→→→→→(填各接口的编号)。
(2)实验时甲仪器的作用与原理是:
;
。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是
。
(4)Ⅳ处观察到的现象是。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会(填“增大”、“减小”或“不变”)。
(6)用nmolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重mg,则本实验中SO2的转化率为。
【例4】已知稀硝酸与铜反应时,NO3—还原为NO;浓硝酸与铜反应时,NO3—还原为NO2。
现将25.6gCu投入到50mL12mol/L的浓硝酸中,充分反应后,收集到4.48L(标况)NO和NO2的混合气体。
(1)被还原的硝酸的物质的量为;
(2)25.6gCu与50mL12mol/L的硝酸反应后,剩余物为,其物质的量为;(3)容积为4.48L的干燥烧瓶充满上述反应中收集的NO和NO2的混合气体(标况)后倒置于水中,须再通入L(标况)O2才能使溶液充满烧瓶。
(4)如果往反应后的体系内再加入200mL4mol/L的稀硫酸,是否有气体逸出?
写出反应的离子方程式,并计算气体的体积(标况)。
例3答案:
(1)ahibcfgd;
(2)使浓硫酸能顺利地滴入烧瓶中;维持烧瓶内压强与分液漏斗内压强相等;(3)先加热V2O5,后缓缓滴入浓硫酸;(4)有无色(或白色)晶体(或固体)生成;(5)减小;
(6)×100%或×100%
例4答案:
(1)0.2mol;
(2)铜;0.2mol;(3)2.24;
(4)逸出NO;3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O;2.99L