乳腺钼靶和超声对照.docx
《乳腺钼靶和超声对照.docx》由会员分享,可在线阅读,更多相关《乳腺钼靶和超声对照.docx(29页珍藏版)》请在冰豆网上搜索。
乳腺钼靶和超声对照
钼靶摄影与乳腺超声检查结果的准确联系首先需要完整的乳腺X线检查以及在做超声检查前建立适当的鉴别诊断。
相关的结果应该描述为肿块、结构不对称、结构扭曲、可疑钙化以及所有这些特征的联合。
钼靶摄影和乳腺超声所显示的病变位置、大小、形状、边界应该是一致的,要仔细的相互对应,以免发生错误。
本文将详细介绍只发生于女性患者的疾病如乳头溢液、假体植入以及乳腺肿块的钼靶和超声检查以及两种检查方法的相互对应。
病变位置
钼靶摄影与超声或者核磁成像结果相互对应的关键是将病变在乳腺的三维空间位置具体化并将其转换为相应的影像形式。
钼靶摄影通常采取站立位或上身直立坐位。
乳腺超声在检查内侧象限时通常取仰卧位,检查外侧象限时取对侧卧位。
核磁成像时患者俯卧,把乳房垂于成像线圈内。
乳腺相对位置固定的参照标志只有乳头和胸壁。
钼靶摄影中的位置通常按照象限(外上、内上、外下、内下)、乳晕下、乳头中央区及腋尾区描述。
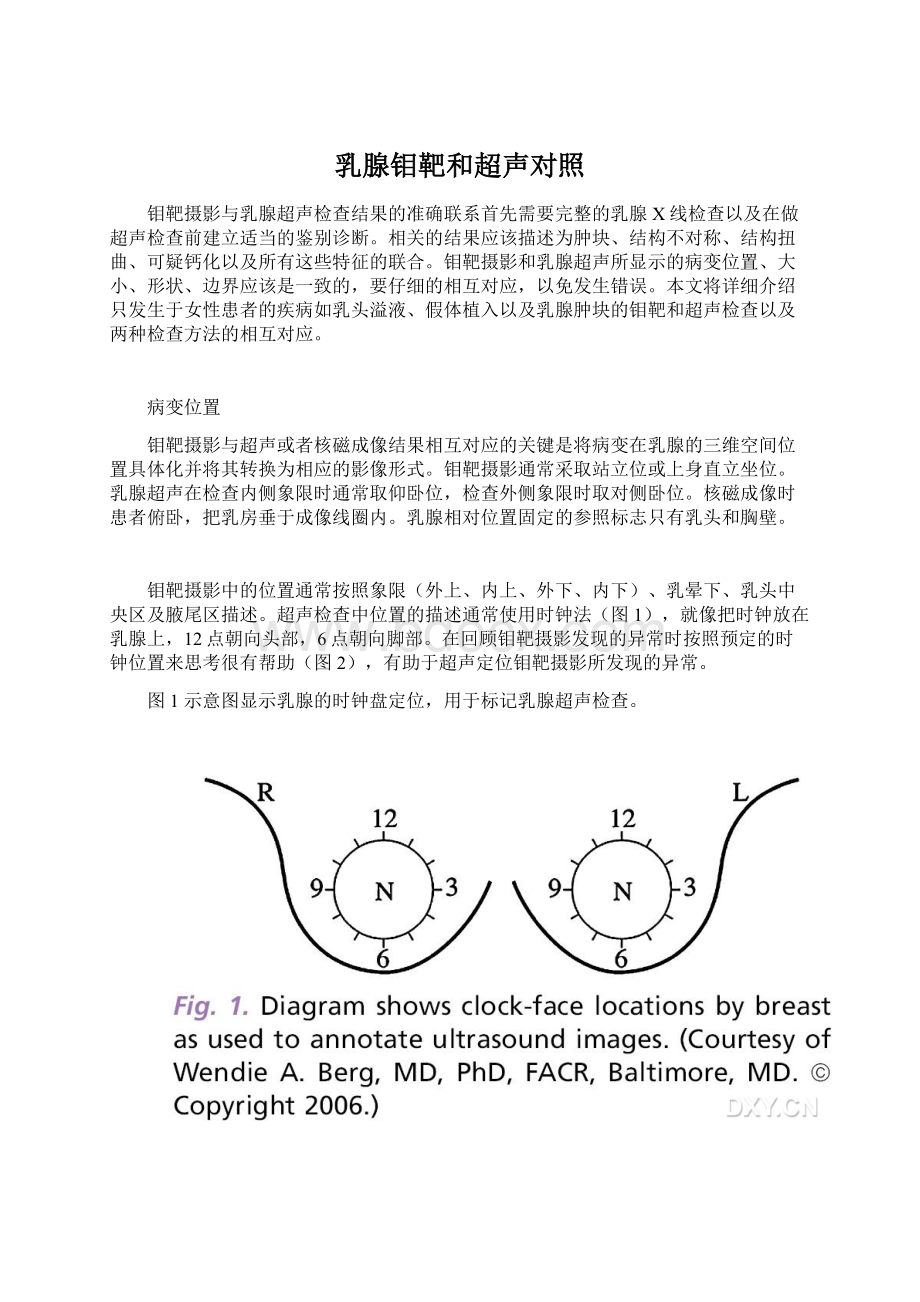
超声检查中位置的描述通常使用时钟法(图1),就像把时钟放在乳腺上,12点朝向头部,6点朝向脚部。
在回顾钼靶摄影发现的异常时按照预定的时钟位置来思考很有帮助(图2),有助于超声定位钼靶摄影所发现的异常。
图1示意图显示乳腺的时钟盘定位,用于标记乳腺超声检查。
图2首先由头足投照(CC,轴位)片上病变的位置推断其在时钟盘的位置,其次利用内斜位相(MLO)判断肿块位于乳腺的上方(乳头上方)还是下方(乳头的下方)。
三角关系是理解钼靶发现异常的三维空间时钟位置的一个重要部分。
钼靶摄影的内斜位(MLO)投照角度有一定变化,其投照平面平行于患者的胸大肌。
而对于超声定位,医生需要知道真正90度侧位钼靶摄影中病变的确切位置。
通过三角关系,有了钼靶摄影两个位相〔轴位(CC)和内斜位(MLO)〕的图像,我们就可以推断病变在第三个位相——90度侧位(无论内—外投照或外—内投照)上的位置,并据此确定病变在乳腺中的空间位置(图3)。
三角关系也能帮助定位那些只能在常规钼靶摄影一个角度(CC或者MLO位)上才能显示出来的病变的空间位置。
这时,就要加拍一个正侧位。
如果病变可以在正侧位和内斜位同时显示,那么它在轴位的位置就可以被推断出来(图3)。
乳腺外象限的病变,其位置从CC相到MLO相再到正侧位相一点点的向下移动(看片顺序:
正侧位相位于MLO相右侧),而外象限的病变从CC相到MLO相再到正侧位则一点点的向上移动(记忆的口诀是“leadfallsandmuffinsrise”,经与作者联系,其意Lead为金属,L代表外侧,即外侧的金属逐渐下沉,Muffins单词为松饼,M代表内侧,松饼轻于铅,即内侧的松饼逐渐上移。
由此来记忆乳腺不同位置病变在不同钼靶相上的位置变化。
译者注)
图3三角关系。
根据以乳头为校准的CC相和中间的MLO相,,只凭这两张钼靶片就可利用三角关系推断肿块在第三幅中的位置。
乳腺外侧象限的肿块(图中卵圆形的肿块)从CC相到MLO相再到内—外侧相,位置逐渐下移,而乳腺内侧象限的肿块(图中的毛刺样肿块)从CC相到MLO相再到内—外侧相,位置逐渐上移。
滚动乳腺CC位照片(医师双手至于患者乳腺上部和下部,以乳头为轴,方向相反转动后,再次拍轴位片,译者注。
)可以帮助定位一个只能在CC位上显示的病变。
用这种方法,乳腺上半部向外侧(CCRL位)或内侧(CCRM位)旋转,病变随着上半部乳腺移动的,认为是位于乳腺上象限(图4)。
只能在MLO上显示的位于乳腺上后方的病变最常见位于腋尾区,通常能在外侧放大的CC相上显示(图5)。
图474岁女性,ACC相上发现双侧乳腺结构限局性不对称,BMLO相上未显示,C点压缩CC相确认存在边缘不清楚的肿块(箭头所示),DCCRL相,肿块(箭头所示)向外侧移动,证实位于乳腺上象限,E右侧乳腺12点超声横切位扫查显示边界不清楚的肿块,伴有后方回声衰减,超声引导下组织活检显示为浸润性小叶癌(ILC)。
图544岁女性,右侧腋尾区扪及肿块。
A肿块在CC相中无法显示,B只能在MLO相中显示(箭头所示),这种情况的肿块通常位于外侧,C侧方放大的CC相上确认肿块的存在(箭头所示)。
超声放射状切面D和垂直放射状切面E上显示边界不清晰的低回声肿块(箭头所示),超声引导下组织活检显示为I级浸润性导管癌。
当获知钼靶照片上病变的预期时钟位置后,就要进一步明确病变距乳头的距离,以及病变距皮肤的深度。
钼靶摄影中,描述时通常把乳腺组织按厚度分成三部分(浅层、中层、深层)或者测量病变到乳头的距离。
为了更好的与超声对应,描述病变到皮肤的深度(表浅的、中间深度的或后部,贴近胸壁的)比单一测量病变到乳头的距离更好。
钼靶照片上,这种距离皮肤的深度与距离乳头的深度可能相关,也可能无关。
例如,一个位于乳腺最外侧贴近皮肤层的病变,在超声上显示为表浅的病变,而在钼靶摄影中则投射到后侧深层位置(图6)。
即使当今应用的12-15MHz的线阵探头,声束也不能很好的聚焦到表浅的位置,因此,应用超声检查表浅部位时在体表涂抹大量耦合剂或者加用导声垫把病变到探头的距离增加到5-7mm,才能正确的显示浅表病变的超声特征。
图680岁女性,接受过激素替代治疗,右乳外侧新近发现一个结节(箭头所示)。
肿块从CC相(A)到MLO相(B)位置向下移动,推断应该位于右乳9点表浅的腺体层内。
C点压缩CC相证实为位置表浅,边界清晰的卵圆形肿块(箭头所示)。
D超声定位显示一个位置表浅的囊肿(箭头所示)位于右乳9点半位置,距乳头8cm,与钼靶所示肿块的大小、形状、位置相吻合。
虽然在钼靶摄影中肿块位置靠后,但是肿块位置靠近皮肤因此在超声中表现为位置表浅的肿块
钼靶摄影中表浅的病变应该在超声中位于前三分之一的乳腺组织内,更接近于皮肤而不是胸壁(图7)。
同样,钼靶摄影两个相位中都接近后方胸壁(而不是皮肤)的病变在超声中应该接近胸大肌(图8)。
了解钼靶摄影中病变在乳头的上方、下方、内侧或外侧的距离同样有助于超声对病变的定位(图6)。
超声图像上,应该用厘米说明病变中心沿着皮肤表面到乳头的距离。
38mm或50mm宽的探头本身就可以作为标志来可靠的估计和记录这一数值。
图744岁女性钼靶点压缩CC相(A)显示位于乳头正后方的两个毛刺样肿块(短箭头指示前面的肿块,长箭头指示中心部的肿块)B最初的超声横切面扫查显示的位于乳头表浅部位的毛刺样肿块,第二个肿块在超声中无法显示。
C第二次超声检查,扩大扫查视野,显示前方的肿块(短箭头)及其稍深处的形状不规则的低回声肿块(长箭头),与钼靶上的中心部肿块相对应。
超声引导下对两个肿块进行了组织活检,显示为原位癌及中等分化程度的浸润癌,以小叶结构为主。
DMR对比增强图像也清晰的显示两个肿块。
图849岁女性,钼靶发现左乳后方腺体内一肿块(箭头),只能在MLO相(A)上显示出来。
放射状切面超声(B)显示3点半位置贴近胸壁处的囊肿(箭头)P胸肌
当病变位于乳腺的上、内、下以及外象限周围时,乳腺超声检查中病变的位置和到乳头的距离通常可以很好的与钼靶摄影相对应。
在钼靶两个相位中都位于乳头正后方的病变,在超声中也位于乳头的正后方。
超声在检查乳头后区域时,需注意使探头采取一定角度,以避免乳头-乳晕复合体产生的声影干扰。
乳头正后方的病变,超声和钼靶测量病变到乳头的距离有很大的不同(图9),因为钼靶的测量几乎完全是从皮肤表面/乳头到病变的距离。
而超声上,因为病变直接在乳头的后方,病变沿皮肤表面与乳头的水平距离几乎为零。
仰卧位超声检查,探头轻轻的放在乳腺上时,乳腺的总体厚度大多是2-4cm,而钼靶检查时乳头到胸壁的距离可以轻松达到10-13cm。
图9MLO图像(A)上显示边界清楚的肿块(箭头)在乳头正后方贴近胸壁处,在外侧或内侧放大CC相上无法显示,表明肿块位于中心位置。
B超声定位扫查在乳头(N)后方直接显示病变,呈贴近胸壁的暴风雪样超声表现,提示为硅胶肉芽肿。
本例58岁女性曾有过植入假体切除史。
钼靶上肿块到乳头的距离为8cm,而超声上沿着肿块对应的皮肤表面到乳头的水平距离仅1-2cm。
虽然值得在钼靶摄影的两个相位中都识别出病变,但有时候是不可能或者是不必要的。
在MLO上很难包括乳腺最靠后内侧部位的病变(图10)。
同样,虽然外侧放大CC相通常可以显示乳腺侧后的病变(图5),但是极靠后或后外侧的病变很难在CC相中充分显示(图8、9)。
因为大多数病变的相对位置可以接近地从单一的钼靶照片中推断出来,所以超声可以成功的定位这些异常区域(图10)。
通常,超声对乳腺适当可能的病变位置进行全面的扫查即已足够(例如,时钟表盘的镜像位置,10点和2点)。
如果需要,象后面将要讨论的一样,可以在超声的监视下在病变部位放置不透射线的标记物(如,铅芯),然后再做一次钼靶摄影就可得到适当的病变相互关系。
必要时,对于只能在钼靶CC相中显示的病变,可以让患者按钼靶摄影时的坐位姿势对乳腺进行扫查,这种方法尤其适用于乳腺较大的患者。
图1071岁女性只在钼靶CC相(A)上显示右乳极靠内后方边缘的一针刺状伴有钙化的肿块(箭头),B钼靶MLO相无法显示,C点放大CC相可以确认(箭头),D超声放射切面显示右乳内侧2点半胸骨旁可见不规则低回声肿块(箭头)伴有钙化,与钼靶上的肿块对应。
超声引导组织活检证实为2级浸润性导管癌和原位导管癌(DCIS)。
图13原位导管癌(DICS)在超声上可以很微小。
47岁女性翻转恢复序列MR图像(A)上显示左乳6点乳晕后方的部分增强信号和附近的几个囊肿(箭头)。
(B)静脉注射0.1mmol/kg(Gadolinium-diethylenetriaminepentaaceticacid,钆二甘醇胺苯乙酸)1.5分钟后矢状面T1加权螺旋梯度回波图像上显示左乳6点乳晕后方部分簇状增强(箭头)。
(C)超声定位检查MR图像上显示的异常,发现一个等回声管状肿块(箭头)以及深方的几个囊肿(箭头)。
超声引导肿块组织活检显示为中等分化级别的原位导管癌(DCIS)。
图14超声上很难发现等回声的肿块。
56岁女性,(A)点压缩MLO钼靶摄影上显示一毛刺状的肿块(短箭头),已知为浸润性小叶癌。
临近的卵圆形部分边界清晰,部分模糊的类似脂肪小叶的肿块(长箭头)在超声上(B)显示为等回声肿块。
超声引导下肿块组织活检显示为纤维腺瘤。
图15等回声的恶性病变很容易在超声上漏诊。
73岁女性,乳腺致密有结节已经25年。
(A)CC钼靶成像显示对称性致密乳腺组织,尽管左乳长期存在的触诊异常得以显示(箭头),(B)出次超声未能发现左乳上的异常,显示为回声的不均匀。
六个月后的随访超声检查发现左乳钼靶对应的位置一8mm的肿块(箭头),(C超声放射状切面,D超声垂直放射状切面),(E)重复超声检查,发现4.4x1.9x3.4cm的等回声分叶状肿块(箭头)。
超声引导组织活检发现为胶质癌,手术切除肿块大小4.5cm。
起初认为是全部病变的小肿块,位于肿物,被再次显示(箭头)。
大小
因为大部分病变位于乳腺内部,所以钼靶射像对病变体积仅轻度放大。
随着放大比率增加,乳腺到探测器的距离也相应增加。
一般钼靶测量结果不应该超过超声测量径线的20%(图16)。
超声检查中恶性病变与正常组织之间可能会有一个逐步的转变,边界不清楚,通常周边有一个有回声的间质反应形成的厚晕环。
一般在测量病变大小时不应该包括这个晕环。
与脂肪回声相同的肿块很难显示,因此准确测量其大小也很困难(图15)。
对于伴有导管内侵犯的肿块,更是特别难以决定如何测量大小(图17)。
超声检查中发现的导管内实性成分通常代表DCIS,而DCIS除非伴有钙化,否则很难在钼靶摄影中发现。
测量超声显示的肿块主要成分的大小通常与病理中测量的肿瘤的大小相吻合,因为病理测量肿瘤大小时并不包括DCIS本身。
虽然超声不能很好的测量DCIS,但是发现了由DCIS侵犯导致的导管扩张可以帮助外科医生手术前制定手术方案,保证切除的标本中包含DCIS成分,避免手术切除后,切缘肿瘤检查仍呈阳性。
超声可以精确的测量2cm或以下的不伴有导管侵犯的孤立性浸润癌。
图16大小的差异。
(A)47岁女性发现左乳外上肿物,钼靶MLO相上显示为3.5cm的致密肿块(箭头)。
(B)超声上显示这个区域有一1.4cm的囊肿,认为是良性病变。
(C)12个月后钼靶随访显示触诊的肿块明显增大,大小为7.0cm(箭头),并伴有腋尾可疑淋巴结肿大(**)。
(D)随后的超声检查,1.4cm的囊肿仍然可见(**),但位于一6.5cm的厚壁囊性肿块(箭头)前方,该后壁囊肿由3级浸润性导管癌所致。
(E)扩展视野超声更好的显示了肿块。
较大的肿块在最初超声检查中被漏诊主要是因为检查视野太小,没有把后方的组织包括在内。
钼靶和超声结果的对应,钼靶测量结果不应该大于超声测量径线的20%。
这个病例中,大小的差异(钼靶上的3.5cm与超声上的1.4cm)远远超过了这一比值。
图1744岁女性,钼靶MLO相(A)上可见一明显的肿块和附近的部分钙化(箭头)。
(B)超声上所见的导管内侵犯(箭头)是一个应记录下来的重要征象,代表了DCIS,术前导管侵犯的记录有助于手术切缘足够大,保证切缘干净无肿瘤成分。
浸润性成分通常限制于肿瘤的主体部分,本病例为2.8cm的3级浸润性导管癌伴发DCIS。
肿块
钼靶两个相位中都可见到的8mm或者更大的肿块,呈散在分布以及边界清楚不伴有钙化者,可以直接进行超声检查。
超声发现为单纯囊肿(无回声、边界清晰、壁薄、后方回声增强)为良性病变,不需要做进一步的检查。
对于小于8mm的病变,超声不能可靠的辨别单纯囊肿与实性肿物。
钼靶点压缩或点放大摄影有助于在超声检查前显示肿块的边缘特征。
对于中高度可疑,特别是伴有钙化的肿块,超声检查前建议进行放大CC位和900侧位钼靶摄影,以便更好的描绘病变的形态特征和更好的显示潜在的恶性程度。
对于有潜在恶性的肿块,超声的主要作用是引导组织活检(图10)。
超声也可以用来评价钼靶阴性的多病灶、多中心或双侧的病变。
钼靶和超声结果的对照除了要观察位置和大小,还应观察病变的形态。
美国放射学会针对钼靶和超声的乳腺影像报告和数据系统词典中,对多数乳腺肿物关键性的特点描述相似。
钼靶摄影中的毛刺样肿块应该在超声检查中显示为不规则、低回声、毛刺样肿块,通常伴有后方回声衰减和有回声环或声晕。
随后,超声可以引导组织活检。
超声检查中放射疤痕通常比肿瘤更微小。
一项最近的研究显示超声检出了93%的肿瘤而只有43%的放射疤痕被发现。
当肿块活检诊断为放射疤痕或放射性硬化病变呈团块状或结构扭曲时,建议手术切除病变组织,因为活检周围的未取样组织有恶性的可能。
钼靶摄影中边界不清的肿块可疑恶性,Liberman等人研究表明,边界不清的肿块中有44%是恶性的。
良性和恶性病变的钼靶影像表现可以很不清晰,但超声却可以清楚的确认良性病变特征(图18)。
一些钼靶上认为是部分边界清楚,部分受上方覆盖的组织的影响而边界不清楚的肿块,实际上被超声证实是边界不清甚至是毛刺状的肿块(图19)。
由于不同成像方法内在的成像原理不同,在钼靶上显示密度相似的肿块由于具有不同的声学特点,因而通常可以在超声中被敏锐的分辨出来。
实际上,对于钼靶表现为致密型腺体的乳房,超声检查的最大可能潜在价值是发现附加病变。
图1846岁女性乳腺内可触及肿块,(A)钼靶点压缩CC摄影显示一边界不清楚的明显肿块。
(B)超声垂直放射切面上显示对应部位为一单纯囊肿。
图19A40岁女性在最初钼靶筛查放大CC相上显示一部分边界不清楚的结节(箭头),B超声横切面上显示钼靶对应部位的异常为大部分边界清楚,部分不规则的低回声肿块(箭头)。
组织活检显示为包含浸润性小叶癌和原位小叶癌在内的纤维腺瘤。
钼靶摄影与超声检查结果相互对照最大的困难之一是患者的病变多发、双侧、部分边界清晰、部分边界模糊。
一般来说,这样的病变通常被认为是良性的,恶性程度小于多数筛查人群,不需要进一步的超声检查。
然而,每一个肿块都需要仔细的观察,尤其是任何表现为边界模糊的或者钼靶摄影后认为需要进一步行超声检查的或需要加拍特殊相位片的肿块。
即使多数边界清晰的双侧乳腺肿块是囊肿或纤维腺瘤,在这种情况下也需要超声检查较大的或是临床可疑的肿块(图20)。
当超声表现为多发、双侧、相似表现的卵圆形边界清楚的实性肿块时,一般认为这些肿块为良性,可以在6个月后随访。
这种方法的有效性在研究中。
图2068岁女性已知乳腺内有多个囊肿。
(A)钼靶发现多发双侧的肿块,大部分边界清晰,与3年前钼靶照片(左图)比较,部分肿块增大了,部分肿块缩小了。
一个明显的可触及肿块,由皮肤的标记物标记显示位于右乳(箭头)。
(B)点压缩CC相上显示最大的肿块边界为毛刺样(箭头)。
(C)超声显示证实了最大的肿块为毛刺样并伴有高回声晕(短箭头),超声引导组织活检及切除,显示为低度分化的浸润性导管癌。
虽然双侧、多发、边界清楚的肿块通常为良性病变,但应该仔细观察每个肿块的边缘。
超声适用于任何可疑的肿块以及较大的、明显的肿块。
基于初步钼靶影像得出适当的鉴别诊断,很有必要。
钼靶摄影和超声检查能够互相补充,他们有各自的优势和不足。
例如,钼靶初步诊断一个结节可能为乳房内的淋巴结,你一定要知道,这些结节可能在超声中无法分辨。
超声检查中,正常的淋巴结经常混合在周围实质中(图21),而反应性淋巴结和转移性淋巴结通常皮质增厚,呈低回声或无回声,淋巴门变小(反应性的淋巴结皮质增厚通常对称,而转移性淋巴结多不对称)。
点压缩或放大钼靶比超声更有助于描述一个边界清楚的可疑为正常淋巴结的肿块。
含有脂肪组织的淋巴结门位于侧面时,就可以显示淋巴结的蚕豆形外观(图22)。
图21超声中正常淋巴结可以混合于周围的实质中。
60岁女性,超声放射状切面(A)及垂直放射切面(B)显示一淋巴结,皮质很薄(箭头),与周围脂肪组织回声相似或稍低,中心部髓质存在脂肪,回声增强。
结构不对称和扭曲
评价结构的不对称性时,与先前的钼靶结果对比可能会发现这种不对称很稳定,可以排除进一步检查的需要。
Sickles发现在钼靶筛查人群中,一次乳腺摄影中约有3%的患者出现结构不对称,这其中有超过一半的不对称可能会由于仅仅是筛查影像而被认为是阴影,从而认为没有意义。
忽视结构的不对称是漏诊恶性病变的常见原因。
新发现的局部结构不对称通常需要在做超声检查前进行附加位置的钼靶检查,大约有20%的恶性可能。
点压缩相摄影有助于确认潜在肿块的存在,通常能比常规钼靶摄影更好的显示肿块边缘(图4、23)。
图2362岁女性,每年一次行钼靶筛查照相,最近在CC相(A)和MLO相(B)上发现右乳内下象限后方的组织结构不对称(箭头)。
(C)点压缩MLO相更好的显示一个边界不清楚的肿块(箭头)。
(D)超声垂直放射切面上显示钼靶上对应位置的肿块,位于右乳5点,大小形状与钼靶相同,边界不清的肿块。
超声引导下组织活检显示为2级浸润性导管癌。
正常组织变异引起的不对称性在钼靶摄影中没有钙化或者结构的扭曲,内部可见交织分布的脂肪,通常与超声中纤维腺体的回声相对应(图24、25)。
如果超声显示的结构其大小、形态、位置与钼靶中的表现相一致,就可以认为这种不对称为正常的变异。
在现在的实践中,这种典型的发现,尤其是不可触及的不对称,通常可以不做组织活检。
如果进行组织活检,与结果相对应的发现为间质纤维或者是萎缩的乳腺组织(图25)。
图24CC相(A)上显示出条带状的结构不对称(箭头),在点压缩CC相(B)上部分变薄(箭头),内部似乎含有交织的脂肪组织。
(C)超声上显示该处为均匀的高回声带状组织(箭头),与钼靶上所见的大小和形状相对应。
超声上表现为典型的正常变异的纤维组织。
图2547岁女性,钼靶MLO相(A)上显示左乳腋尾区球形的不对称结构(箭头)。
(B)超声上显示该处为卵圆形回声增强区(箭头),其内小低回声区代表残余的脂肪和/或终末导管小叶单元。
超声上表现符合正常变异的纤维组织。
由于该处触诊模糊,因此行超声引导下组织活检,证实为间质纤维组织。
特别一提的是浸润性小叶癌(ILC),通常只在一个相位中表现为局部结构不对称,多在CC相(图4)。
点压缩相可能会显示出相关的结构扭曲。
超声尤其有助于发现钼靶上轻微的或隐匿的ILC,虽然超声发现的病变声像图变化也可能非常微妙(图26,27)。
ILC的大小在钼靶和超声图像上通常低估,尤其是超过3cm的肿瘤。
MR成像特别有助于显示和确定ILC的范围。
图2656岁女性,钼靶CC相(A)上很好的显示右乳外侧结构扭曲(箭头)。
(B)超声放射切面上显示右乳外侧10点位置一略显低回声的肿块,形状不规则(箭头)。
超声引导下组织部活检显示为浸润性小叶癌。
图2756岁女性,多灶性浸润性小叶癌。
钼靶点放大侧位(内—外)相(A)上显示轻微的结构扭曲(长箭头)及附近的毛刺样肿块(短箭头)。
(B)初始的超声检查显示一单一,直立的低回声肿块(长箭头)伴有后方回声衰减和Cooper’s韧带(*)的扭曲和牵拉,该处异常证实与钼靶上的结构扭曲相对应。
超声引导下组织活检显示为浸润性小叶癌(ILC)。
(C)几周后再次行超声检查显示邻近部位的一不规则低回声肿块(短箭头)伴有后方回声衰减。
超声引导下组织活检证实为多灶性浸润性小叶癌(ILC)。
使用标记针(没显示)证明第二个肿块对应于钼靶上显示的更表浅的毛刺样肿块。
钼靶新发现的无法解释的不对称或结构扭曲即使缺少超声相对应的表现,也应该做进一步的检查或组织活检,这种情况下MR检查有助于进一步的诊断。
特别重要的是,如果钼靶摄影中发现的局部可疑不对称在点压缩相中明显变薄,并不能排除进一步超声检查的必要。
这一原则同样适用于结构的扭曲(图28)。
图2852岁女性,钼靶筛查MLO相上显示右乳上方的结构扭曲(箭头)。
(B)点压缩MLO相上认为该区域变薄,没有临床意义。
四个月后,患者发现乳头回缩。
(C)此时超声在右乳10点同样位置发现大小为6cm的不规则低回声肿块,位于结构扭曲部位的中心。
超声引导下组织活检显示为浸润性小叶癌(ILC)。
钼靶中的结构扭曲在超声中可能表现为Cooper’s韧带的牵拉(图27)。
超声能发现潜在在的肿块(图27),并用于引导组织活检。
手术后的瘢痕是引起结构扭曲的常见原因(图29)。
超声除了能发现结构扭曲、低回声肿块、通常伴有后方回声衰减的区域外,还可能发现肿块连续到皮肤切口处的通道,通常该处伴有皮肤增厚(大于2mm,图29)甚至皮肤皱缩。
象钼靶发现的一样,瘢痕深方伴发的积液一旦吸收,其表面通常应呈凹陷形,并随着时间逐渐消失。
图29手术后瘢痕。
乳房肿瘤切除术后4年,超声垂直放射切面(A)及放射切面(B)显示一回声减低区,伴有后方回声衰减及Cooper’s韧带的牵拉(短箭头)。
放射切面图像病变联系到皮肤表面瘢痕的通道征象很明显(长箭头),同时伴有皮肤的增厚,与术后瘢痕一致。
钙化
许多人认为超声对评价不确定的钙化没有意义。
虽然超声对进一步观察钙化的形态或钙化的范围意义不大,但是超声证实在评价可疑的DCIS中有用。
很多时候,如果被侵犯的导管由于肿瘤或坏死碎片导致扩张,相应的超声图像可以清晰的显示出来,这些肿瘤或坏死组织碎片可以伴有或不伴有钙化(图30、31)。
当超声可以显示DCIS时可以在超声引导下进行组织活检。
超声几乎不能帮助发现未预期的朝向乳头的导管DCIS侵犯或者是多病灶、多中心的DCIS,而MR对这种情况的检查更准确。
图3084岁女性,对侧乳腺浸润性导管癌。
钼靶放大MLO相(A)上显示节段性的多形性、粗糙不均匀的钙化(箭头)。
超声定位(B)显示扩张的导管内含有由钙化造成的强回声点(箭头)。
超声引导下组织活检显示为高分化的DCI