高考化学备考优生百日闯关系列 专题09 工艺流程题 教师版.docx
《高考化学备考优生百日闯关系列 专题09 工艺流程题 教师版.docx》由会员分享,可在线阅读,更多相关《高考化学备考优生百日闯关系列 专题09 工艺流程题 教师版.docx(16页珍藏版)》请在冰豆网上搜索。
高考化学备考优生百日闯关系列专题09工艺流程题教师版
专题09工艺流程题
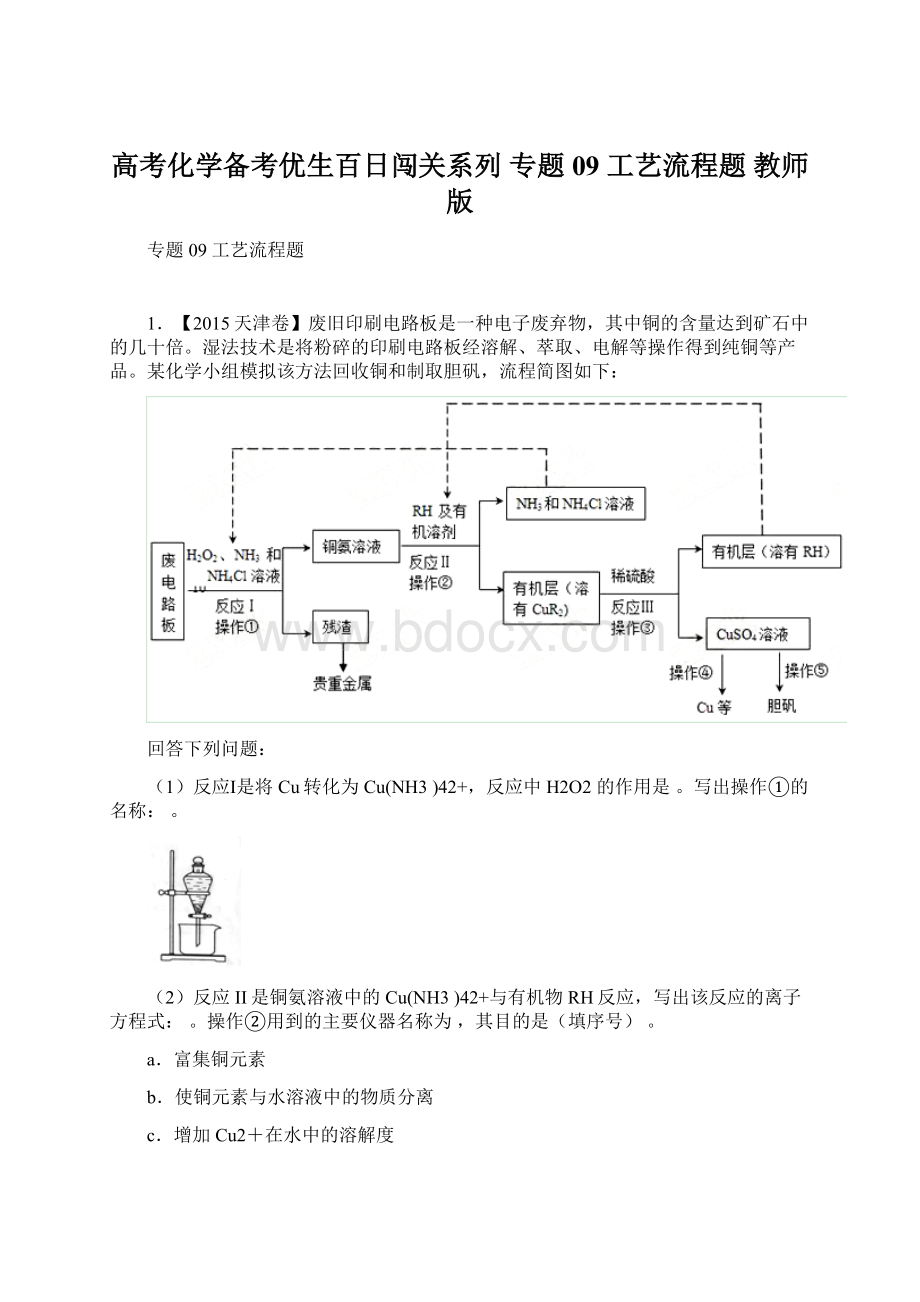
1.【2015天津卷】废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。
湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。
某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:
回答下列问题:
(1)反应Ⅰ是将Cu转化为Cu(NH3)42+,反应中H2O2的作用是。
写出操作①的名称:
。
(2)反应II是铜氨溶液中的Cu(NH3)42+与有机物RH反应,写出该反应的离子方程式:
。
操作②用到的主要仪器名称为,其目的是(填序号)。
a.富集铜元素
b.使铜元素与水溶液中的物质分离
c.增加Cu2+在水中的溶解度
(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和。
若操作③使用右图装置,图中存在的错误是。
(4)操作④以石墨作电极电解CuSO4溶液。
阴极析出铜,阳极产物是。
操作⑤由硫酸铜溶液制胆矾的主要步骤是。
(5)流程中有三次实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是。
循环使用的NH4Cl在反应Ⅰ中的主要作用是。
【答案】
(1)作氧化剂过滤
(2)Cu(NH3)42++2RH=2NH4++2NH3+CuR2分液漏斗ab
(3)RH分液漏斗尖端未紧靠烧杯内壁液体过多
(4)O2H2SO4加热浓缩冷却结晶过滤
(5)H2SO4防止由于溶液中的c(OH-)过高,生成Cu(OH)2沉淀
【考点定位】本题主要考查物质的制备流程的分析判断,离子方程式的书写,基本操作的判断等
【名师点睛】对于工业流程的分析是该问题的难点。
将该工业流程转化为化学的问题及掌握基本的化学知识是解题的关键。
包括反应原理的判断、基本操作的判断、仪器的选择、物质或操作作用的分析、电解反应原理的应用、操作方案的设计、误差分析、物质质量分数的计算等。
这类题目距离生活较远,因此学生会感到无从下手。
从流程图中可分析问题的答案,如经过操作1将溶液与残渣分离,则该操作一定是过滤,从溶液中得到固体的操作一定需蒸发浓缩的步骤等,根据加入某物质前后反应物质的成分变化判断发生的化学反应及该物质的作用,所以本题以化学工业为载体,考查学生的分析问题与解决问题的能力为主。
2.【2015福建卷】无水氯化铝在生产、生活中应用广泛。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为。
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
已知:
物质
SiCl4
AlCl3
FeCl3
FeCl2
沸点/℃
57.6
180(升华)
300(升华)
1023
步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是(只要求写出一种)。
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是。
③已知:
Al2O3(s)+3C(s)=2Al(s)+3CO(g)ΔH1=+1344.1kJ·mol-1
2AlCl3(g)=2Al(s)+3Cl2(g)ΔH2=+1169.2kJ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为。
步骤Ⅲ经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为。
结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是。
【答案】
(1)Al3++3H2O
Al(OH)3+3H+
(2)
防止后续步骤生成的AlCl3水解或增大反应物的接触面积,加快反应速率。
Fe或铁;
Al2O3(s)+3C(s)+2Cl2(g)=2AlCl3(g)+3CO(g)ΔH=+174.9kJ/mol;
NaCl、NaClO、NaClO3;
除去FeCl3,提高AlCl3纯度。
【考点定位】考查盐的水解、反应条件的控制、热化学方程式的书写、物质反应充分的确定及化学试剂的作用的判断的知识。
【名师点睛】离子方程式、热化学方程式都是化学用语,是学习化学的基础。
要掌握反应规律。
在分析该题目,书写盐水解的离子方程式时,要知道,盐水解的程度是微弱的,水解产生的物质很少,不能形成沉淀或气体,因此写离子方程式应该不能写沉淀符号或气体符号,要用可逆号“
”,不能使用等号“==”,要掌握盐的水解规律是:
有弱才水解,谁弱谁水解,谁强显谁性。
在进行热化学方程式书写时,要注意物质的存在状态、物质的多少与能量相对应。
注意热化学方程式的系数只表示物质的量,因此可以用分数系数,也可以用整数系数。
反应放出的热量多少,只与反应物质起始状态和终了状态有关,与反应的物质多少有关,而与反应途径无关。
利用盖斯定律进行反应热的计算,不仅可以计算能够直接发生反应的物质的反应热,也可以计算不能直接反应的或不容易测定的反应的反应热。
在进行反应条件的控制、化学试剂的选择使用时,从固体物质的表面积的大小、盐的水解等多个对化学反应速率影响的角度分析,从参加反应的物质及可能发生的反应判断溶液的成分。
掌握物质的化学性质、盐的水解规律、化学反应速率的影响因素是解决本题的关键。
从化学原理的角度、用化学语言作答;要抓住主要问题,针对具体问题作具体分析。
具体答题要点如下:
(1)答是所问:
要看清题目要求,按要求答题。
如:
写离子方程式还是化学方程式;写物质的名称还是化学式等方程;式中反应物、产物的分子式书写要正确;尤其是化学方程式要配平,电极反应式和化学方程式一定要书写正确;正确使用等号或可逆符号;沉淀、气体、水溶液等符号要标明。
(2)准确、规范:
回答问题的要准确全面,注意语言表达的规范性,例如评价或比较实验方案时要全面考虑:
反应物种类多少、是否易得、是否对环境有污染;反应产物的种类多少,对目标产物的分离和提纯是否有影响;反应条件是否苛刻;仪器、设备是否要求高;工艺流程、实验步骤的多少。
(3)注意答题的完整性:
要答到对产品生产的影响这一步!
①除杂:
除去……中的……(只写“除杂”一类是不给分的)
②干燥:
除去……气体中的水蒸气,防止……
(4)注意归纳答题的套路:
①增大原料浸出率(离子在溶液中的含量多少)的措施:
搅拌、升高温度、延长浸出时间、增大气体的流速(浓度、压强),增大气液或固液接触面积
②加热的目的:
加快反应速率或促进平衡向某个方向(一般是有利于生成物生成的方向)移动
③温度不高于××℃的原因 适当加快反应速率,但温度过高会造成(如浓硝酸)挥发//(如H2O2、NH4HCO3)分解//(如Na2SO3)氧化或促进(如AlCl3)水解等,影响产品的生成
④从滤液中提取一般晶体(溶解度随温度升高而增大的晶体)的方法【蒸发浓缩<至有晶膜出现>、冷却结晶、过滤、洗涤(冰水洗、热水洗、乙醇洗)、干燥】
⑤从滤液中提取溶解度受温度影响较小或随温度升高而减小的晶体的方法(蒸发浓缩、趁热过滤 <如果温度下降,杂质也会以晶体的形式析出来>、洗涤、干燥)
⑥溶液配制、灼烧、蒸发、过滤用到的仪器
⑦控制某反应的pH值使某些金属离子以氢氧化物的形式沉淀(调节pH所用试剂为主要元素对应的氧化物、碳酸盐、碱,以避免引入新的杂质;pH分离时的范围确定、范围过小的后果<导致某离子沉淀不完全>或过大的后果<导致主要离子开始沉淀>)
⑧减压蒸馏(减压蒸发)的原因:
减小压强,使液体沸点降低,防止(如H2O2、浓硝酸、NH4HCO3)受热分解\挥发
⑨检验溶液中离子是否沉淀完全的方法:
将溶液静置一段时间后,向上层清夜中滴入沉淀剂,若无沉淀生成,则离子沉淀完全
⑩洗涤沉淀:
沿玻璃棒往漏斗中加蒸馏水至液面浸没沉淀,待水自然流下后,重复操作2-3次
⑪检验沉淀是否洗涤干净的方法:
取少量最后一次的洗涤液于试管中,向其中滴入某试剂,若-----------,则沉淀洗涤干净
⑬冰水洗涤的目的:
洗去晶体表面的杂质离子并降低被洗涤物质的溶解度,减少其在洗涤过程中的溶解损耗
⑭乙醇洗涤的目的:
降低被洗涤物质的溶解度,减少其在洗涤过程中的溶解损耗,得到较干燥的产物
⑮蒸发、反应时的气体氛围:
抑制某离子的水解,如加热蒸发AlCl3溶液时为获得AlCl3需在HCl气流中进行
⑯事先煮沸溶液的原因:
除去溶解在溶液中的(如氧气)防止某物质被氧化
1、选取无机化工流程的片段,结合中学化学知识设计问题,一般需要用化学反应原理解释、分析化工问题。
2、流程与实验相结合的模式,即以制备某物质的流程为载体,将中学教材中的气体制备联系起来命题。
3、考查课本中重要的化工原理。
4、结合实际生产和流程图设计问题,考查元素及化合物知识等。
从生产目的出发,读懂流程图
明确原料和产品(包括副产品),即箭头进出的方向,指入的加入的物质(反应物),指出的是生成物(产物)。
既要看框内的物质,也要看框外的物质和操作,里外结合,边分析,边思考,从易出着手。
初步分析流程步骤,了解操作过程
依据流程图分析反应原理,紧扣信息,搞清流程中每一步发生了什么反应——知其然;
依据有关反应原理,明确操作目的(如沉淀反应、除杂、分离等)——知其所以然
结合问题中提供的信息,规范答题
联系储存的知识,有效地进行信息的利用,回答问题。
如对反应条件的分析可以从以下几个方面着手:
对反应速率有何影响、对平衡转化率有何影响、对综合生产效率有何影响,对设备有何要求及环境保护等
可归纳为:
1.硫酸锰可作为饲料添加剂用于增肥,也可用于某些化学反应的催化剂,易溶于水,不溶于乙醇。
工业上常用软锰矿(主要成分为MnO2,含有MgSO4等杂质)制备硫酸锰,其简化流程如下:
(1)为了加快软锰矿与硫酸、黄铁矿反应的速率,工业上除采用粉碎软锰矿的方法,还可以用哪些方法 。
(写两种)
(2)流程中黄铁矿(主要含FeS2)和FeSO4的作用都是作还原剂,请写出FeSO4与软锰矿反应的离子方程式 。
(3)双氧水和氨水的作用分别是 .
(4)操作II包括 、 、 、洗涤、干燥,可制得MnSO4·H2O粗产品.洗涤中最好选用 ’
A.稀硫酸 B.水 C.乙醇. D.浓硫酸
【答案】
(1)加热、搅拌(答案合理即可,2分)
(2)MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O(3分)
(3)双氧水氧化Fe2+转化为Fe3+;氨水使Fe3+转化为Fe(OH)3沉淀而除去(2分)
(4)蒸发浓缩(1分)冷却结晶(1分)过滤(1分)C(1分)
【考点定位】本题考查化学流程的分析、基本操作。
【名师点睛】无机工业流程题能够以真实的工业生产过程为背景,体现能力立意的命题为指导思想,能够综合考查学生各方面的基础知识及将已有知识灵活应用在生产实际中解决问题的能力,所以这类题成为近年来高考的必考题型。
流程题的解题思路为:
明确整个流程及每一部分的目的→仔细分析每步反应发生的条件以及得到的产物的物理或化学性质→结合基础理论与实际问题思考→注意答题的模式与要点。
解决本类题目的基本方法和步骤为:
(1)从题干中获取有用信息,了解生产的产品。
(2)然后整体浏览一下流程,基本辨别出预处理、反应、提纯、分离等阶段。
(3)分析流程中的每一步骤,从以下几个方面了解流程:
①反应物是什么;②发生了什么反应;③该反应造成了什么后果,对制造产品有什么作用。
抓住一个关键点:
一切反应或操作都是为获得产品而服务。
2.碳酸铈[Ce2(CO3)3]为白色粉末,难溶于水,主要用作生产铈的中间化合物。
它可由氟碳酸铈精矿经如下流程。
(1)氟碳酸铈的化学式为为CeFCO3,该化合物中,Ce的化合价为。
(2)氧化焙烧生成的铈化合物为二氧化铈(CeO2