单克隆抗体制备实验过程.docx
《单克隆抗体制备实验过程.docx》由会员分享,可在线阅读,更多相关《单克隆抗体制备实验过程.docx(10页珍藏版)》请在冰豆网上搜索。
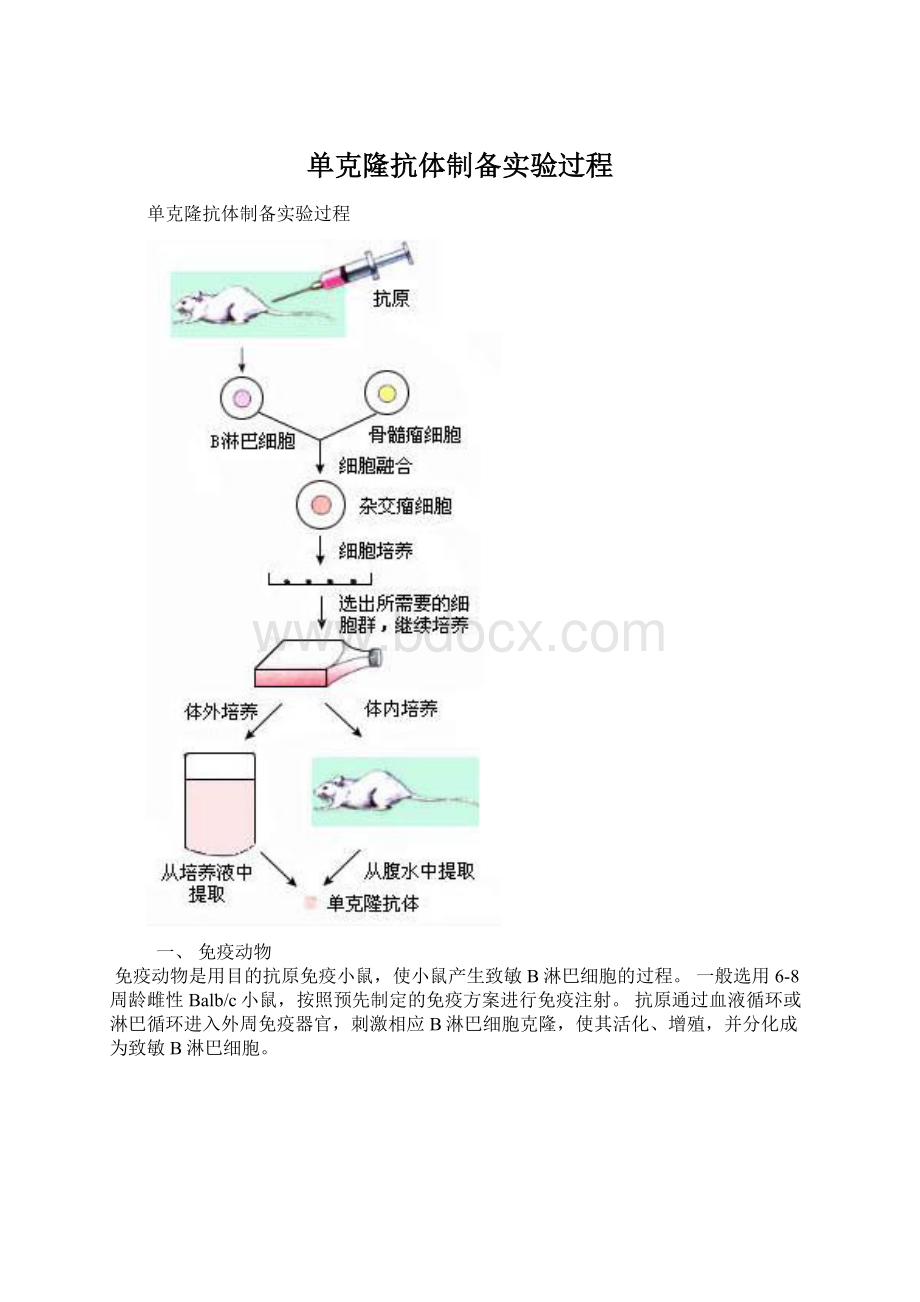
单克隆抗体制备实验过程
单克隆抗体制备实验过程
一、免疫动物
免疫动物是用目的抗原免疫小鼠,使小鼠产生致敏B淋巴细胞的过程。
一般选用6-8周龄雌性Balb/c小鼠,按照预先制定的免疫方案进行免疫注射。
抗原通过血液循环或淋巴循环进入外周免疫器官,刺激相应B淋巴细胞克隆,使其活化、增殖,并分化成为致敏B淋巴细胞。
说明:
FCA,弗氏完全佐剂;FIA,弗氏不完全佐剂;Quickantibody,北京康碧泉公司研制的佐剂。
上表中第四种免疫方法产生的抗体大部份都为IgM,存在亲和力弱等缺点,慎用。
PS:
1、一般皮下注射每个注射点注射30-50ul左右混有佐剂的抗原,每只小鼠注射6-8个点为宜。
2、腹腔注射时,如果抗原混有弗氏佐剂,建议注射在左侧腹腔,如果采用右侧腹腔注射,则在免疫过程中,很容易导致小鼠脾脏与腹膜粘连的情况,造成后期取出脾脏麻烦。
3、冲击免疫完成后,应在96小时内完成细胞融合,否则相应的B细胞数量会下降到未冲击前的水平。
二、细胞融合(Cellfusion)
【材料和试剂】
(1)骨髓瘤细胞悬液选好骨髓瘤细胞株,取体外培养对数生长期细胞或体内生长的肿瘤分离骨髓瘤细胞,制备细胞悬液。
(2)免疫小鼠脾细胞悬液取3天前加强免疫的小鼠,眼眶放血,分离血清冻存备用。
拉颈处死小鼠,浸泡于75%酒精中3~5min。
无菌操作取出脾脏,置入盛有5ml不完全培养液的平皿中洗涤,剪去周围的结缔组织,将脾脏移入另一盛有5ml不完全培养液的平皿中的钢网上,先用剪刀剪成3~5个小块,然后用注射器内芯研磨。
将脾脏细胞悬液移至50ml离心管中,加不完全培养液50ml,1000r/min离心5min,弃上清,再以同法洗涤离心一次。
然后将沉淀细胞重新悬浮于10ml不完全培养液中,计活细胞数,一般一只小鼠可得0.5~2×108个脾细胞。
(3)饲养细胞将小鼠致死、体表消毒和固定后,用消毒剪镊从后腹掀起腹部皮肤,暴露腹膜。
用酒精棉球擦拭腹膜消毒。
用注射器注射10ml不完全培养基至腹腔,注意避免穿入肠管。
右手固定注射器,使针头留置在腹腔内,左手持酒精棉球轻轻按摩腹部1分钟,随后吸出注入的培养液。
1000r/min离心5-10分钟,弃上清。
先用5mlHAT培养基将沉淀细胞悬浮,根据细胞计数结果,补加HAT培养基,使细胞浓度为2×105/ml,备用。
(4)主要试剂的配制
①细胞培养基杂交瘤技术中使用的细胞培养基主要有RPMI-1640或DMEM(DulbercoModifiedEaglesMedium)两种基础培养基,配好后过滤除菌(0.22um),分装,4℃保存。
不完全RPMI-1640培养基:
RPMI-1640培养基原液
96ml
100×L.G.溶液
1ml
双抗溶液
1ml
7.5%NaHCO3溶液
1-2ml
HEPES溶液
1ml
不完全DMEM培养基:
DMEM
13.37g
超纯水或四蒸水
980ml
NaHCO3
3.7g
双抗溶液
10ml
100×L.G.溶液
10ml
用1NHCl调试PH至7.2-7.4,过滤除菌,分装4℃保存。
完全RPMI-1640或DMEM培养基:
不完全RPMI-1640或DMEM培养基
80ml
小牛血清
15-20ml
HT或HAT培养基:
HT培养基
HAT培养基
完全RPMI-1640或DMEM培养基
99ml
98ml
HT贮存液
1ml
1ml
A贮存液
1ml
②氨基喋呤(A)贮存液(100×,4×10-5mol/L)
称取1.76mg氨基喋呤(AminopterinMW440.4),溶于90ml超纯水或四蒸水中,滴加1mol/LNaOH0.5ml中和,再补加超纯水或四蒸水至100ml。
过滤除菌,分装小瓶(2ml/瓶),-20℃保存。
③次黄嘌呤和胸腺嘧啶核苷(HT)贮存液(100×,H:
10-2mol/L,T:
1.6×10-3mol/L)
称取136.1mg次黄嘌呤(Hypoxanthine,MW136.1)和38.8mg胸腺嘧啶核苷(Thymidine,MW242.2),加超纯水或四蒸水至100ml,置45-50℃水浴中使完全溶解,过滤除菌,分装小瓶(2ml/瓶),-20℃冻存。
用前可置37℃加温助溶。
④L-谷氨酰胺(L.G.)溶液(100×,0.2mol/L)
称取2.92gL-谷氨酰胺(L-glutamine,MW146.15),用100ml不完全培养液或超纯水(或四蒸水)溶解,过滤除菌,分装小瓶(4-5ml/瓶),-20℃冻存。
⑤青、链霉素(双抗)溶液(100×)
取青霉素G(钠盐)100万单位和链霉素(硫酸盐)1g,溶于100ml灭菌超纯水或四蒸水中,分装小瓶(4-5ml/瓶),-20℃冻存。
⑥7.5%NaHCO3溶液
称取分析纯NaHCO37.5g,溶于100ml超纯水或四蒸水中,过滤除菌,分装小瓶(4-5ml/瓶),盖紧瓶塞,4℃保存。
⑦HEPES溶液(1mol/L)
称取23.83gHEPES(N-2-Hydroxyethylpiperazine-N,-2-ethanesulfonicacid,N-2-羟乙基哌嗪-N,-2-乙基磺酸,MW238.3)溶于100ml超纯水或四蒸水中,过滤除菌,分装小瓶(4-5ml/瓶),4℃保存。
⑧8-氮鸟嘌呤贮存液(100×)
称取200mg8-氮鸟嘌呤(8-azaguanine,MW152.1),加入4mol/LNaOH1ml,待其溶解后,加入超纯水或四蒸水99ml,过滤除菌;分装小瓶,-20℃冻存。
使用时按1%浓度加入到培养液中(即终浓度为20ug/ml)。
⑨50%PEG
称取PEG1000或400020-50g于三角瓶中,盖紧,60-80℃水浴融化,0.6ml分装于青霉素小瓶中,盖紧,8磅高压蒸汽15分钟,-20℃存放备用。
临用前加热融化,加等量不完全培养基,用少许7.5%NaHCO3调PH至8.0,或购买Sigma或Gibco公司现成产品。
(5)24孔及96孔培养板等细胞培养所用材料和试剂。
【操作步骤】
(1)将准备好的骨髓瘤细胞与小鼠脾细胞按1:
5~1:
10比例混合,加入20~50mlRPMI-1640液。
(2)1000r/min×6~10min离心弃上清,将上清尽量吸净。
(3)用手指轻轻击打离心管底部,使沉淀细胞分散,将离心管置37℃水浴中。
(4)吸取1ml37℃预温的50%PEG缓慢滴入离心管内,45秒左右加完,边加边轻轻搅拌,37℃静置1~5min。
(5)在5min内滴加不完全完全培养液(37℃预温)20ml,第一分钟内滴加1ml,第2分钟2ml,第3分钟5ml,第4和第5分钟各6ml,同时应边加边轻轻地转动离心管,应沿管壁滴加,不应直接滴加在沉淀细胞上,以防将刚融合的细胞冲开。
然后加1640液至50ml使PEG作用终止。
(6)800r/min×5~10min离心,弃上清。
(7)将沉淀细胞轻轻悬浮于所需容积的HAT培养液中,接种24孔板(每孔1.0-1.5ml)或96孔培养板(每孔0.10-0.15ml)。
(8)接种完毕后,将培养板放入37℃5%CO2温箱中培养。
PS:
1、冻存的骨髓瘤细胞在复苏后要2周时间才能处于适合于融合的状态,培养目标是使处于对数生长的时间尽可能长。
2、饲养层细胞应在使的前一天制备好,这样才能分泌足够的细胞因子。
三、选择性培养
原理:
在HAT培养基中,未融合的骨髓瘤细胞因缺乏次黄嘌呤-鸟嘌呤-磷酸核糖转移酶,不能利用补救途径合成DNA而死亡。
未融合的淋巴细胞虽具有次黄嘌呤-鸟嘌呤-磷酸核糖转移酶,但其本身不能在体外长期存活也逐渐死亡。
只有融合的杂交瘤细胞由于从脾细胞获得了次黄嘌呤鸟嘌呤磷酸核糖转移酶,并具有骨髓瘤细胞能无限增殖的特性,因此能在HAT培养基中存活和增殖。
(1)接种24孔板或96孔板5天后,用HAT培养基换出1/2培养基。
(2)7-10天后用HT培养基换出HAT培养基;(第14天后可用普通完全培养基)。
PS:
1、经常观察杂交瘤细胞生长情况,待其长至孔底面积1/10以上时吸出上清供抗体检测。
4、杂交瘤阳性克隆的筛选与克隆化
杂交瘤细胞在融合后2周左右即可筛选,选用抗体检测方法的原则是快速、敏感、特异、可靠、花费小和节省人力,通常根据所研究的抗原和实验室的条件而定,一般制备单抗的目的决定了筛选克隆所用的方法。
由于融合后,细胞上清份数多,但每份体积有限,因此ELISA是最适合用于初步筛选的方法。
经过ELISA筛选出的阳性克隆即可进行克隆化,因为如果不进行克隆化,当阳性孔有非抗体分泌型的杂交瘤时,非抗体分泌型的杂交瘤由于生长速度更快,将会占主导生长,最终很难分离出目标杂交瘤以至丢失。
另外杂交瘤细胞培养的初期是不稳定的,有的细胞丢失部分染色体,可能丧失产生抗体的能力。
通常在得到针对预定抗原的杂交瘤以后需连续进行2-3次克隆化,有时还需进行多次。
克隆化的方法很多,如有限稀释法、软琼脂法、单细胞显微操作法、单克隆细胞集团显微操作法和荧光激活细胞分类仪(FACS)分离法。
(1)包被将抗原以pH9.6的NaCO3-NaHCO3包被,每块酶标板以5-20ug抗原为宜(如果抗原为多肽或小分子物质,则需要加大包被量)。
每孔的包被体积为50-100ul。
37℃包被2h或4℃包被过夜。
(2)封闭倒掉抗原,拍干酶标板孔内液体,以0.5-1%BSA(用PBST溶解)或5%脱脂牛奶(PBST溶解)或1%明胶(PBST溶解)于37℃封闭2h或4℃封闭过夜,也可以使用10%小牛血清或其它无关物种血清封闭。
封闭完后可立即使用,也可以洗涤一次置于4℃密封保存以备后面使用。
(3)一抗封闭完后,弃去孔内液体,拍干,加入待检测细胞上清,每孔100ul为宜。
在每块板子上做好记号。
37℃孵育1h。
(4)二抗孵育完一抗后,弃去孔内液体,拍干,以PBST洗涤3次,每次5min。
根据二抗说明稀释好二抗,每孔加入100ul.37℃孵育1h。
(5)显色孵育完二抗后,弃去孔内液体,拍干,加入显色剂。
待颜色最深时用终止液终止反应。
用酶标仪读出各孔OD值,选择出阳性孔。
(1)有限稀释法
从有限稀释的原理以及影响因素可以知道,其克隆化结果应该是一个修正的泊松分布:
式中λ在有限稀释里的意义是稀释时设计的每孔细胞的平均数,k则代表可能出现的细胞个数。
材料:
a、96孔细胞培养板等;b、HT培养基;c、活力强的杂交瘤细胞;d、小鼠腹腔细胞。
方法:
a、制备饲养细胞(小鼠腹腔细胞)。
b、制备待克隆的杂交瘤细胞悬液,用含20%血清的HT培养基稀释至每毫升含2.5、15和50个细胞3中不同的稀释度。
c、按每毫升加入5×104-1×105细胞的比例,在上述杂交瘤细胞悬液中分别加入腹腔巨噬细胞。
d、每种杂交瘤细胞分装96孔板一块,每个稀释度32孔,每孔量为0.2ml,每孔的杂交瘤细胞数分别为0.5、3和10。
e、37℃、7.5%CO2湿润培养7-10天,出现肉眼可见的克隆即可检测抗体;在倒置显微镜下观察,标出只有单个克隆生长的孔,取上清作抗体检测。
f、取抗体检测阳性孔的细胞扩大培养,并冻存。
g、本法中(b)、(c)、(d)也可简化为将计数后的杂交瘤细胞准确地进行系列稀释,直至每毫升含10个细胞,按每孔接种0.1ml细胞悬液,即每孔含1个细胞。
(2)软琼脂法
材料:
a、HT培养基(双倍浓度)。
b、用0.15mol/LNaCl配制的2.0%琼脂糖:
称取2.0g细胞培养用琼脂糖,