高中化学必修1基础的知识点学案定稿.docx
《高中化学必修1基础的知识点学案定稿.docx》由会员分享,可在线阅读,更多相关《高中化学必修1基础的知识点学案定稿.docx(38页珍藏版)》请在冰豆网上搜索。
高中化学必修1基础的知识点学案定稿
专题一物质的量及相关计算
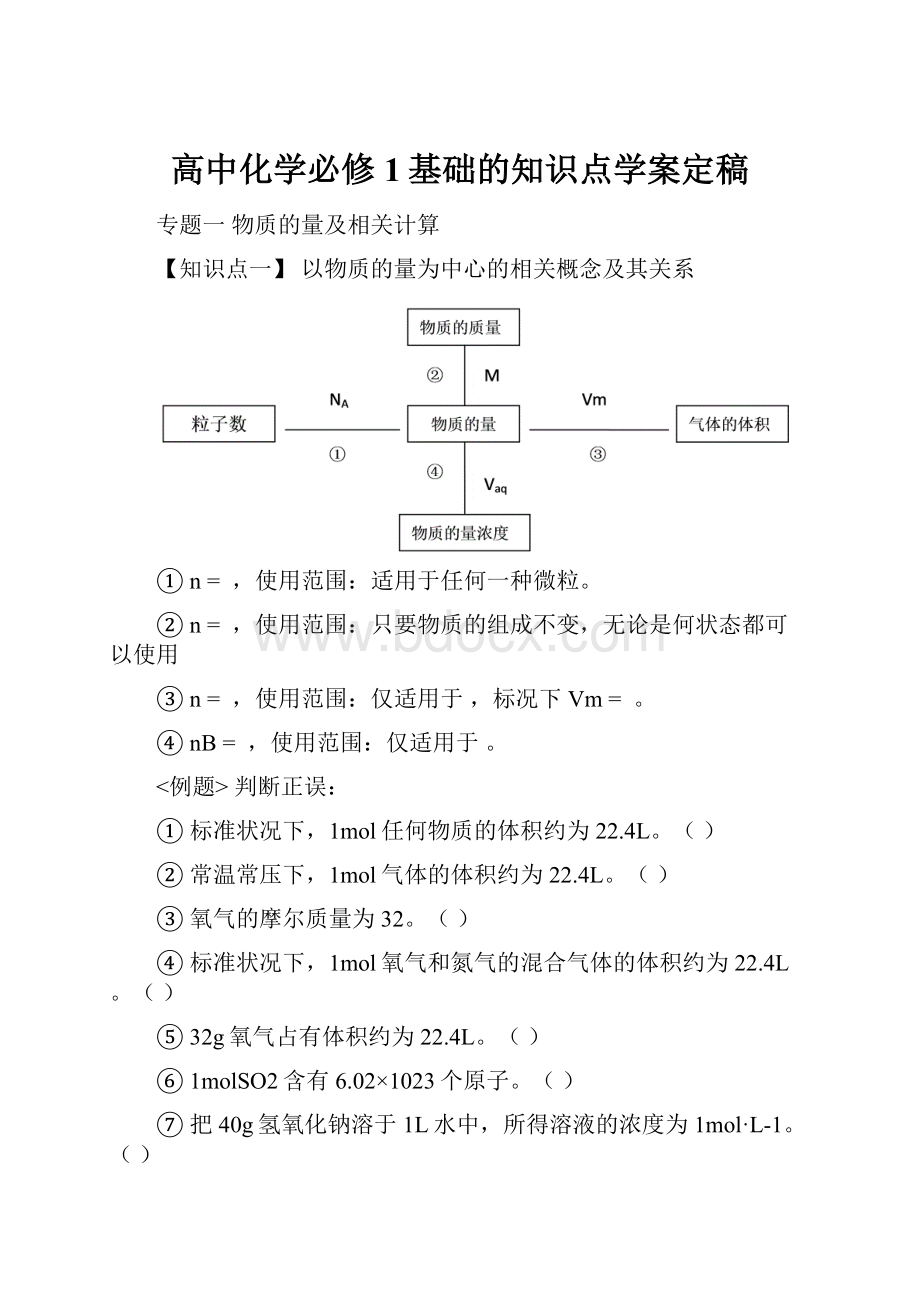
【知识点一】以物质的量为中心的相关概念及其关系
①n=,使用范围:
适用于任何一种微粒。
②n=,使用范围:
只要物质的组成不变,无论是何状态都可以使用
③n=,使用范围:
仅适用于,标况下Vm=。
④nB=,使用范围:
仅适用于。
<例题>判断正误:
①标准状况下,1mol任何物质的体积约为22.4L。
()
②常温常压下,1mol气体的体积约为22.4L。
()
③氧气的摩尔质量为32。
()
④标准状况下,1mol氧气和氮气的混合气体的体积约为22.4L。
()
⑤32g氧气占有体积约为22.4L。
()
⑥1molSO2含有6.02×1023个原子。
()
⑦把40g氢氧化钠溶于1L水中,所得溶液的浓度为1mol·L-1。
()
⑧2.4g镁与足量的盐酸反应时,失去的电子数为2NA。
()
⑨17g氨气所含电子数目为10NA。
()
⑩16gCH4中含有4NA个C—H键。
()
【知识点二】阿伏加德罗定律及其推论
阿伏加德罗定律:
相同温度和压强下,相同体积的任何气体都含有相同的________________。
同温同压下:
理想气体状态方程PV=nRT同温同体积下:
同温同压下:
<例题>判断正误:
①同温同压下两种气体的体积之比等于摩尔质量之比。
()
②同温同压下两种气体的物质的量之比等于密度之比。
()
③同温同压下两种气体的摩尔质量之比等于密度之比。
()
④同温同体积下两种气体的物质的量之比等于压强之比。
()
⑤在同温同压时,相同体积的任何气体单质所含的原子数目相同。
()
⑥同温同压下,相同体积的物质,它们的物质的量必相等。
()
⑦任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等。
()
【知识点三】有关溶液浓度的计算
1、溶液浓度的两种表示方法及其换算关系
(1)溶质质量分数:
ω=。
(2)物质的量浓度:
cB=。
(3)物质的量浓度与溶质质量分数的换算:
cB=。
(注意密度的单位换算)
<例题>计算:
①4gNaOH溶于水配成1L的溶液,该氢氧化钠溶液的物质的量浓度。
②商品硫酸的质量分数为98%,密度为1.84g/cm3,则它的物质的量浓度为__________。
③已知150mL2mol/LNaOH溶液的质量为160g。
则溶液中溶质的质量分数为__________。
2、溶液稀释的计算
稀释前后溶质质量的不变:
m(浓)·ω(浓)=。
稀释前后溶质的物质的量不变:
c(浓)·V(浓)=。
<例题>计算:
配制250mL1mol/LHCl溶液,需要12mol/LHCl溶液的体积是。
3、气体溶于水的有关计算
在标准状况下,一定体积气体溶于水后所得溶液物质的量浓度的计算,一定要注意不可用水的体积直接代替溶液的体积。
<例题>计算:
在标准状况下的224LNH3溶于1000mL水中,若所得氨水的密度近似为1g/cm3,求:
①此氨水的物质的量浓度是。
②此氨水的溶质的质量分数是。
专题二离子反应
【知识点一】电解质与电离
电解质:
。
1、化合物
非电解质:
。
注意:
电解质和非电解质首先应该是化合物,混合物和单质既不是电解质也不是非电解质。
2、强电解质与弱电解质的比较
强电解质
弱电解质
概念
电离程度
溶液里粒子
化合物类型
离子化合物、某些共价化合物
某些共价化合物
物质类别
强碱、强酸、大多数盐
弱碱、弱酸、水
常见的强酸有:
。
常见的强碱有:
。
常见的弱酸有:
。
常见的弱碱有:
。
3、电离
(1)概念:
电解质在中或下离解成的过程。
(2)条件:
(离子化合物)或(离子化合物或共价化合物)。
(3)表示方法——电离方程式
强电解质:
如HCl。
弱电解质:
如CH3COOH。
写出下列物质溶于水的电离方程式:
①H2SO4(电离时生成的____离子全部是______的化合物叫做酸)
②Ba(OH)2(电离时生成的____离子全部是______的化合物叫做碱)
③Fe2(SO4)3(电离时生成_______和_________的化合物叫做盐)
④NaHCO3
⑤NaHSO4
【知识点二】离子方程式的书写
1、写:
准确、完整地写出化学方程式。
2、拆:
将且的物质(强酸、强碱、可溶性盐)改写成离子形式,难溶物质、难电离物质、易挥发物质、单质、氧化物等均保留化学式。
3、删:
删去不参加反应的离子,并使化学计量数最简化。
4、查:
检查离子方程式是否守恒、守恒、守恒。
写出下列化学反应的离子方程式:
①氯气通入水中
②实验室制二氧化碳
③稀硫酸和氢氧化钡溶液混合
④将铝投入氢氧化钠溶液中
⑤Na2S04溶液中加入AgNO3溶液
⑥二氧化碳气体通入澄清石灰水
⑦石灰乳中加入Na2C03溶液
⑧盐酸与氨水反应
⑨氯化铵溶液与氢氧化钠溶液共热
⑩氯化铵溶液与稀氢氧化钠溶液混合
⑪用氢氧化钠溶液吸收少量二氧化碳
⑫氢氧化钠溶液中通入过量二氧化碳
⑬碳酸氢钠溶液中滴入少量澄清石灰水
⑭碳酸氢钠溶液中加入过量澄清石灰水
注意:
(1)对于微溶物的处理有三种情况:
①在生成物中有微溶物析出时,微溶物用化学式表示。
②当反应物里有微溶物处于溶液状态(稀溶液),应写成离子的形式。
③当反应物里有微溶物处于悬浊液或固态时,应写成化学式。
(2)有氨气参加或生成的反应
氨水作为反应物写成NH3·H2O;作为生成物,若有加热条件或浓度很大时,应写成NH3↑。
(3)与量有关的离子方程式的书写方法——少定多变法
“少定”即量少的反应物的离子的计量数按化学式确定;
“多变”即过量的反应物的计量数根据反应的需要量确定,不受化学式中的比例制约,是可变的。
专题三氧化还原反应
【知识点一】氧化还原反应的概念
1、氧化还原反应的本质是,判断依据是。
2、相关概念之间的联系
氧化剂→得→化合价→被→发生反应→具有性→变成产物
还原剂→失→化合价→被→发生反应→具有性→变成产物
3、电子转移的表示方法
(1)双线桥法:
如MnO2+4HCl(浓)=MnCl2+2H2O+Cl2↑
(2)单线桥法:
如MnO2+4HCl(浓)=MnCl2+2H2O+Cl2↑
4、常见的氧化剂和还原剂
(1)氧化剂
①非金属性较强的单质:
如F2、、、Br2、I2、O3等;
②高价态化合物:
如、浓H2SO4、HNO3、Fe3+等;
③H+及金属阳离子:
如、、等;
④其它化合物:
如HClO、MnO2、H2O2、Na2O2、NO2等。
(2)还原剂
①金属单质:
如、、等;
②某些非金属单质:
如、等;
③低价态化合物:
如H2S、KI、CO、SO2、SO32-、Fe2+等。
(3)元素的最高价只具有性,元素的最低价只具有性,元素的中间价既具有
性,又具有性。
5、物质的氧化性、还原性强弱判断
氧化性:
>;还原性:
>。
<例题1>在Cl2+SO2+2H2O=H2SO4+2HCl反应中,_是氧化剂,_是还原剂,
元素被氧化,元素被还原,_是氧化产物,_是还原产物,若有0.5molCl2参与此反应,则此时反应中有_的电子转移。
<例题2>已知在某温度时可发生如下三个反应:
C+CO2=2CO,C+H2O=CO+H2,CO+H2O=CO2+H2,由此可判断,在该温度下C.CO、H2的还原性由强到弱的顺序正确的是_。
【知识点二】氧化还原反应的配平及有关计算
1、依据:
电子得失总数相等→化合价升降总数相等
2、配平方法:
例:
Cu+HNO3(稀)--Cu(NO3)2+NO↑+H2O
①标价态:
标出发生氧化和还原反应的元素的正负化合价。
②标变化:
列出元素的化合价的变化。
③求总数:
使化合价升高和降低的总数相等(最小公倍数法)。
④用观察的方法配平其它物质的化学计量数。
<例题>配平下列氧化还原反应的方程式:
①KMnO4+HCl----KCl+Cl2+MnCl2+H2O
②I—+IO3—+H+----I2+H2O
③NaNO2+HI----NO+I2+NaI+
3、有关计算类型介绍:
<例题1>一定条件下硝酸铵受热分解的未配平化学方程式为:
NH4NO3——HNO3+N2+H2O,在反应中被氧化与被还原的氮原子数之比为。
<例题2>在一定条件下,PbO2与Cr3+反应,产物是Cr2O72—和Pb2+,则与1molCr3+反应所需PbO2的物质的量为。
<例题3>24mL浓度为0.05mol·L-1的Na2SO3溶液恰好与20mL浓度为0.02mol·L-1的K2Cr2O7溶液完全反应。
已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为。
<总结>
根据得失电子守恒解决有关氧化还原的计算的方法是:
①找出氧化剂、还原剂及其物质的量以及每摩尔氧化剂、还原剂得失电子的量。
②根据电子守恒列出等式:
氧化剂的物质的量×每摩尔氧化剂得电子数=还原剂的物质的量×每摩尔还原剂失电子数
③利用等式求解未知量。
专题五钠及其化合物
【知识点一】钠
1、单质钠的物理性质:
。
2、单质钠的化学性质:
(1)钠与O2反应
常温下:
(新切开的钠放在空气中容易变)
加热时:
(生成色固体)
(2)钠与水反应
Na+H2O=离子方程式:
。
实验现象:
浮——说明;游——说明;响——说明;熔——说明;(红——说明。
(3)钠与盐溶液反应
如钠与CuSO4溶液反应,应该先是钠与反应生成NaOH与H2,再和溶液反应,有关化学方程式:
;。
总的方程式:
。
实验现象:
有蓝色沉淀生成,有气泡放出
3、钠的存在:
以态存在。
4、钠的冶炼:
法,化学方程式为。
5、钠的保存:
保存在中,钠着火用灭火,久置的钠在空气中最终变为。
【知识点二】钠的重要化合物
1、钠的两种氧化物
名称
氧化钠
过氧化钠
化学式
氧元素的化合价
电子式
颜色状态
与水反应
与CO2反应
用途
2、碳酸钠和碳酸氢钠
Na2CO3
NaHCO3
俗称
水溶性比较
溶液酸碱性
与酸反应剧烈程度
较(二步反应)
较(一步反应)
与酸反应
热稳定性
与CO2反应
与NaOH溶液反应
与Ca(OH)2溶液反应
与CaCl2溶液反应
有CaCO3沉淀
不反应
用途
洗涤剂,玻璃、肥皂、造纸、纺织等工业
发酵粉、灭火剂、治疗胃酸过多(有胃溃疡时不能用)
相互转化
【知识点三】碱金属元素简介
1、碱金属元素概述
元素名称及符号
锂钠钾铷铯
周期表中的位置
位于元素周期表的第族
原子结构
相同点:
最外层电子数都是。
不同点:
电子层数不同。
相似性
(1)最高正价为价;
(2)氧化物对应水化物为(强或弱)碱,典型的活泼金属元素。
递变性(从上到下)
(1)原子半径由到;
(2)元素的金属性逐渐;
(3)对应碱的碱性逐渐;(4)单质的熔沸点逐渐。
2、碱金属元素的化学性质
写出下列化学方程式:
①锂在空气中燃烧②钠在空气中燃烧
③钾与水的反应④铷与水的反应
巩固练习
1.写出实现下列变化的化学方程式(注:
是离子反应的只写离子方程式)
Na2O
NaClNaNaOHNa2CO3NaHCO3
Na2O2
①②
③④
⑤⑥
⑦⑧
⑨⑩
专题六铝及其化合物
【知识点一】铝
1、单质铝的物理性质:
色金属、密度小(属轻金属)、硬度小、熔沸点低。
2、单质铝的化学性质
(1)铝与非金属的反应:
①常温下铝能与O2反应生成,保护内层金属。
②铝在氯气中燃烧____________________________________________________
③铝粉和硫粉混合加热_____________________________________________________
(2)铝热反应
①铝粉和三氧化二铁粉末混合加热________________________________________;
②铝粉和四氧化三铁粉末混合加热________________________________________;
③铝粉和二氧化锰粉末混合加热____________________________________________________。
(3)常温下Al既能与强酸反应,又能与强碱溶液反应,均有生成。
与稀盐酸反应的离子方程式
与氢氧化钠溶液反应的离子方程式
注意:
①铝制餐具不能用来长时间存放酸性、碱性和咸的食品。
②铝遇冷的浓硫酸或浓硝酸发生。
(4)与盐溶液的反应
①铝投入硫酸铜溶液中的离子方程式_____________________________________________
②铝投入硝酸汞溶液中的离子方程式_________________________________________________
3、铝的冶炼:
法,化学方程式为。
【知识点二】铝的重要化合物
1、Al2O3和Al(OH)3
化学式
Al2O3
Al(OH)3
所属类别
色、态、溶解性
色固体,溶于水
色胶状固体,溶于水
热稳定性
熔点,不易分解。
受热分解:
与强酸反应
与强碱反应
主要用途
材料
医用中和剂
2、硫酸铝钾
(1)硫酸铝钾在水中的电离方程式:
KAl(SO4)2===
(2)十二水合硫酸铝钾俗名,可用作。
【知识点三】含铝化合物间的相互转化(“铝三角”关系)
1、铝三角相互转化关系
Al3+Al(OH)3AlO2-
写出相应的离子方程式:
①Al3++强碱或弱碱→Al(OH)3:
Al3++===Al(OH)3↓;Al3++NH3·H2O===。
②Al(OH)3+强碱AlO2-:
。
③Al3++过量强碱AlO2-:
。
④AlO2-+强酸或弱酸Al(OH)3:
AlO2-++===Al(OH)3↓;AlO2-+CO2+H2O===。
⑤Al(OH)3+强酸Al3+:
。
⑥AlO2-+过量强酸Al3+:
。
2、实验室制取Al(OH)3的方法(用化学方程式表示):
①以氯化铝溶液为原料:
________________________________。
用氨水而不用氢氧化钠溶液的主要原因是__________________________________________。
②以偏铝酸钠溶液为原料:
________________________________。
用二氧化碳而不用稀盐酸的主要原因是_________________________________________。
11.下列物质(均为中学化学常见物质)转化关系图中,D为红棕色粉末,K为白色胶状沉淀(反应条件及部分反应物、产物未全部说明)
根据图示转化关系填写下列空白:
(1)写出下列物质的化学式A,B,G。
(2)写出下列化学方程式或离子方程式
I+过量氨水→K(离子方程式)。
G+B→H(化学方程式)。
C+D→A+E(化学方程式)。
专题七铁及其化合物
【知识点一】铁
1、铁在元素周期表中的位置:
周期族。
2、单质铁的物理性质:
。
3、单质铁的化学性质
(1)铁与非金属的反应:
①在氧气中燃烧:
(现象:
)
②在氯气中燃烧:
________________________________(现象:
)
③与硫粉混合加热_____________________________________________________
(2)铁与水蒸气反应:
(3)与非氧化性酸反应:
Fe+2HCl=
(4)与某些盐溶液反应:
Fe+CuSO4=
(5)与强氧化性酸的反应:
常温下铝、铁遇浓硫酸或浓硝酸。
加热能反应但无氢气放出。
写出铁与稀硝酸反应的化学方程式:
①少量铁粉溶于稀硝酸
②过量铁粉溶于稀硝酸
【知识点二】铁的重要化合物
1、铁的氧化物
名称
化学式
颜色状态
与稀盐酸反应的化学方程式
氧化亚铁
氧化铁(铁红)
四氧化三铁(磁性氧化铁)
2、铁的氢氧化物
化学式
Fe(OH)2
Fe(OH)3
颜色状态
化学性质
Fe(OH)2+H+—
Fe(OH)3+H+—
Fe(OH)2+O2+H2O—
Fe(OH)3—
制备原理
注意:
Fe(OH)2在空气中极易被,实验制得的Fe(OH)2色沉淀在空气中会迅速变为色,最后变为色。
所以实验室制取Fe(OH)2时,要用新制的Fe2+,并尽量避免与接触。
(思考一下可以采取哪些措施避免Fe(OH)2被氧化)
3、Fe2+和Fe3+的性质
离子
Fe2+
Fe3+
溶液中的颜色
主要化学性质
Fe2++Cl2—
Fe3++Fe—
常用检验方法
保存方法
加铁粉防止
加相应的酸防止水解
【知识点三】含铁化合物间的相互转化(“铁三角”关系)
FeFe2+Fe3+
写出相应的离子方程式:
1Fe→Fe2+:
与弱氧化剂反应,如S、I2、H+、Cu2+、Fe3+等,
;;
;。
2Fe2+Fe3+:
与强氧化剂反应,如O2、Cl2、H2O2、HNO3、KMnO4等。
;。
3FeFe3+:
与强氧化剂反应,如Cl2、Br2、HNO3、浓H2SO4等。
;。
4Fe3+Fe2+:
与较强的还原剂反应,如I-、H2S、S2-、Fe、Cu、SO2等。
;。
⑤Fe2+Fe:
与强的还原剂反应,如Zn、H2等。
;。
5Fe3+Fe:
与强的还原剂反应,如Al、C、CO、H2等。
;。
巩固练习
1.写出实现下列变化的化学方程式(注:
是离子反应的只写离子方程式)
FeOFeCl2Fe(OH)2
Fe3O4Fe
Fe2O3FeCl3Fe(OH)3
①②
③④
⑤⑥
⑦⑧
⑨⑩
10.A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。
且已知G为主族元素的固态氧化物,F是红褐色难溶于水的沉淀,A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素是 。
(2)写出物质的化学式:
B ;C ;G ;
(3)写出①、⑥反应的化学方程式:
反应①:
反应⑥:
专题八氯及其化合物
【知识点一】氯气
1、氯气的物理性质:
色,气味,毒,密度比空气,溶于水,易。
2、氯气的化学性质:
与钠反应:
(现象:
)
(1)与大多数金属反应与铁反应:
(现象:
)
与铜反应:
(现象:
)
(2)与氢气反应:
(现象:
)
(3)与水反应:
(4)与碱反应:
制漂白液
制漂白粉和漂粉精
(5)其他反应(写出下列离子方程式):
①Br-+Cl2—②I-+Cl2—③Fe2++Cl2—
④S2-+Cl2—⑤H2S+Cl2—
⑥SO2+Cl2+H2O—⑦SO32-+Cl2+H2O—
3、氯气的实验室制法
(1)反应原理:
。
(2)装置特点:
_______________。
(3)净化:
用_________除去Cl2中少量HCl,用_________干燥气体。
(4)收集和检验:
用________法或_________法收集,用_________检验。
(5)尾气吸收:
。
(写化学方程式)
4、与氯相关的重要物质
(1)次氯酸:
弱酸,具有强氧化性,可用于消毒漂白,见光易分解。
(2)新制氯水:
呈色,含等多种成分,性质具有多重性。
(3)漂白粉:
有效成分是,在空气中久置失效的原因是(用化学方程式表示):
。
【知识点二】卤族元素简介
1、卤族元素概述
元素名称及符号
氟氯溴碘
周期表中的位置
位于元素周期表的第族
原子结构
最外层电子数都是
相似性
最高正价为价;最高价氧化物对应水化物的通式为。
递变性(从上到下)
原子半径由到;元素的非金属性逐渐;
单质与氢气越来越,氢化物的稳定性逐渐;最高价氧化物对应水化物酸性逐渐;单质的熔沸点逐渐。
2、卤素单质的色态:
F2Cl2Br2I2
3、卤素单质的化学性质
(1)与H2反应的条件及氢化物的稳定性:
F2与H2Cl2与H2
Br2与H2I2与H2
(2)卤素单质间的置换反应(与单质的氧化性强弱有关):
Cl2+2Br-—;Cl2+2I-—;Br2+2I-—。
(3)与水的反应:
氟气与水的反应:
其他卤素单质与水的反应:
X2+H2O—。
(X=ClBrI)
4、卤素离子的性质及检验
(1)卤素离子的还原性强弱顺序I->Fe2+>Br->Cl->F-写出下列离子方程式:
①向FeBr2溶液中通入少量Cl2
②向FeBr2溶液中通入过量Cl2
③向FeI2溶液中通入少量Cl2
④向FeI2溶液中通入过量Cl2
(2)卤素离子的检验
Cl-+Ag+—(色沉淀)
①硝酸银-硝酸法:
产生不溶于稀硝酸的沉淀Br-+Ag+—(色沉淀)
I-+Ag+—(色沉淀)
②氯水-CCl4法:
CCl4层出现不同颜色
巩固练习
1.写出实现下列变化的化学方程式(注:
是离子反应的只写离子方程式)
FeCl2FeC