高中化学竞赛晶体结构10年真题加完整答案.docx
《高中化学竞赛晶体结构10年真题加完整答案.docx》由会员分享,可在线阅读,更多相关《高中化学竞赛晶体结构10年真题加完整答案.docx(25页珍藏版)》请在冰豆网上搜索。
高中化学竞赛晶体结构10年真题加完整答案
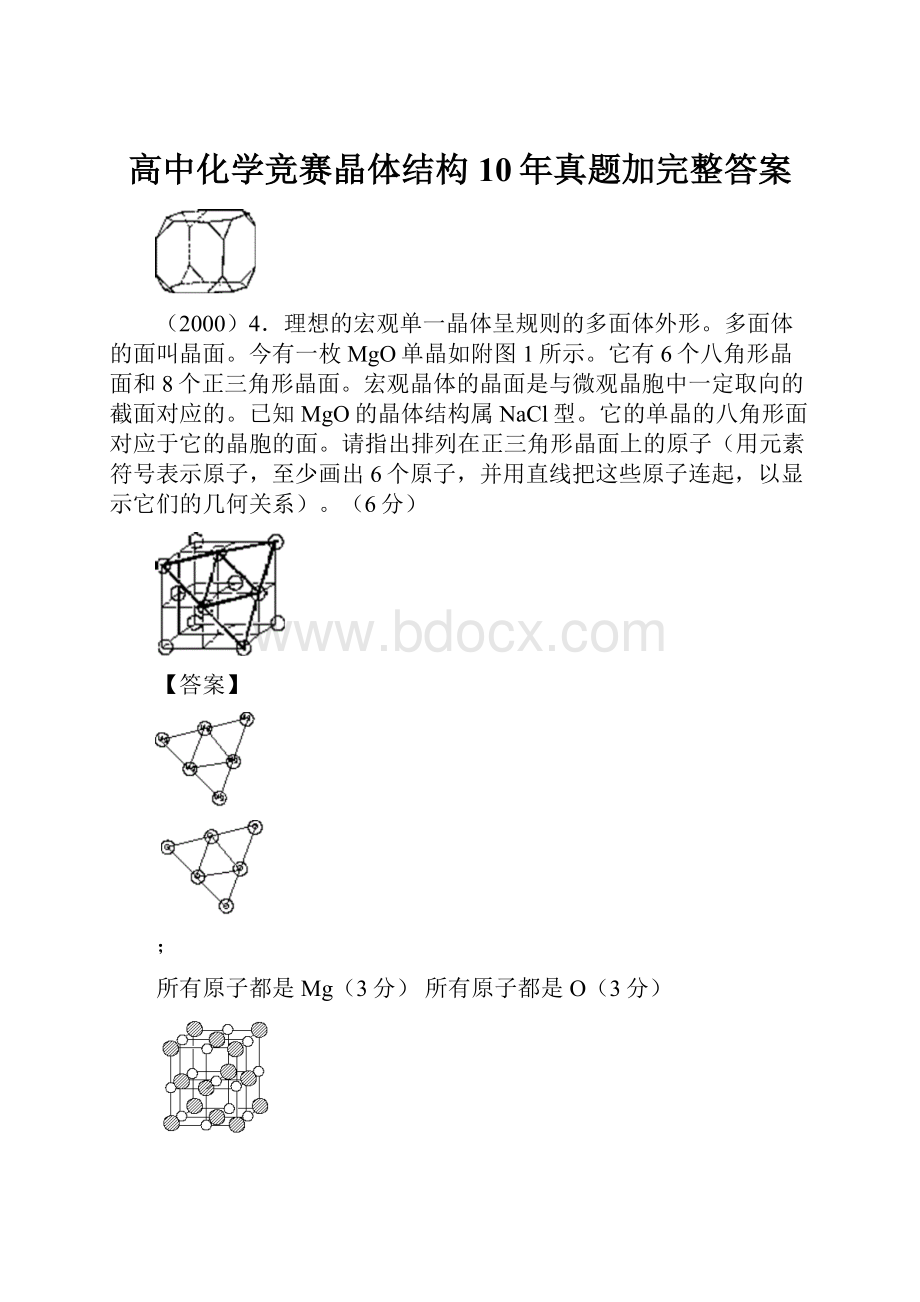
(2000)4.理想的宏观单一晶体呈规则的多面体外形。
多面体的面叫晶面。
今有一枚MgO单晶如附图1所示。
它有6个八角形晶面和8个正三角形晶面。
宏观晶体的晶面是与微观晶胞中一定取向的截面对应的。
已知MgO的晶体结构属NaCl型。
它的单晶的八角形面对应于它的晶胞的面。
请指出排列在正三角形晶面上的原子(用元素符号表示原子,至少画出6个原子,并用直线把这些原子连起,以显示它们的几何关系)。
(6分)
【答案】
;
所有原子都是Mg(3分)所有原子都是O(3分)
注:
画更多原子者仍应有正确几何关系;右图给出了三角形与晶胞的关系,不是答案。
(2000)5.最近发现一种由钛原子和碳原子构成的气态团簇分子,如右图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是______。
【答案】Ti14C13(2分)说明:
凡按晶胞计算原子者得零分。
(2001)第5题(5分)今年3月发现硼化镁在39K呈超导性,可能是人类对超导认识的新里程碑。
在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,像维夫饼干,一层镁一层硼地相间,图5-1是该晶体微观空间中取出的部分原子沿C轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。
5-1由图5-1可确定硼化镁的化学式为:
。
5-2在图5-l右边的方框里画出硼化镁的一个晶胞的透视图,标出该晶胞内面、棱、顶角上可能存在的所有硼原子和镁原子(镁原子用大白球,硼原子用小黑球表示)。
图5-1硼化镁的晶体结构示意图
第5题(5分)5-1MgB2(2分)(注:
给出最简式才得分)
或
a=b≠c,c轴向上(3分)
5-2(注:
任何能准确表达出Mg︰B=1︰2的晶胞都得满分,但所取晶胞应满足晶胞是晶体微观空间基本平移单位的定义,例如晶胞的顶角应完全相同等。
)
(2001)第10题(5分)最近有人用一种称为“超酸”的化合物H(CB11H6Cl6)和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]-。
回答如下问题:
10-1以上反应看起来很陌生,但反应类型上却可以跟中学化学课本中的一个化学反应相比拟,后者是:
。
10-2上述阴离子[CB11H6Cl6]-的结构可以跟图10-1的硼二十面体相比拟,也是一个闭合的纳米笼,而且,[CB11H6Cl6]-离子有如下结构特征:
它有一根轴穿过笼心,依据这根轴旋转360°/5的度数,不能察觉是否旋转过。
请在图10-1右边的图上添加原子(用元素符号表示)和短线(表示化学键)画出上述阴离子。
图10-1
第10题(5分)NH3+HCl=NH4Cl(2分)(注:
答其他非质子转移的任何“化合反应”得1分)。
(3分)
(注:
硼上氢氯互换如参考图形仍按正确论,但上下的C、B分别连接H和Cl,不允许互换。
)
(2001)第11题(10分)研究离子晶体,常考察以一个离子为中心时,其周围不同距离的离子对它的吸引或排斥的静电作用力。
设氯化钠晶体中钠离子跟离它最近的氯离子之间的距离为d,以钠离子为中心,则:
11-1第二层离子有 个,离中心离子的距离为 d,它们是 离子。
11-2已知在晶体中Na+离子的半径为116pm,Cl-离子的半径为167pm,它们在晶体中是紧密接触的。
求离子占据整个晶体空间的百分数。
11-3纳米材料的表面原子占总原子数的比例极大,这是它的许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰等于氯化钠晶胞的大小和形状,求这种纳米颗粒的表面原子占总原子数的百分比。
11-4假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞边长的10倍,试估算表面原子占总原子数的百分比。
第11题(10分)12,
,钠(各1分,总3分)
11-2晶胞体积V=[2×(116pm+167pm)]3=181×106pm3
离子体积v=4x(4/3)π(116pm)3+4x(4/3)π(167pm)3=104×106pm3
v/V=57.5%(1分)(有效数字错误扣1分,V和v的计算结果可取4位,其中最后1位为保留数字,不扣分。
)
11-3表面原子为8(顶角)+6(面心)+12(棱中心)=26
总原子数为8(顶角)+6(面心)+12(棱中心)+1(体心)=27
表面原子占总原子数26/27×100%=96%(1分)
注:
26和27均为整数值,比值26/27是循环小数0.962,取多少位小数需根据实际应用而定,本题未明确应用场合,无论应试者给出多少位数字都应按正确结果论。
11-4计算分两个步骤:
步骤一:
计算表面原子数。
可用n=2、3的晶胞聚合体建立模型,得出计算公式,用以计算n=10。
例如,计算公式为:
[8]+[(n-1)×12]+[n×12]+[(n-1)2×6]+[n2x6]+[(n-1)×n×2×6]
顶角棱上棱交点棱上棱心面上棱交点面上面心 面上棱心
n=10,表面原子总数为2402 (2分)
步骤二:
计算晶胞聚合体总原子数:
n3×8+[8]×7/8+[(n-1)×12]×3/4+[n×12]×3/4+[(n-1)2×6]/2+[n2×6]/2+[(n-1)×n×2×6]/2
=8000+7+81+90+243+300+540=9261 (2分)
表面原子占总原子数的百分数:
(2402/9261)×100%=26%(1分)(总5分)
(注:
本题计算较复杂,若应试者用其他方法估算得出的数值在26%左右2个百分点以内可得3分,3个百分点以内可得2分,其估算公式可不同于标准答案,但其运算应无误。
本题要求作估算,故标准答案仅取整数,取更多位数不扣分。
)
(2003) 第6题(12分)2003年3月日本筑波材料科学国家实验室一个研究小组发现首例带结晶水的晶体在5K下呈现超导性。
据报道,该晶体的化学式为Na0.35CoO2•1.3H2O,具有……-CoO2-H2O-Na-H2O-CoO2-H2O-Na-H2O-……层状结构;在以“CoO2”为最简式表示的二维结构中,钴原子和氧原子呈周期性排列,钴原子被4个氧原子包围,Co-O键等长。
6-1 钴原子的平均氧化态为 +3.65 。
(1分;不写“+”给0.5分)
6-2 以 代表氧原子,以 代表钴原子,画出CoO2层的结构,用粗线画出两种二维晶胞。
可资参考的范例是:
石墨的二维晶胞是下图中用粗线围拢的平行四边形。
、
或
或
(画出1种晶胞给6分,画出2种晶胞给9分)
画成不符合化学式者如:
,
不是同一形状平行四边形的最小体积者以及不符合平移特征的图形均不得分。
6-3 据报道,该晶体是以Na0.7CoO2为起始物,先跟溴反应,然后用水洗涤而得到的。
写出起始物和溴的反应方程式。
Na0.7CoO2+0.35/2Br2=Na0.35CoO2+0.35NaBr (2分;未配平不给分。
)
(2003)第9题(6分) 钒是我国丰产元素,储量占全球11%,居第四位。
在光纤通讯系统中,光纤将信息导入离光源1km外的用户就需用5片钒酸钇晶体(钇是第39号元素)。
我国福州是全球钒酸钇晶体主要供应地,每年出口几十万片钒酸钇晶体,年创汇近千万美元(1999年)。
钒酸钇是四方晶体,晶胞参数a=712pm,c=629pm,密度d=4.22g/cm3,含钒25%,求钒酸钇的化学式以及在一个晶胞中有几个原子。
给出计算过程。
钒酸钇的化学式:
YVO4 (1分)
计算过程:
YVO4的摩尔质量为203.8g/mol;钒的质量分数为50.9/203.8=025合题意。
203.8/4.22=48.3cm3/mol四方晶胞的体积V=7122X629X10-30cm3=3.18X10-22cm3(1分)
48.3/6.02X1023=8.02X10-23cm3 (1分)
3.18X10-22/8.02X10-23=3.97≈4 (1分)
一个晶胞中的原子数:
4X6=24(2分) (类似过程或步骤合并,得分相同)
(2004)(4分)2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N-N键的键能为160kJ/mol(N2的键能为942kJ/mol),晶体结构如图所示。
在这种晶体中,每个氮原子的配位数为;按键型分类时,属于晶体。
这种固体的可能潜在应用是,这是因为:
。
3原子炸药(或高能材料)高聚氮分解成N2释放大量能量(各1分)
(2005)第2题(12分)为纪念1905年爱因斯坦连续发表6篇论文导致物理学大变革100周年,今年被定为国际物理年。
本题涉及的“热电效应”机理也是爱因斯坦首先阐释的,即他提出的被后人称为“爱因斯坦振荡器”的独立振荡原子与温度关系的模型。
2-1左上图是热电效应之一的图解。
给出图中所有英文单词(或词组)及物理学符号的意义,并为此图写一篇不超过200字(包括标点符号等)的说明文。
input——输入hot——热(端)cold——冷(端)heatflow——热流
I——电流强度n——n型半导体p——p型半导体i+——正电流(各0.25分)
向热电材料构成的半导体的n-p结的远端输入外电流,半导体发生空穴导电,电流流经n-p结时发生复合,外电流输入的能量转化为热流,使n-p结的温度越来越低,而其远端的温度越来越高,即有类似冰箱制冷的效应。
(4分)
2-2右上图是化学家合成的能实现热电效应的一种晶体的晶胞模型。
图中的大原子是稀土原子,如镧;小原子是周期系第五主族元素,如锑;中等大小的原子是周期系VIII族元素,如铁。
按如上结构图写出这种热电晶体的化学式。
给出计算过程。
提示:
晶胞的6个面的原子数相同。
设晶体中锑的氧化态为-1,镧的氧化态为+3,问:
铁的平均氧化态多大?
化学式LaFe4Sb12(2分)(写La2Fe8Sb24扣1分)铁的氧化态9/4=2.25(1分)
计算化学式的过程如下:
晶胞里有2个La原子(处于晶胞的顶角和体心);有8个Fe原子(处于锑形成的八面体的中心);锑八面体是共顶角相连的,平均每个八面体有6/2=3个锑原子,晶胞中共有8个八面体,8x3=24个锑原子;即:
La2Fe8Sb24。
其他合理过程也可。
(3分)
(2005)第8题(12分)LiCl和KCl同属NaCl型晶体,其熔点分别为614℃和776℃。
Li+、K+和Cl-的半径分别为76pm、133pm和181pm。
在电解熔盐LiCl以制取金属锂的生产工艺中,加入适量的KCl晶体,可使电解槽温度下降至400℃,从而使生产条件得以改善。
8-1简要说明加入熔点高的KCl反而使电解温度大大下降的原因;
熔点降低效应;或形成有低共熔点的二元体系;或固相不互溶,而在液相中产生混合熵。
(2分:
三者中答出任一者可得2分)
8-2有人认为,LiCl和KCl可形成固溶体(并画出了“固溶体的晶胞”)。
但实验表明,液相LiCl和KCl能以任意比例混溶而它们的固相完全不混溶(即不能生成固溶体!
)。
请解释在固相中完全不混溶的主要原因。
在固相中,离子呈周期性排列,对“相似相溶”的“相似条件”的要求比液相中严格得多。
LiCl和KCl的结构型式相同,Li+和K+的电价相等,Li和K的电负性差别也有限。
显然,两个组分在固相中完全不互溶源于Li+和K+的半径差别太大。
(2分,关键要回答出最后一句话)
8-3写出计算LiCl和KCl两种晶体密度之比的表达式(须包含离子半径的符号);
(2分)只写出最后的表达式也可
8-4在KCl晶体中,K+离子占据由Cl-离子围成的八面体空隙,计算相距最近的八面体空隙中心之间的距离。
=
=
(133+181)×2pm=444pm(2分;方法正确但结果算错扣0.5分)
8-5实验证明,即使产生了阳离子空位,KCl晶体在室温下也不导电。
请通过计算加以说明。
可按如下思路说明:
离子晶体能够导电是由于离子离开原位而迁移到距离最近的空位所致。
迁移中必须经过由异号离子围成的最小窗孔。
比较离子半径和窗孔的大小,可判断能否发生迁移,即能否成为快离子导体。
取体积为KCl正当晶胞体积1/8的小立方体(见图)来考虑。
三个分布在正当晶胞0,0,0;1/2,0,1/2;0,1/2,1/2位置的Cl-围成的三角形半径为:
该半径远小于K+的半径,K+不能穿过此窗口,因而KCl晶体不能成为固体离子导体。
大白球为Cl-,黑球为K+,虚线球为空位
(4分;思路和方法正确但计算结果错误可得2分)。
(2006)第8题(9分)超硬材料氮化铂是近年来的一个研究热点。
它是在高温、超高压条件下合成的(50GPa、2000K)。
由于相对于铂,氮原子的电子太少,衍射强度太弱,单靠X-射线衍射实验难以确定氮化铂晶体中氮原子数和原子坐标,2004年以来,先后提出过氮化铂的晶体结构有闪锌矿型、岩盐型(NaCl)和萤石型,2006年4月11日又有人认为氮化铂的晶胞如下图所示(图中的白球表示氮原子,为便于观察,该图省略了一些氮原子)。
结构分析证实,氮是四配位的,而铂是六配位的;Pt—N键长均为209.6pm,N—N键长均为142.0pm(对比:
N2分子的键长为110.0pm)。
备用图
8-1氮化铂的上述四种立方晶体在结构上有什么共同点?
铂原子面心立方最密堆积。
(2分)
8-2分别给出上述四种氮化铂结构的化学式。
依次为PtN、PtN、PtN2、PtN2(2分)
8-3试在图上挑选一个氮原子,不添加原子,用粗线画出所选氮原子的配位多面体。
(3分)
8-4请在本题的附图上添加六个氮原子(添加的氮请尽可能靠前)。
(2分)
(2006)第11题(11分)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。
磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成。
11-1.写出合成磷化硼的化学反应方程式。
BBr3+PBr3+3H2=BP+6HBr(1分)
11-2.分别画出三溴化硼分子和三溴化磷分子的结构。
(画不画磷上的孤对电子不影响得分)
平面三角形三角锥(2分)
11-3磷化硼晶体中磷原子作立方最密堆积,硼原子填入四面体空隙中。
画出磷化硼的正当晶胞示意图。
(注:
填入另外四个四面体空隙也可,但不能一层空一层填)(2分)
11-4已知磷化硼的晶胞参数a=478pm,计算晶体中硼原子和磷原子的核间距(dB-P)。
dB-P=
或dB-P=
(2分)
11-5画出磷化硼正当晶胞沿着体对角线方向的投影(用实线圆圈表示P原子的投影,用虚线圆圈表示B原子的投影)。
(4分)
(2007)第3题(8分)
X-射线衍射实验表明,某无水MgCl2晶体属三方晶系,呈层形结构,氯离子采取立方最密堆积(ccp),镁离子填满同层的八面体空隙;晶体沿垂直于氯离子密置层的投影图如下。
该晶体的六方晶胞的参数:
a=363.63pm,c=1766.63pm;p=2.53g·cm-3。
3-1以“
”表示空层,A、B、C表示Cl-离子层,a、b、c表示Mg2+离子层,给出三方层型结构的堆积方式。
3-2计算一个六方晶胞中“MgCl2”的单元数。
3-3假定将该晶体中所有八面体空隙皆填满Mg2+离子,将是哪种晶体结构类型?
(2008)第5题(5分)1963年在格陵兰Ika峡湾发现一种水合碳酸钙矿物ikaite。
它形成于冷的海水中,温度达到8oC即分解为方解石和水。
1994年的文献指出:
该矿物晶体中的Ca2+离子被氧原子包围,其中2个氧原子来自同一个碳酸根离子,其余6个氧原子来自6个水分子。
它的单斜晶胞的参数为:
a=887pm,b=823pm,c=1102pm,β=110.2°,密度d=1.83gcm3,Z=4。
5-1通过计算得出这种晶体的化学式。
ikaite晶胞体积:
V=abcsinβ=(8.878.2311.0210-24cm3)sin110.2°=7.5510-22cm3(0.5分)
设晶胞中含有n个水分子,晶胞的质量:
m=4(100+18n)/NA(g)(0.5分)
晶体密度:
d=m/V=4(100+18n)/(6.0210237.5510-22)(gcm3)=1.83gcm-3
100+18n=208n=6(0.5分)
该晶体的化学式为CaCO36H2O(0.5分)
算出6个水分子,未写化学式,得1.5分。
5-2研究了这种晶体在加压下受热膨胀体积增大的情形,并与冰及钙离子配位数也是8的二水合石膏晶体(gypsum)作了对比,结果如下图所示(纵坐标为相对体积):
为什么选取冰和二水合石膏作对比?
实验结果说明什么?
Ikaite在冷水中形成,而且含有大量结晶水,分解温度又接近冰的熔点,可能与冰的结构有相似性,故选取冰作参比物;(0.5分)
石膏是带结晶水的钙的含氧酸盐,而且钙的配位数也是8,可能与ikaite结构相似,故选取石膏作参比物。
(0.5分)
实验结果说明ikaite的结构跟冰相似。
(1分)
实验结果,说明含水的摩尔分数越大膨胀越大,可以得0.5分。
5-3这种晶体属于哪种类型的晶体?
简述理由。
分子晶体。
(0.5分)
答混合型晶体不得分。
晶体分解温度接近冰的熔点,体积随温度的变化趋势也接近冰,可认为晶体中的化学微粒是CaCO36H2O,它们以分子间作用力(氢键和范德华力)构成晶体。
(0.5分)
(2008)第8题(9分)由烷基镁热分解制得镁的氢化物。
实验测定,该氢化物中氢的质量分数为7.6%,氢的密度为0.101gcm3,镁和氢的核间距为194.8pm。
已知氢原子的共价半径为37pm,Mg2+的离子半径为72pm。
8-1写出该氢化物中氢的存在形式,并简述理由。
H(1分)
镁-氢间距离为194.8pm,Mg2+离子半径为72pm,则氢的半径为194.8pm-72pm=123pm。
此值远大于氢原子的共价半径,这说明H原子以H离子的形式存在。
(1分)
8-2将上述氢化物与金属镍在一定条件下用球磨机研磨,可制得化学式为Mg2NiH4的化合物。
X-射线衍射分析表明,该化合物的立方晶胞的面心和顶点均被镍原子占据,所有镁原子的配位数都相等。
推断镁原子在Mg2NiH4晶胞中的位置(写出推理过程)。
Mg原子与Ni原子数之比为2:
1,故每个晶胞中含8个镁原子。
所有镁原子的配位数相等,它们只能填入由镍原子形成的四面体空隙。
(3分)
镁原子的位置用下列坐标参数表示也得3分:
14,14,14;14,14,34;34,34,14;34,34,34;
14,34,14;14,34,34;34,14,14;34,14,34。
坐标错一组,扣0.5分,不得负分。
其他答案不得分。
8-3实验测定,上述Mg2NiH4晶体的晶胞参数为646.5pm,计算该晶体中镁和镍的核间距。
已知镁和镍的原子半径分别为159.9pm和124.6pm。
镁镍间的距离为
(2分)
算式及答案皆正确(包括单位)得2分;算式对但结果错;只得1分;结果中数对但单位错,得1.5分。
用原子半径相加计算镁-镍间的距离,不得分。
8-4若以材料中氢的密度与液态氢密度之比定义储氢材料的储氢能力,计算Mg2NiH4的储氢能力(假定氢可全部放出;液氢的密度为0.0708gcm3)。
储氢能力=晶体的密度×氢的质量分数÷液氢密度
(2分)
=1.40
=1.4
算法及结果皆正确得2分;算法(式)正确但结果错得1分;无过程不得分。
只有结果但无算式,不得分。
氢的原子量取1不取1.008,算出结果1.39,只得1.5分。
(2009)第6题(10分)
6-1文献中常用下图表达方解石的晶体结构:
图中的平行六面体是不是方解石的一个晶胞?
简述理由。
不是。
(1分)
晶体的平移性决定了晶胞的8个顶角必须相同,平行棱的结构必须相同,平行面的结构必须相同,而该平行六面体平行棱上的碳酸根离子的取向是不同的。
(1分)
6-2文献中常用下图表达六方晶体氟磷灰石的晶体结构:
该图是c轴投影图,位于图中心的球是氟,大球是钙,四面体是磷酸根(氧原子未画出)。
试以此图为基础用粗线画出氟磷灰石晶胞的c轴投影图,设晶胞顶角为氟原子,其他原子可不补全。
(2分)
6-3某晶体的晶胞参数为:
a=250.4pm,c=666.1pm,γ=120o;原子A的原子坐标为0,0,1/2和1/3,2/3,0,原子B的原子坐标为1/3,2/3,1/2和0,0,0。
(1)试画出该晶体的晶胞透视图(设晶胞底面即ab面垂直于纸面,A原子用“○”表示,B原子用“●”表示)。
或
(2分)
(2)计算上述晶体中A和B两原子间的最小核间距d(AB)。
d(AB)=250.4pm0.5cos30o=144.6pm
只要有计算过程,得出正确的核间距(2分)
(3)共价晶体的导热是共价键的振动传递的。
实验证实,该晶体垂直于c轴的导热性比平行于c轴的导热性高20倍。
用上述计算结果说明该晶体的结构与导热性的关系。
因为该晶体的c=666.1pm,是AB最短核间距的4.6倍,其间不可能有共价键,只有范德华力,该晶体属层状晶体,难以通过由共价键振动传热。
(2分)
(2010)
第3题(7分)早在19世纪人们就用x金属硼化物和碳反应得到了碳化硼。
它是迄今已知的除金刚石和氮化硼外最硬的固体。
1930年确定了它的理想化学式。
左下图是2007年发表的一篇研究论文给出的碳化硼晶胞简图。
3-1该图给出了晶胞中的所有原子,除“三原子”(中心原子和与其相连的2个原子)外,晶胞的其余原子都是B12多面体中的1个原子,B12多面体的其他原子都不在晶胞内,均未画出。
图中原子旁的短棍表示该原子与其他原子相连。
若上述“三原子”都是碳原子,写出碳化硼的化学式。
3-2该图有什么旋转轴?
有无对称中心和镜面?
若有,指出个数及它们在图中的位置(未指出位置不得分)。
有一根3重旋转轴(过上述“三原子”的直线)。
(1分)
有对称中心,在晶胞中心。
(1分)
有3个镜