第七讲 氮及其重要化合物的性质和应用.docx
《第七讲 氮及其重要化合物的性质和应用.docx》由会员分享,可在线阅读,更多相关《第七讲 氮及其重要化合物的性质和应用.docx(18页珍藏版)》请在冰豆网上搜索。
第七讲氮及其重要化合物的性质和应用
第七讲氮及其重要化合物的性质和应用
一、知识梳理
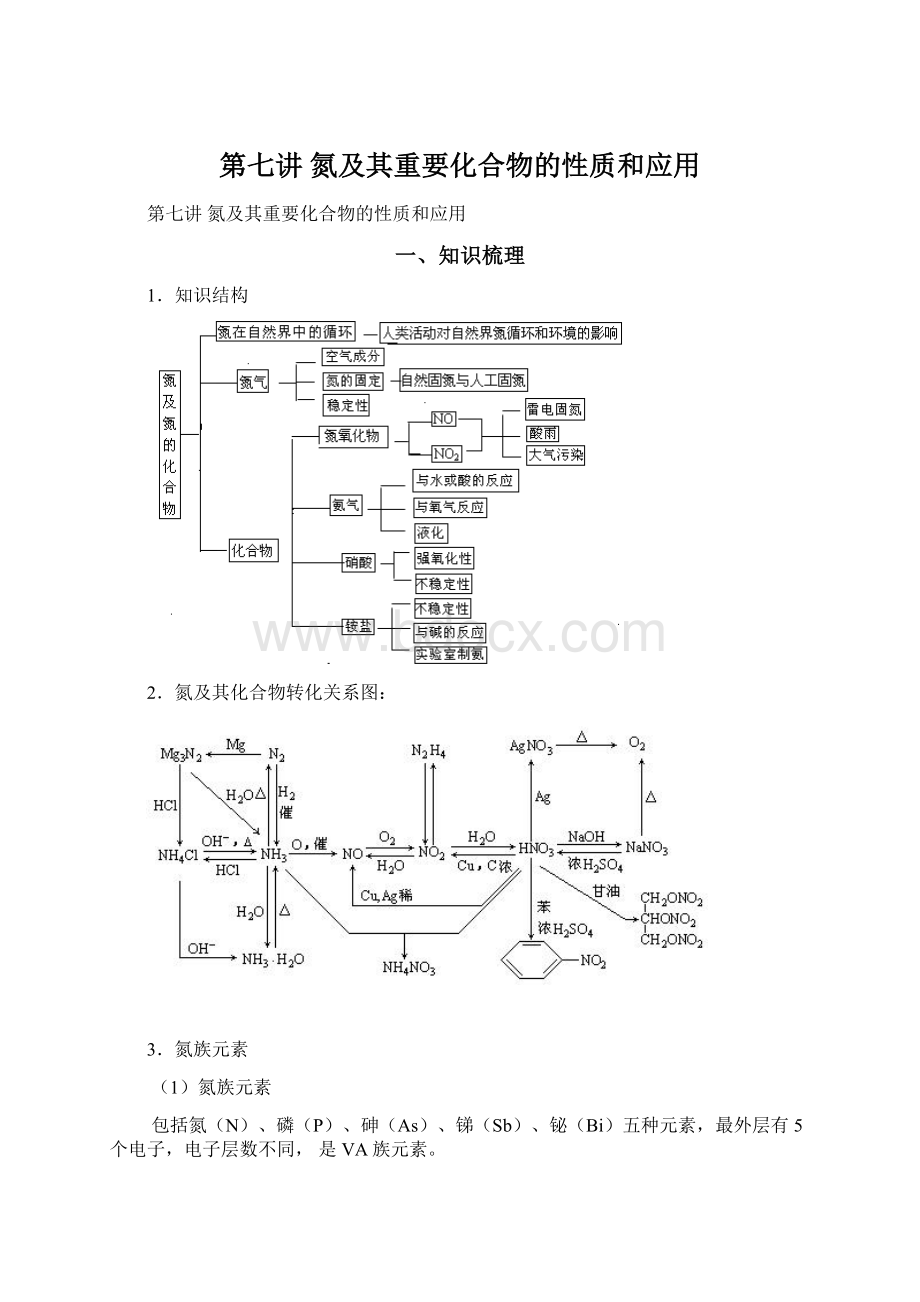
1.知识结构
2.氮及其化合物转化关系图:
3.氮族元素
(1)氮族元素
包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)五种元素,最外层有5个电子,电子层数不同,是VA族元素。
(2)氮族元素性质比较
在周期表中从上到下性质相似,最高价态为+5,负价为-3,Sb、Bi无负价;最高价氧化物水化物(HRO3或H3RO4)呈酸性。
但非金属性逐渐减弱,金属性逐渐增强,从非金属元素逐渐过渡到金属元素。
具体表现为:
如氢化物的稳定性:
NH3>PH3>AsH3,最高价氧化物水化物的酸性:
HNO3>H3PO4等;这是由于它们的原子中最外层都有5个电子(性质相似),而在周期表中按从上到下的顺序电子层数逐渐增多(得电子能力逐渐减弱,失电子能力逐渐增强)引起的。
4.氮元素单质及其重要化合物的主要性质、制法及应用
氮元素是一种典型的变价元素,掌握氮元素形成的单质和化合物的有关知识,应抓住以
下线索(N元素化合价为线索)
化合价-30+2+4+5
物质NH3N2NONO2HNO3
(铵盐)(硝酸盐)
而对其中每种物质都从结构、性质(物理、化学)、制法、用途四方面来认识理解记忆,最后在各物质(不同价态间)间形成相互转化的知识网络。
氨气(NH3)
(1)分子结构:
由极性键形成的三角锥形的极性分子,N原子有一孤对电子;N-3价,
为N元素的最低价态
(2)物理性质:
无色、刺激性气味的气体,密度比空气小,极易溶于水,常温常压下
1体积水能溶解700体积的氨气,易液化(可作致冷剂)
(3)化学性质:
①与H2O反应:
NH3+H2O
NH3·H2O
+
,
溶液呈弱碱性,氨水的成份为:
NH3、H2O、NH3·H2O、
、
、H+,氨水易挥发;
②与酸反应:
NH3+HCl
NH4ClNH3+HNO3
NH4NO3(有白烟生成);
③还原性(催化氧化):
4NH3+5O2
4NO+6H2O(N为-3价,最低价态,具有还原性)
(4)实验室制法Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O;
工业上采取N2与H2在高温高压催化剂条件下合成氨气
(5)用途:
化工原料,制硝酸、氮肥等,作致冷剂
铵盐
(1)物理性质:
白色晶体,易溶于水
(2)化学性质:
①受热分解:
NH4HCO3
NH3↑+H2O+CO2↑(30℃以上可分解),
NH4Cl
NH3↑+HCl↑
②与碱反应:
Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O
铵盐与碱溶液反应的离子方程式:
+
NH3↑+H2O(该性质可用于
氨气的制取和铵根离子的检验)
氮气(N2)
(1)分子结构:
电子式为∶N┇┇N∶,结构式为N≡N,氮氮叁键键能大,分子结构稳定,化学性质不活泼。
(2)物理性质:
纯净的氮气是无色无味的气体,难溶于水,空气中约占总体积的78%。
(3)化学性质:
常温下性质稳定,可作保护气;但在高温、放电、点燃等条件下能与
H2、O2、IIA族的Mg、Ca等发生化学反应,即发生氮的固定(将
空气中的氮气转
变为含氮化合物的过程,有自然固氮和人工固氮两种形式)。
高温、高压
催化剂
N2中N元素0价,为N的中间价态,既有氧化性又有还原性
①与H2反应:
N2+3H2
2NH3
点燃
②与O2反应:
N2+O2
2NO
③与活泼金属反应:
N2+3Mg
Mg3N2
(4)氮气的用途:
化工原料;液氮是火箭燃烧的推进剂;还可用作医疗、保护气等。
氮的氧化物
(1)氮的氧化物简介:
氮元素有+1、+2、+3、+4、+5五种正价态,对应有六种氧化物
种类
色态
化学性质
N2O
无色气体
较不活泼
NO
无色气体
活泼,不溶于水
N2O3(亚硝酸酐)
蓝色液体(-20℃)
常温极易分解为NO、NO2
NO2
红棕色气体
较活泼,与水反应
N2O4
无色气体
较活泼,受热易分解
N2O5(硝酸酸酐)
无色固体
气态时不稳定,易分解
(2)NO和NO2的重要性质和制法
①性质:
2NO+O2
2NO2(易被氧气氧化,无色气体转化为红棕色);
2NO2(红棕色)
==N2O4(无色)(平衡体系);
3NO2+H2O
2HNO3+NO(工业制硝酸);
NO+NO2+2NaOH
2NaNO2+H2O(尾气吸收);
NO2有较强的氧化性,能使湿润的KI淀粉试纸变蓝。
②制法:
NO:
3Cu+8HNO3(稀)
3Cu(NO3)2+2NO↑+4H2O(必须__________
法收集NO);
NO2:
Cu+4HNO3(浓)
Cu(NO3)2+2NO2↑+2H2O(必须___________法收集NO2)
(3)氮的氧化物溶于水的计算
①NO2或NO2与N2(非O2)的混合气体溶于水可依据3NO2+H2O
2HNO3+NO利用气体体积变化差值进行计算。
②NO2和O2的混合气体溶于水时由4NO2+O2+2H2O
4HNO3进行计算,当体积比V(NO2)︰V(O2)=4︰1时,恰好反应;>4︰1时,NO2过量,剩余NO;<4︰1时,O2过量,剩余O2。
③NO和O2同时通入水中时,由4NO+3O2+2H2O
4HNO3进行计算,原理同②。
④NO、NO2、O2的混合气体通入水中,先按①求出NO的体积,再加上混合气体中NO的体积再按③方法进行计算。
(4)氮的氧化物(NO、NO2)对环境的影响
氮氧化物是形成光化学烟雾和酸雨的一个重要原因,同时也可造成水体污染。
汽车尾气中的氮氧化物(燃料在发动机内高温燃烧时,空气中的氮气与氧气反应生成的)与碳氢化合物经紫外线照射发生反应生成形成的一种有毒的烟雾,称为光化学烟雾。
光化学烟雾具有特殊气味,刺激眼睛、伤害植物并使大气能见度降低。
另外,氮氧化物与空气中的水反应生成硝酸和亚硝酸,是酸雨的成分。
大气中氮氧化物主要来源于化石燃料的燃烧、
汽车尾气和植物体的焚烧,以及农田土壤和动物排泄物中含氮化合物的转化。
因此必须减少氮氧化物的排放,控制进入大气、陆地和海洋的含氮的氧化物。
在工业上含氮氧化物的尾气吸收常用以下反应:
NO2+NO+2NaOH=2NaNO2+H2O,既可以回收尾气,生成的亚硝酸盐又是重要的化工原料。
硝酸(HNO3)
(1)物理性质:
无色、刺激性气味、易挥发液体,能与水以任意比例互溶,常用浓硝酸的质量分数大约为69%。
(2)化学性质
硝酸为强酸,具有以下性质:
①具有酸的通性,
②不稳定性:
4HNO3
4NO2↑+O2↑+2H2O
③强氧化性:
无论浓、稀硝酸均具有强氧化性,与金属反应时不放出氢气。
a、与金属反应:
Cu+4HNO3(浓)
Cu(NO3)2+2NO2↑+2H2O;
3Cu+8HNO3(
稀)
3Cu(NO3)2+2NO↑+4H2O;
3Ag+4HNO3(稀)
3AgNO3+NO↑+2H2O;
常温下浓硝酸与铁、铝发生钝化。
b、与非金属反应:
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O。
c、与其他还原剂反应,如H2S、SO2、Fe2+等。
d、与有机物反应:
硝化反应、酯化反应、与蛋白质发生颜色反应等。
(3)制法
①实验室制法:
硝酸盐与浓硫酸微热,
NaNO3(固)+H2SO4(浓)
NaHSO4+HNO3↑(不能用强热和稀硫酸);
②工业制法:
氨的催化氧化法,4NH3+5O2
4NO+6H2O;
2NO+O2
2NO2;3NO2+H2O
2HNO3+NO;
尾气处理:
NO2+NO+2NaOH
2NaNO2+H2O
(4)用途:
制硝酸盐、氮肥、炸药、染料等。
二、课堂精讲例题
例题1如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是()
①CO、O2 ②Cl2、CH4 ③NO2、O2 ④N2、H2
A.①②B.②④C.③④D.②③
搭配课堂训练题
1.“保护环境,就是保护人类自己。
”下列环境问题与产生的主要原因不相符的是()
①“臭氧空洞”主要是大量使用氟氯代烃等引起的
②“光化学烟雾”主要是由NO2等引起的
③“酸雨”主要是由空气中CO2浓度增大引起的
④“白色污染”主要是由聚乙烯塑料等引起的
⑤“厄尔尼诺”现象由空气中CO2浓度增大引起的
⑥“温室效应”主要是由空气中CO2浓度增大引起的
⑦“赤潮”主要是由水体中P、N等元素过量引起的
A.只有①② B.只有②③⑤
C.全部D.只有③
2.如下图所示,相同条件下,两个容积相同的试管分别装满NO2和NO气体,分别倒置于水槽中,然后通过导管缓慢通入氧气,边通边慢慢摇动试管,直到两个试管内充满液体。
假设试管内的溶质不向水槽中扩散,则两个试管内溶液物质的量浓度之比为()
A.1∶1B.5∶7
C.7∶5D.4∶3
重复例题2对某酸性溶液(可能含有
、
、H2SO3、
)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝;③加入氯水时,溶液显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在原溶液中是否存在的是()
A.Br-B.
C.H2SO3D.
搭配课堂训练题
1.无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体经过下图所示实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为()
A.NH3、NO2、N2B.NH3、NO、CO2
C.NH3、NO2、CO2D.NO、CO2、N2
2.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述中正确的是()
A.反应速率:
两者相同
B.消耗硝酸的物质的量:
前者多,后者少
C.反应生成气体的颜色:
前者浅,后者深
D.反应中转移的电子总数:
前者多,后者少
例题3将盛有amolNO2和bmolNO(标准状况下)混合气体的试管倒立于水槽中,再通入
bmolO2,充分反应后试管里剩余气体的成分及物质的量决定于a与b的关系,请填写表格:
a与b的关系
剩余气体的成分
剩余气体物质的量
若a=b
若a>b
若aO2
搭配课堂训练题
【题目】:
某化学课外小组欲用固体与液体反应(不需加热),快速简便地制取一满瓶(125mL)干燥的氧气。
(1)从所提供的仪器(或装置)A至G中,选出所需要的(填序号)________。
(2)选用的试剂为______________________,化学反应方程式________________________。
(3)用上述所选的气体发生装置,除可制取O2、H2、CO2外,请于下表中写出还可用此装置制取的2种其他气体及制取该气体所需的试剂。
气体
所需试剂
①
②
三、课后自我检测
A类题(10道题):
1