高中化学总复习之知识讲解氮磷提高.docx
《高中化学总复习之知识讲解氮磷提高.docx》由会员分享,可在线阅读,更多相关《高中化学总复习之知识讲解氮磷提高.docx(22页珍藏版)》请在冰豆网上搜索。
高中化学总复习之知识讲解氮磷提高
高考总复习《氮磷》
【考纲要求】
1.了解氮气的性质及应用。
2.了解氮的氧化物(NO、NO2)的性质及对环境的影响。
3.掌握氨气的结构、性质、制法和用途。
4.了解硝酸的氧化性。
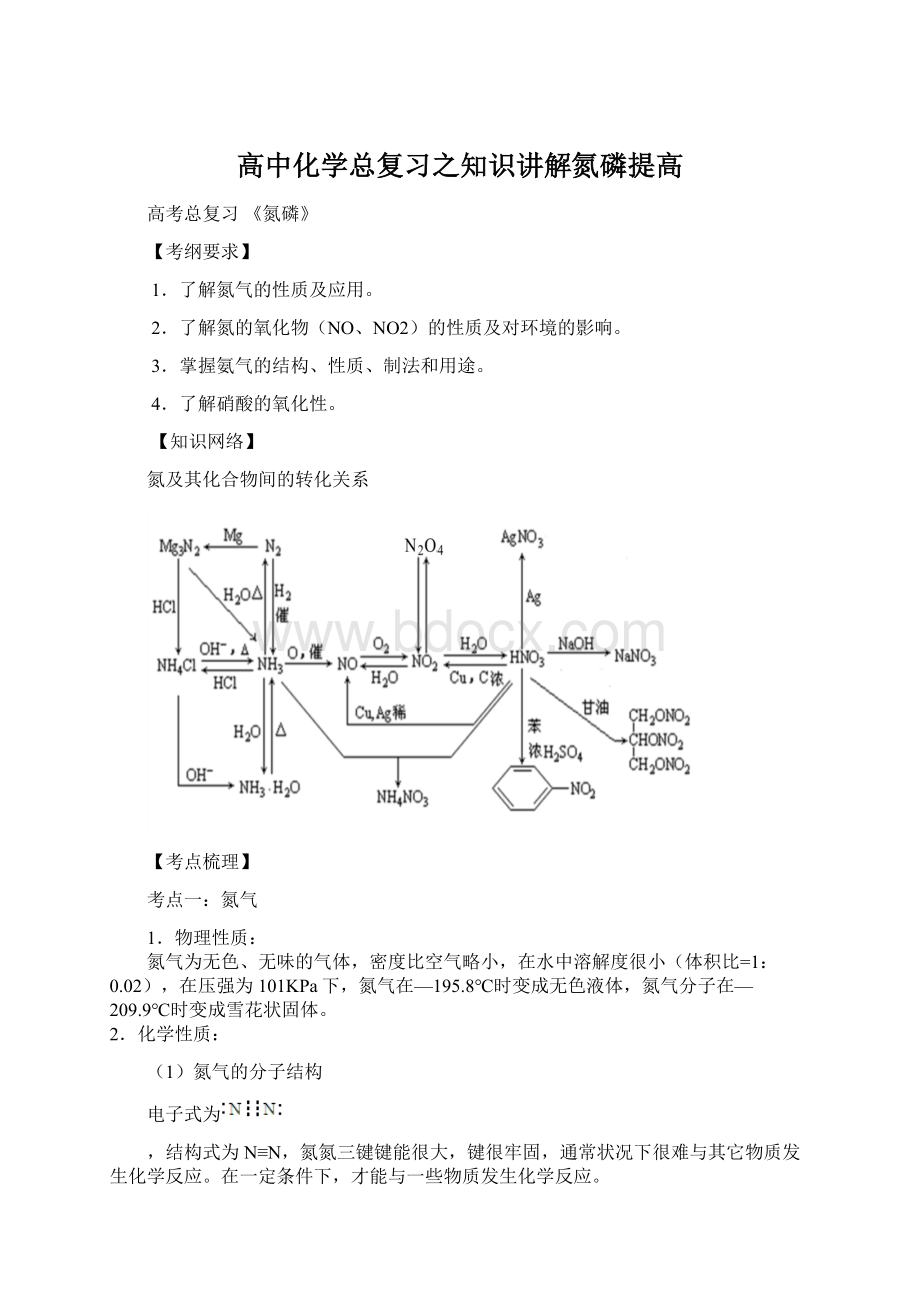
【知识网络】
氮及其化合物间的转化关系
【考点梳理】
考点一:
氮气
1.物理性质:
氮气为无色、无味的气体,密度比空气略小,在水中溶解度很小(体积比=1:
0.02),在压强为101KPa下,氮气在—195.8℃时变成无色液体,氮气分子在—209.9℃时变成雪花状固体。
2.化学性质:
(1)氮气的分子结构
电子式为
,结构式为N≡N,氮氮三键键能很大,键很牢固,通常状况下很难与其它物质发生化学反应。
在一定条件下,才能与一些物质发生化学反应。
(2)氮气的化学性质
①与H2反应:
(氨气的工业制法)
②与某些金属反应:
3Mg+N2
Mg3N2
③与O2反应:
N2+O2
2NO(闪电、汽车引擎中发生的反应)
NO很容易在常温下与空气中的O2化合,生成NO2:
2NO+O2==2NO2,NO、NO2为大气污染物。
3.工业制法:
(1)分离液态空气:
(2)耗氧法:
4.用途:
工业原料,合成氨,制化肥,HNO3,保护气,致冷剂
考点二:
二氧化氮和一氧化氮的比较
【356211氮的氧化物】
NO
NO2
物
理性质
色态味
无色、无味、气体
红棕色、刺激性气味、气体
密度
密度略大于空气
密度比空气大,
熔沸点
很低
低,易液化
溶解性
不溶
易溶
毒性
有毒
有毒
化学性质
与水
不反应
3NO2+H2O=2HNO3+NO
NO2既是氧化剂,又是还原剂
与碱
不反应
2NO2+2NaOH=NaNO3+NaNO2+H2O
NO+NO2+2NaOH=2NaNO2+H2O
氧化性
2NO+2CO=2CO2+N2
2NO2+2KI=I2+2KNO2
还原性
2NO+O2=2NO2
可使KMnO4褪色
可使KMnO4褪色
(与O2混合,通入水中
4NO+3O2+2H2O=4HNO3
4NO2+O2+2H2O=4HNO3
实验室制取
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
收集方法
排水法
向上排空气法
要点诠释:
①氮的氧化物除NO、NO2外,还有N2O、NO、N2O3、NO2、N2O4、N2O5,其中N2O5、N2O3分别是硝酸、亚硝酸(HNO2)的酸酐。
②NO能与人体中的血红蛋白结合使血液丧失输送氧气的能力;空气中的NO和NO2污染物主要来自汽车尾气以及制硝酸的工厂的废气等,空气中的NO2也是造成酸雨和光化学烟雾的主要因素之一。
考点三:
氮的氧化物溶于水的计算
1.关系式法
(1)NO2与NO、N2等气体的混合气体溶于水时可依据:
3NO2+H2O==2HNO3+NO利用气体体积变化差值进行计算。
(2)NO2和O2的混合气体溶于水时,由4NO2+O2+2H2O==4HNO3可知,当体积比:
(3)NO和O2同时通入水中时,由4NO+3O2+2H2O==4HNO3可知,当体积比:
(4)NO、NO2、O2三种混合气体通入水中,可先按
(1)求出NO2与H2O反应生成的NO的体积,再加上原混合气体中的NO的体积即为NO的总体积,再按(3)方法进行计算。
2.电子守恒法
当NO2或NO转化为HNO3时要失去电子,若上述两种气体与O2混合,O2得电子,且得失电子数必然相等,这是电子守恒法解答此类题目的依据。
H
H
考点四:
氨气
1.氨分子的结构:
氨的电子式为,结构式为,氨分子的空间构型是三角锥形。
由于氨分
子中N-H键的极性强,氨分子与水分子、氨分子与氨分子间存在较强的分子间作用力(氢键),所以氨易溶于水,氨的熔、沸点相对较高(易液化)。
2.氨的物理性质
NH3是无色、有刺激性气味、极易溶于水的气体,常温时,1体积水可溶解700体积的氨气。
3.氨的化学性质
(1)与水反应:
生成氨水
NH3+H2O
NH3·H2O
NH4++OH―
氨溶于水所得的水溶液称为氨水,其中大部分氨与水结合成一水合氨(NH3·H2O)。
氨水显弱碱性,能使酚酞试液变红。
NH3·H2O受热又容易分解为NH3和H2O。
NH3是唯一能使红色石蕊试纸变蓝的气体,常用此性质检验NH3。
(2)与酸反应:
生成铵盐
NH3+HCl=NH4Cl(白烟)
NH3+HNO3=NH4NO3(白烟)
2NH3+H2SO4=(NH4)2SO4
(3)与某些盐反应:
一般生成难溶的碱
如氯化铁溶液与氨水反应:
Fe3++3NH3·H2O==Fe(OH)3↓+3NH4+
(4)还原性
氨分子中的氮元素呈-3价,因此氨气在一定条件下具有还原性,在一定条件下可被某些强氧化剂氧化。
4NH3+5O2
4NO+6H2O
4NH3+3O2(纯氧)
2N2+6H2O
2NH3(少量)+3Cl2==N2+6HCl
8NH3(过量)+3Cl2==N2+6NH4Cl
2NH3+3CuO
N2+3H2O+3Cu
4.氨气的实验室制法
(1)原理:
Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O。
(2)装置:
“固体+固体
气体”(与用KClO3或KMnO4制O2的装置相同)。
(3)收集:
只能用向下排空气法。
(4)干燥:
用碱石灰(NaOH和CaO固体的混合物)。
(5)验满方法:
①用湿润的红色石蕊试纸置于试管口,试纸变蓝色;②将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生。
(6)环保措施:
用稀硫酸吸收多余的氨气,吸收时用防倒吸装置,如图。
要点诠释:
①收集NH3时所用仪器必须干燥,导气管要插入管底。
②干燥NH3应用碱石灰、CaO、固体NaOH等碱性干燥剂,不能用浓H2SO4、P2O5(固体)等酸性干燥剂;不能用无水CuSO4,也不能用无水CaCl2(因NH3与CaCl2能形成CaCl2·8NH3)。
③制氨气时所用铵盐不能是硝酸铵、碳酸氢铵。
因为加热过程中NH4NO3可能发生爆炸而有危险;NH4HCO3受热极易分解产生CO2,使生成的NH3中混有较多的CO2杂质。
(7)快速制NH3的方法:
①加热浓氨水(装置:
见图Ⅰ)
反应原理:
NH3·H2O
NH3↑+H2O。
②浓氨水中加固态碱性物质(装置:
见图Ⅱ)
反应原理:
浓氨水中存在以下平衡:
NH3+H2O
NH3·H2O
NH4++OH―,加入固态碱性物质(如CaO、NaOH、碱石灰等),消耗水且使c(OH―)增大,使平衡逆向移动,同时反应放热,促进NH3·H2O的分解。
NH3·H2O+CaO=NH3↑+Ca(OH)2
5.氨的喷泉实验
(1)、实验步骤:
在干燥的圆底烧瓶时充满氨气,用带有玻璃管和滴管(滴管里预先吸入水)的塞子塞紧瓶口。
立即倒置烧瓶,使玻璃管插入盛有水的烧杯里(水里事先加入少量酚酞试液),按图甲安装好装置。
打开橡皮管上的夹子,挤压滴管的胶头,使少量水进入烧瓶,观察现象。
(2)、实验现象:
可以看到,烧杯里的水经玻璃管进入烧瓶,形成喷泉,烧瓶内液体呈红色。
(3)、实验结论:
氨易溶于水,氨与水反应生成了易溶于水且能使溶液显碱性的物质。
要点诠释:
喷泉实验原理
①容器内气体极易溶于水或容器内气体易与溶液中的溶质发生化学反应。
当外部的水或溶液接触容器内气体时,由于气体大量溶解或与溶液中的溶质发生化学反应,使容器内压强迅速降低,在外界的大气压作用下,外部液体迅速进入容器,通过尖嘴导管喷出,形成喷泉。
下表列出的气体作用于吸收剂,就能形成喷泉。
气体
HCl
NH3
CO2、Cl2、H2S、SO2
NO2+O2
CH2=CH2
吸收剂
水或NaOH溶液
水或盐酸
浓NaOH溶液
水
溴水
②密闭容器内的液体由于受热挥发(如浓盐酸、浓氨水、酒精等)或发生化学反应,容器内产生大量气体,容器内压强迅速增大,促使容器内液体迅速向外流动,形成喷泉。
如喷雾器、人造喷泉、火山喷发等均是此原理。
考点五:
铵盐
1.物理性质
铵盐是由铵根和酸根构成的离子化合物,铵盐都是白色或无色晶体,都易溶于水。
2.化学性质
(1)受热分解(热解)
NH4Cl
NH3↑+HCl↑(用于除去或分离铵盐)
说明:
NH4Cl受热分解成NH3和HCl,遇冷NH3和HCl又反应生成的NH4Cl,本质上发生了化学反应,不要误认为是升华。
NH4HCO3
NH3↑+CO2↑+H2O
(NH4)2CO3
2NH3↑+CO2↑+H2O
(2)碱解——与强碱反应(铵盐的共性)
NH4++OH-
NH3↑+H2O
3.NH4+的检验方法:
(1)取少许样品与碱混合于试管中共热,将湿润的红色石蕊试纸靠近管口,若石蕊试纸变蓝,则证明样品中含NH4+。
(2)取少许样品于试管口,加入烧碱后加热,用蘸有浓盐酸的玻璃棒检验产生的气体,若有白烟产生,则证明样品中含有NH4+。
考点六:
硝酸
1.物理性质
(1)纯硝酸是无色、有刺激性气味的液体。
(2)硝酸沸点(83℃)低,易挥发,在空气中遇水蒸气呈白雾状。
(3)质量分数69%以上的硝酸称为浓硝酸。
2.化学性质
(1)酸的通性:
一元强酸。
如:
稀硝酸使紫色石蕊试液变红。
(2)不稳定性
①硝酸不稳定,见光或受热易分解,其反应方程式为:
4HNO3
2H2O+4NO2↑+O2↑
②存放:
HNO3应盛放在棕色试剂瓶里,并存放在黑暗阴凉处。
③浓硝酸常呈黄色是因为HNO3分解产生的NO2溶解于硝酸中,去掉硝酸中黄色的方法是通入少量O2,发生的反应为:
4NO2+O2+2H2O==4HNO3
(3)强氧化性
①与金属的反应(大部分金属能与硝酸反应)
a.Cu与浓、稀硝酸均能起反应,其反应方程式分别为:
Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
b.常温下,铁、铝遇冷的浓HNO3能发生钝化,原因是浓HNO3使Fe、Al表面生成一层致密的氧化物薄膜,阻止了酸与内层金属的进一步反应,故常温下可用铁、铝容器盛装冷的浓HNO3。
但加热能和它们发生剧烈的发生化学反应。
如:
Al+6HNO3(浓)
Al(NO3)3+3NO2↑+3H2O
②与非金属(木炭)的反应:
C+4NHO3(浓)
CO2↑+4NO2↑+2H2O。
③硝酸还能与其他还原剂,如H2S、SO2、Na2SO3、FeSO4、KI、NaBr等发生氧化还原反应。
④王水
浓HNO3和浓盐酸按体积比1∶3混合即为王水,它的氧化性更强,能溶解Pt、Au等金属。
3.用途:
制炸药、染料、塑料、硝酸盐等。
考点七:
磷及其化合物
1.磷的同素异形体
名 称
白 磷
红 磷
物
理
性
质
颜色状态
白色蜡状固体
红色粉末
毒性
剧毒
无毒
溶解性
易溶于CS2,不溶于水
不溶于H2O和CS2
密度
1.82g·cm-3
2.3g·cm-3
着火点
40℃
240℃
化
学
性
质
与O2反应
4P+5O2
2P2O5(白烟)
与Cl2反应
2P+3Cl2
2PCl3(白雾)
2P+5Cl2
2PCl5(白烟)
相