高考化学复习高考真题实验.docx
《高考化学复习高考真题实验.docx》由会员分享,可在线阅读,更多相关《高考化学复习高考真题实验.docx(23页珍藏版)》请在冰豆网上搜索。
高考化学复习高考真题实验
高中化学学习材料
金戈铁骑整理制作
2009年高考真题——化学实验
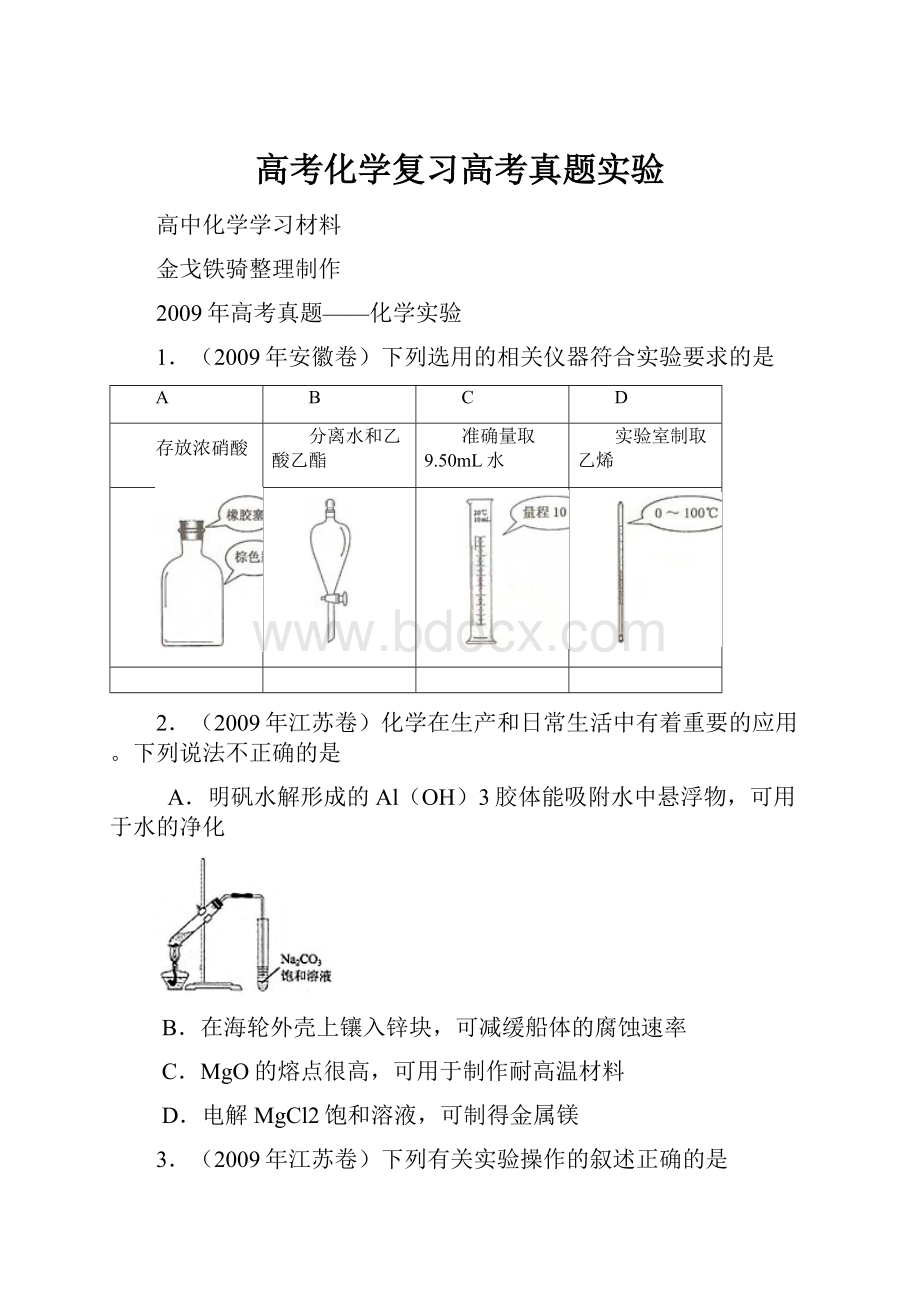
1.(2009年安徽卷)下列选用的相关仪器符合实验要求的是
A
B
C
D
存放浓硝酸
分离水和乙酸乙酯
准确量取9.50mL水
实验室制取乙烯
2.(2009年江苏卷)化学在生产和日常生活中有着重要的应用。
下列说法不正确的是
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.MgO的熔点很高,可用于制作耐高温材料
D.电解MgCl2饱和溶液,可制得金属镁
3.(2009年江苏卷)下列有关实验操作的叙述正确的是
A.实验室常用右图所示的装置制取少量的乙酸乙酯
B.用50mL酸式滴定管可准确量取25.00mLKmnO4溶液
C.用量筒量取5.00mL1.00mol·L-1盐酸于50mol容量
瓶中,加水稀释至刻度,可配制0.100mol·L-1盐酸
D.用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
4.(2009年上海卷)下列措施不能达到节能减排目的的是
A.利用太阳能制氢燃料B.用家用汽车代替公交车
C.利用潮汐能发电D.用节能灯代替白炽灯
5.(2009年上海卷)下列坐标图所表示的量的关系错误的是
6.(2009年广东卷)下列措施不符合节能减排的是
A.大力发展火力发电,解决广东电力紧张问题
B.在屋顶安装太阳能热水器为居民提供生活用热水
C.用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D.用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
7.(2009年广东卷)工业废水中常含有不同类型的污染物,可采用不同的方法处理。
以下处理措施和方法
选项
污染物
处理措施
方法类别
A
废酸
加生石灰中和
物理法
B
Cu2+等重金属离子
加硫酸盐沉降
化学法
C
含苯废水
用活性炭吸附
物理法
D
含纯碱的废水
加石灰水反应
化学法
8.(2009年江苏卷)《中华人民共和国食品安全法》于2009年6月1日起实施。
下列做法不利于食品安全的是
A.用聚氯乙烯塑料袋包装食品
B.在食用盐中添加适量的碘酸钾
C.在食品加工中科学使用食品添加剂
D.研发高效低毒的农药,降低蔬菜的农药残留量
9.(2009年四川卷)下列有关物质检验的实验结论正确的是
选项
实验操作及现象
实验结论
A
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成
该溶液中一定含有SO2-4
B
向某溶液中加入2滴KSCN溶液,溶液不显红色。
再向溶液中加入几滴新制的氯水,溶液变为红色
该溶液中一定含有Fe2+
C
将某气体通入品红溶液中,品红溶液褪色
该气体一定是SO2
D
将少量某物质的溶液滴加到新制的银溶液中,水浴加热后有银镜生成
该物质一定属于醛类
10.(2009年重庆卷)有关实验的叙述,正确的是
A.将固体加入容量瓶中溶解并稀释至刻度,配置成一定物质的量浓度的溶液
B.用玻璃棒蘸取溶液,点在湿润的pH是指上测定其pH
C.用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应
D.读取滴定管内液体的体积,俯视读数导致读数偏小
11.(2009年浙江卷)已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就列溶液沸点最高的是
A.0.01mol·L-1的蔗糖溶液
B.0.01mol·L-1的CaCl2溶液
C.0.02mol·L-1的NaCl溶液
D.0.02mol·L-1的CH3OOH溶液
12.(2009年浙江卷)下列说法正确的是
A.仅用AgNO3溶液便可鉴别亚硝酸钠和食盐
B.重结晶时,溶液冷却速度越慢得到的晶体颗粒越大
C.乙酸与乙醇的混合液可用分液漏斗进行分离
D.用盐酸标准溶液滴定待测氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,
则次测结果偏低
13.(2009年天津卷)下列实验设计和结论相等的是
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
C.某无色溶液中加Ba(NO2)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO2-4
D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
14.(2009年江苏卷)下列化学实验事实及其解释都正确的是
A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
B.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸
C.向0.1mol·L-1FeSO4溶液中滴加少量酸性KmnO4溶液,KmnO4溶液褪色,说明Fe2+具有氧化性
D.向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Kap比AgI的Kap大
15.(2009年上海卷)下列实验装置不适用于物质分离的是D
16.(2009年上海卷)在下列变化①大气固氮②硝酸银分解③实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是
A.①②③B.②①③C.③②①D.③①②
17.(2009年全国2卷)下列关于溶液和胶体的叙述,正确的是
A.溶液是电中性的,胶体是带电的
B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
C.溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动
D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有
18.(2009年上海卷)物质鉴别有多种方法。
下列能达到鉴别目的的是
①用水鉴别苯、乙醇、溴苯
②用相互滴加的方法鉴别Ca(OH)2和NaHCO3溶液
③点燃鉴别甲烷和乙炔
A.①②B.①③C.②③D.①②③
19.(2009年广东卷)下列实验能达到实验目的且符合安全要求的是
20.(2009年广东卷)下列除去杂质的方法正确的是
A.除去CO2中混有的CO:
用澄清石灰水洗气
B.除去BaCO3固体中混有的BaSO4:
加过量盐酸后,过滤、洗涤
C.除去FeCl2溶液中混有的FeCl3:
加入过量铁粉,过滤
D.除去Cu粉中混有的CuO:
加适量稀硝酸后,过滤、洗涤3.(2009年广东卷)下列21、有关实验操作的说法正确的是
A.可用25ml碱式滴定管量取20.00mlKMnO4溶液
B.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干
D.将金属钠在研体中研成粉末,使钠与水反应的实验更安全
22.(2009年广东卷)广州将于2010年承办第16界亚运会。
下列措施有利于节能减排、改善环境质量的有
①在大亚湾核电站已安全运行多年的基础上,广东将继续发展核电,以减少火力发电带来的二氧化硫和二氧化碳排放问题
②积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料
③加速建设地铁轻轨等轨道交通,促进珠三角城市一体化发展,减少汽车尾气排放
④发展低碳经济、循环经济,推广可利用太阳能、风能的城市照明系统
⑤使用生物酶降解生活废水中的有机物,使用填埋法处理未经分类的生活垃圾
A.①②③④B.①②⑤C.①②④⑤D.③④⑤
23.(2009年广东卷)(12分)
某试验小组利用如下装置(部分固定装置略)制备氧化钙(Ca3N2),并探究其实验式。
(1)按图连接好实验装置。
检查装置的气密性,方法是。
(2)反映过程中末端导管必须插入试管A的水中,目的是。
(3)制备氮化钙的操作步骤是:
①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后,;④拆除装置,取出产物。
(4)数据记录如下:
空瓷舟质量m0/h
瓷舟与钙的质量m1/g
瓷舟与产物的质量m2/g
14.80
15.08
15.15
①计算得到实验式Ca2N2,其中x=.
②若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:
。
24.(2009年广东卷)(12分)
三草酸合铁酸钾晶体K3[Fe(C3O4)3]·3H2O可有于摄影和蓝色印刷。
某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。
请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:
浓硫酸、1.0mol·L-1HNO、1.0mol·L-1盐酸、1.0mol·L-1NaOH、3%H2O2、0.1mol·L-1KI、0.1mol·L-1CuSO4、20%KSCN、澄清石灰水,氧化铜、蒸馏水。
(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C)观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。
验证固体产物中钾元素存在的方法是,现象是。
(3)固体产物中铁元素存在形式的探究。
①提出合理假设
假设1:
;假设2:
;假设3:
。
②设计实验方案证明你的假设(不要在答题卡上作答)
③实验过程
根据②中方案进行实验。
在答题卡上按下表的格式写出实验步骤、预期现象与结论。
实验步骤
预期现象与结论
步骤1:
步骤2:
步骤3:
……
25.(2009年福建卷)(17分)
某研究性小组借助A-D的仪器装置完成有关实验
【实验一】收集NO气体。
(1)用装置A收集NO气体,正确的操作上(填序号)。
a.从①口进气,用排水法集气b.从①口进气,用排气法集气
c.从②口进气,用排水法集气d..从②口进气,用排气法集气
【实验二】为了探究镀锌薄铁板上的锌的质量分数
和镀层厚度,查询得知锌易溶于碱:
Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1g。
用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
方案甲:
通过测量试样与碱反应生成的氢气体积来实现探究木目标。
(2)选用B和(填仪器标号)两个装置进行实验。
(3)测得充分反应后生成氢气的体积为VL(标准状况),
=。
(4)计算镀层厚度,还需要检索的一个物理量是。
(5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将(填“偏大”、“偏小”或“无影响”)。
方案乙:
通过称量试样与碱反应前后的质量实现探究目标。
选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g。
(6)
。
方案丙:
通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。
实验同样使用仪器C。
(7)从实验误差角度分析,方案丙方案乙(填“优于”、“劣于”或“等同于”)。
26.(2009年安徽卷)(17分)
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和
浓度的废水中加入
,所产生的羟基自由基能氧化降解污染物。
现运用该方法降解有机污染物
,探究有关因素对该降解反应速率的影响。
[实验设计]控制
的初始浓度相同,恒定实验温度在298K或313K(基余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)
实验考号
实验目的
T/K
pH
c/10-3mol·L-1
H2O2
Fe2+
①
为以下实验作参照物
298
3
6.0
0.30
②
探究温度对降解反应速率的影响
③
298
10
6.0
0.30
[数据处理]实验测得
的浓度随时间变化的关系如右上图。
(2)请根据右上图实验①曲线,计算降解反应在50~150s内反应速率:
=
。
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。
但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂
的角度分析原因:
。
(4)实验③得出的结论是:
pH等于10时,。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。
根据上图中的信息,给出一种迅速停止反应的方法:
。
27.(2009年江苏卷)(10分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。
以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。
检验Fe(OH)3是否沉淀完全的实验操作是_____▲_____。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:
①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③_____▲_____。
(3)测定样品中Cl-含量的方法是:
a.称取0.7500g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用0.05000mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39mL。
①上述测定过程中需用溶液润洗的仪器有_____▲_____。
②计算上述样品中CaCl2·2H2O的质量分数为_____▲_____。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有_____▲_____;_____▲_____。
28.(2009年全国1卷)(11分)(注意:
在试题卷上作答无效)
已知2H2O2=2H2O+O2↑,可以通过观察反应过程中O2的生成速度(即起气泡从溶液中释放的速度)来判断H2O2分解反应的速度。
请用所给的实验材料和用具设计实验,使其能同时验证过氧化氢酶具有催化作用和高效性。
要求写出实验步骤、预测实验结果、得出结论,并回答问题。
实验材料与用具:
适宜浓度的H2O2溶液,蒸馏水,3.5%FeCl3溶液,0.01%牛过氧化氢酶溶液,恒温水浴锅,试管。
(1)实验步骤:
①
(2)实验结果预测及结论:
整个实验中,不同处理的试管中
的释放速度从快到慢依次是:
。
由此可得出的结论是。
(3)如果仅将实验中的恒温水浴改为
,重做上述实验,
释放的速度最快的是,原因是
。
29.(2009年四川卷)(16分)
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。
某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
Ⅰ.测定过氧化的含量
请填写下列空白:
(1)移取10.00m密度为ρg/mL的过氧化氢溶液至250mL___________(填仪器名称)中,加水衡释至刻度,摇匀。
移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
(3)滴定时,将高锰酸钾标准溶液注入______________________(填“酸式”或“碱式”)滴定管中。
滴定到达终点的现象是__________________________________________
______________________________________________________________。
(4)复滴定三次,平均耗用cmol/LKMnO4标准溶液VmL,则原过氧化氢溶液中过氧化
氢的质量分数为______________________________________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏
高”或“偏低”或“不变”)。
II.探究过氧化氢的性质
该化学举小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。
(实验条件:
试剂只有过氧化氢溶液、氯水、碘化钾演粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。
)
请将他们的实验方法和实验现象填入下表:
实验内容
实验方法
实验现象
验证氧化性
验证不稳定性
30.(2009年天津卷)(18分)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列;从海水中提取食盐和溴的过程如下:
(1)请列举海水淡化的两种方法:
、 。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、 、 、或H2、 。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br,其目的为 。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。
微溶于水,有毒性和强腐蚀性。
他们参观生产过程后,了如下装置简图:
请你参与分析讨论:
①图中仪器B的名称:
。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是 。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
。
④C中液体产生颜色为 。
为除物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
31.(2009年上海卷)根据硫化氢气体的实验室制法和性质完成下列填空。
(1)若用启普发生器制取硫化氢气体,则制取气体的原料可选用。
a.稀硫酸与硫化亚铁b.稀硝酸与硫化亚铁
c.稀硫酸与硫化钠d.稀盐酸与硫化亚铁
(2)现要组装一套可以控制硫化氢气体产生速率的装置,请在下图中选择合适的仪器:
(填编号)。
(3)如右图,在一个充满氧气的集气瓶中加入少量品红稀
溶液,点燃硫化氢气体。
在火焰自动熄灭后,停止通
入气体,瓶内可观察到的现象是。
(4)在上述集气瓶中继续通入硫化氢气体,振荡,发生反应
的化学方程式为:
反应过程中,溶液的pH(填“变大”、“变小”或“不变”)。
(5)点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连续一个安全装置。
下图的装置能起到此作用的是。
(6)已知硫化氢气体在空气中的体积分数为4.3%~45.5%时会发生爆炸。
当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是。
32.(2009年上海卷)实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。
大理石的主要杂质是氧化铁,
以下是提纯大理石的实验步骤:
(1)溶解大理石时,用硝酸而不用硫酸的原因是。
(2)操作II的目的是,溶液A(溶质是共价化合物)是。
(3)写出检验滤液中是否含铁离子的方法:
。
(4)写出加入碳酸铵所发生反应的离子方程式:
写出滤液B的一种用途:
。
(5)CaO2中一般含CaO。
试按下列提示完成CaO2含量分析的实验设计。
试剂:
氢氧化钠标准溶液、盐酸标准溶液、酚酞
仪器:
电子天平、锥形瓶、滴定管
实验步骤:
①;②加入;③加入酚酞,用氢氧化钠标准溶液滴定。
(6)若理论上滴定时耗用标准溶液20.00mL恰好完全反应,实际操作中过量半滴(1mL溶液为25滴),则相对误差为。
答案:
1B2D3B4B5C6A7D8A9B10D11C12B13B14AD15D16A17D18B19B20C21C22A
23.(共12分)
【命题意图】考查考生化学实验基本操作技能和处理问题的能力,以及对试验结果进行计算和误差分析判断的能力
(1)关闭活塞K,微热反应管,试管A中有气泡冒出,停止加热。
冷却后若末端导管中水柱上升且高度保持不变,则说明装置气密性良好。
(2)防止反应过程中空气进入反应管;便于观察N2的流速
(3)熄灭酒精灯,待反应管冷却至室温,停止通入N2,并关闭活塞K。
(4)①2.80
②O2和N2分别与等量的Ca反应,生成CaO的质量高于Ca3N2。
若通入的N2中混有少量的O2,会导致计算出n(N)偏大,所以n(Ca)/n(N)<3/2,即x<3。
24.(共12分)
【命题意图】考查考生对元素及其化合物性质的掌握,对物质进行检验的实验技能,考查考生运用相关知识对实验提出假设及设计方案的能力。
(1)CO2和CO
(2)利用焰色反应透过蓝色钴玻璃,观察到紫色的火焰
(3)①全部为铁单质全部为FeO同时存在铁单质和FeO
③
实验步骤
预期现象与结论
步骤1:
取适量固体产物与试管中,加入足量蒸馏水,充分振荡使碳酸钾完全溶解。
分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体
固体产物部分溶解
步骤2:
向试管中加入适量硫酸铜溶液,再加入少量不溶固体,充分振荡
(1)若蓝色溶液颜色及加入的不溶固体无明显变化,则假设2成立。
(2)若蓝色溶液颜色明显改变,且有暗红色固体生成,则证明有铁单质存在
步骤3:
继续步骤2中的
(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色。
取少量固体于试管中,滴加过量HCl,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN
结合步骤2中的
(2):
(1)若溶液基本无色,则假设1成立
(2)若溶液呈血红色,则假设3成立
25.(17分)
(1)c
(2)D
(3)
(4)金属锌的密谋(或其他合理答案)
(5)偏大
(6)
(或其他合理答案)
(7)劣于
26.
(1)
实验
编号
实验目的
T/K
pH
c/10-3mol·L-1
H2O2
Fe2+
①
②
313
3
6.0
0.30
③
探究溶液的pH对降解反应速率的影响
(2)8.0×10-6
(3)过氧化氢在温度过高时迅速分解。
(4)反应速率趋向于零(或该降解反应趋于停止)
(5)将所取样品迅速加入到一定量的NaOH溶液中,使pH约为10(或将所取样品骤冷等其他合理答案均可)
27.(本题10分)
(1)取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe(OH)3沉淀完全
(2)防止溶液吸收空气中的CO2
(3)①酸式滴定管②99.9%③样品中存在少量的NaCl少量CaCl2·2H2O失水
20.(本题10分)
28.
(1)①取3支试管,各加入等量且适量的H2O2溶液,放入37℃恒温水浴锅中保温适当时间
②分别向上述3支试管