高考化学专题题库铁及其化合物的综合题及详细答案.docx
《高考化学专题题库铁及其化合物的综合题及详细答案.docx》由会员分享,可在线阅读,更多相关《高考化学专题题库铁及其化合物的综合题及详细答案.docx(19页珍藏版)》请在冰豆网上搜索。
高考化学专题题库铁及其化合物的综合题及详细答案
高考化学专题题库∶铁及其化合物的综合题及详细答案
一、高中化学铁及其化合物
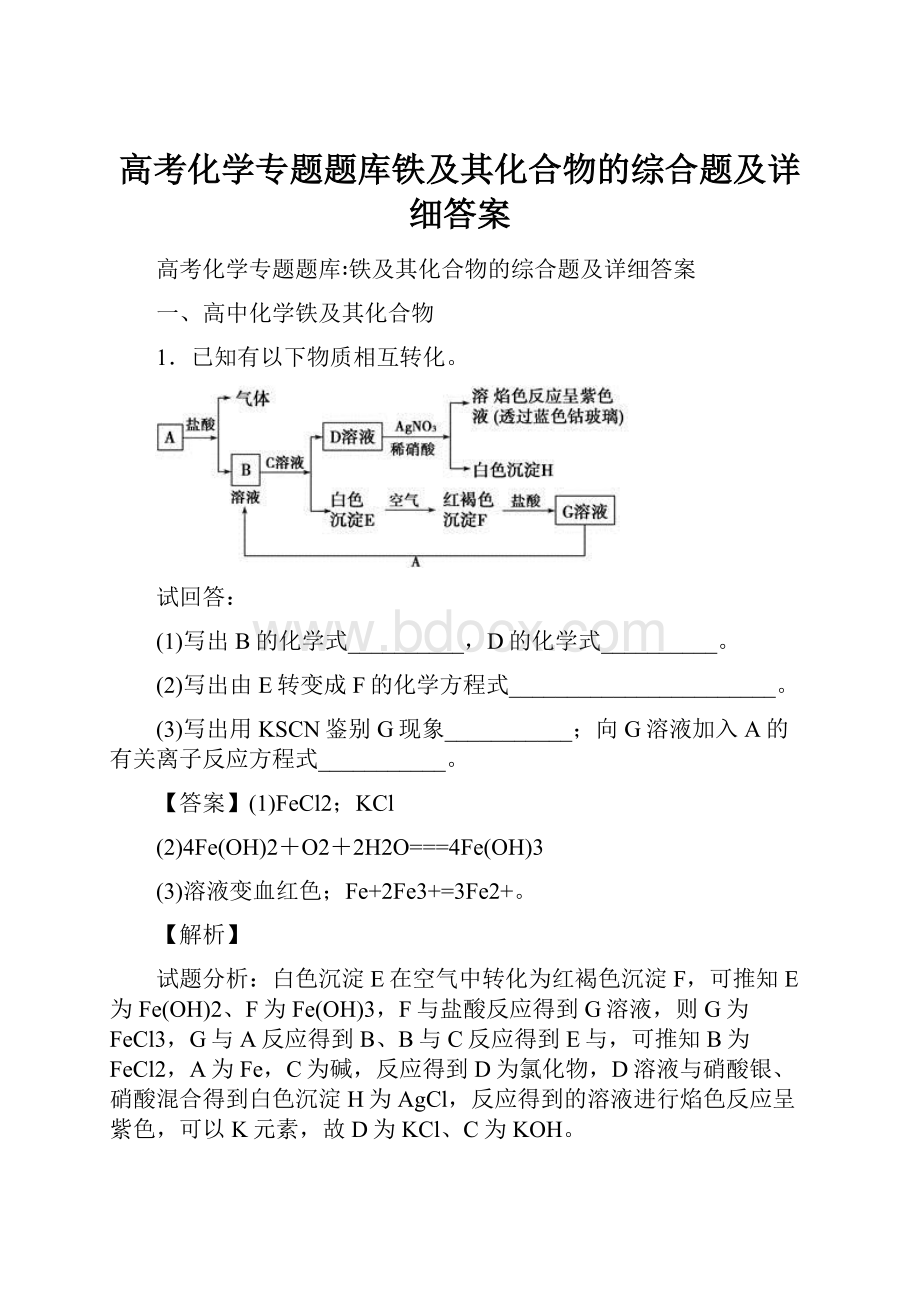
1.已知有以下物质相互转化。
试回答:
(1)写出B的化学式__________,D的化学式__________。
(2)写出由E转变成F的化学方程式_______________________。
(3)写出用KSCN鉴别G现象___________;向G溶液加入A的有关离子反应方程式___________。
【答案】
(1)FeCl2;KCl
(2)4Fe(OH)2+O2+2H2O===4Fe(OH)3
(3)溶液变血红色;Fe+2Fe3+=3Fe2+。
【解析】
试题分析:
白色沉淀E在空气中转化为红褐色沉淀F,可推知E为Fe(OH)2、F为Fe(OH)3,F与盐酸反应得到G溶液,则G为FeCl3,G与A反应得到B、B与C反应得到E与,可推知B为FeCl2,A为Fe,C为碱,反应得到D为氯化物,D溶液与硝酸银、硝酸混合得到白色沉淀H为AgCl,反应得到的溶液进行焰色反应呈紫色,可以K元素,故D为KCl、C为KOH。
(1)由上述分析可知,B为FeCl2,D为KCl,故答案为FeCl2;KCl;
(2)E转变成F的化学方程式为:
4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)用KSCN鉴别FeCl3溶液的现象为:
溶液呈血红色,向FeCl3溶液加入Fe的离子方程式为:
Fe+2Fe3+=3Fe2+故答案为血红色;Fe+2Fe3+=3Fe2+。
考点:
考查了无机物推断、Fe、Cl、K元素化合物的性质的相关知识。
2.某金属X,为了确定其成分,进行一系列实验,实验过程和发生的现象如下图所示:
⑴写出金属X的化学式_________。
⑵写出溶液B中溶质的化学式_________。
⑶写出白色沉淀C转变为红褐色沉淀D的化学方程式_________。
【答案】FeFeCl24Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】
【分析】
金属与盐酸反应生成无色可燃性气体为氢气,白色沉淀与氧气反应生成红褐色沉淀,则金属为Fe;
【详解】
(1)分析可知,金属X为Fe;
(2)溶液B为氯化亚铁;
(3)白色沉淀为氢氧化亚铁,在空气中与氧气反应生成氢氧化铁,方程式为:
4Fe(OH)2+O2+2H2O=4Fe(OH)3;
3.现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示
图中有些反应的生成物和反应的条件没有标出
。
请根据以上信息完成下列各题:
(1)写出下列物质的化学式:
B_______、丙__________。
(2)写出黄绿色气体乙的一种用途___________,反应过程⑦可能观察到的实验现象是______。
对应的化学方程式是_______。
(3)反应③中的离子方程式是_________。
【答案】AlHCl杀菌消毒、强氧化剂、漂白白色沉淀迅速变成灰绿色,最终变成红褐色4Fe(OH)2+O2+2H2O=4Fe(OH)32Al+2OH-+2H2O=2AlO2-+3H2↑
【解析】
【分析】
金属A颜色反应为黄色证明A为金属Na,Na与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应产生H2,说明B为金属Al,黄绿色气体乙为Cl2,气体甲是H2,H2和Cl2反应生成丙为HCl,HCl溶于水得到的物质E为盐酸溶液,盐酸与金属C反应产生F溶液是金属氯化物,该氯化物与Cl2还可以反应产生G,G与NaOH溶液反应生成红褐色沉淀H为Fe(OH)3,则G为FeCl3,推断物质F为FeCl2;判断C为Fe,以此解答该题。
【详解】
根据上述分析可知A是Na,B是Al,C为Fe,气体甲是H2,气体乙是Cl2,气体丙是HCl;D是NaOH,E是盐酸,F是FeCl2,G是FeCl3,H是Fe(OH)3。
(1)根据上述分析可知,物质B是Al,丙是HCl;
(2)黄绿色气体乙是Cl2,该物质可以与水反应产生HCl和HClO,HClO具有强氧化性,可作氧化剂,氧化一些具有还原性的物质,也用于杀菌消毒或用于物质的漂白;
(3)FeCl2与NaOH溶液发生反应:
FeCl2+2NaOH=Fe(OH)2↓+2NaCl,Fe(OH)2具有还原性,容易被溶解在溶液中的氧气氧化,发生反应:
4Fe(OH)2+O2+2H2O=4Fe(OH)3,固体由白色迅速变为灰绿色,最后变为红褐色,因此可观察到的实验现象是白色沉淀迅速变成灰绿色,最终变成红褐色;
(4)反应③是Al与NaOH溶液发生反应产生NaAlO2和H2,反应的离子方程式为:
2Al+2OH-+2H2O=2AlO2-+3H2↑。
【点睛】
本题是无机物推断,物质的颜色及转化关系中特殊反应是物质推断的突破口,再结合转化关系推断,需要学生熟练掌握元素化合物知识,试题培养了学生的分析能力及逻辑推理能力。
4.甲、乙、丙三种物质之间有如下转化关系:
(1)若甲和丙都是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液。
则甲是________(填化学式)。
写出“
”转化的离子方程式______________________。
(2)若乙溶液中加入
溶液,有血红色出现,则乙溶液中含有的离子是___________,甲的化学式为_____________。
【答案】
【解析】
【详解】
(1)甲和丙都是不溶于水的白色固体物质,按信息知甲为
、乙是硫酸铝,丙为
,则乙与氨水反应的离子方程式为:
;
(2)若乙溶液中加入
溶液,有血红色出现,则乙为硫酸铁,其溶液中含有铁离子,氧化物甲与硫酸反应得到硫酸铁溶液,因此甲为氧化铁。
【点睛】
铝离子与氨水反应的离子方程式容易出错,同学往往错误地把离子方程式写错成
。
5.A、B、C、D、E分别是铁或铁的化合物。
其中D是一种红褐色沉淀。
其相互反应关系如图所示:
根据如图所示变化,按要求回答下列问题:
(1)写出A、E的化学式:
A__,E__;
(2)写出其中几步反应的化学方程式:
C→B:
___;
B→D:
___;
E→A:
___。
(3)C中加入NaOH溶液,看到的现象是__。
【答案】FeFe2O32FeCl2+Cl2=2FeCl3FeCl3+3NaOH=Fe(OH)3↓+3NaClFe2O3+3CO
2Fe+3CO2(或Fe2O3+2Al
2Fe+Al2O3)出现白色沉淀,迅速变成灰绿色,最终变成红褐色
【解析】
【分析】
D是一种红褐色沉淀,应为Fe(OH)3,由转化关系可知E为Fe2O3,A为Fe,则B为FeCl3,C为FeCl2,结合对应物质的性质以及题目要求解答该题。
【详解】
(1)由以上分析可知A为Fe,E为Fe2O3,
故答案为:
Fe;Fe2O3;
(2)C为FeCl2,可与氯气反应生成FeCl3,方程式为2FeCl2+Cl2=2FeCl3,B为FeCl3,可与氢氧化钠溶液反应生成Fe(OH)3,方程式为FeCl3+3NaOH=Fe(OH)3↓+3NaCl,可经一氧化碳高温下还原(或铝热反应)生成Fe,方程式为Fe2O3+3CO
2Fe+3CO2(或Fe2O3+2Al
2Fe+Al2O3),
故答案为:
2FeCl2+Cl2=2FeCl3;FeCl3+3NaOH=Fe(OH)3↓+3NaCl;Fe2O3+3CO
2Fe+3CO2(或Fe2O3+2Al
2Fe+Al2O3);
(3)C为FeCl2,可与氢氧化钠溶液反应生成Fe(OH)2,出现白色沉淀,Fe(OH)2不稳定已被空气中的氧气氧化,迅速变成灰绿色,最终变成红褐色,
故答案为:
出现白色沉淀,迅速变成灰绿色,最终变成红褐色。
6.已知A是一种常见金属,F是一种红褐色沉淀。
根据图中转化关系,回答下列问题。
(1)写出F、G的化学式:
F.________;G._______。
(2)检验D中阳离子的方法为_____________________________________________________
(3)保存C溶液时要加固体A的原因是_____________________________________________
(4)写出下列转化的离子方程式:
①B→C:
______________________________________________________________________
②C→D:
______________________________________________________________________
【答案】Fe(OH)3Fe2O3取D溶液少许于试管中,加入几滴KSCN溶液,溶液变红色,证明含Fe3+防止Fe2+被O2氧化Fe3O4+8H+═Fe2++2Fe3++4H2O2Fe2++Cl2═2Fe2++2Cl−
【解析】
【分析】
A是一种常见金属,F是一种红褐色沉淀,由转化关系可知F为Fe(OH)3,A为Fe,Fe与氧气反应生成B为Fe3O4,四氧化三铁与盐酸反应得到氯化亚铁与氯化铁,故Fe与盐酸反应得到X为氢气、C为FeCl2,可推知E为Fe(OH)2、D为FeCl3,G为Fe2O3。
【详解】
(1)由上述分析可知,F为Fe(OH)3,G为Fe2O3;
(2)检验FeCl3中阳离子的方法为:
取D溶液少许于试管中,加入几滴KSCN溶液,溶液变红色,证明含Fe3+;
(3)保存FeCl2溶液时要加固体Fe的原因是:
防止Fe2+被O2氧化;
(4)①B→C的离子方程式:
Fe3O4+8H+═Fe2++2Fe3++4H2O;
②C→D的离子方程式:
2Fe2++Cl2═2Fe2++2Cl−;
【点睛】
物质的颜色是推断突破口,再结合转化关系推断各物质,需要学生熟练掌握元素化合物的性质
7.已知X、Y均为有刺激性气味的气体,且几种物质间有以下转化关系,部分产物未标出。
请回答下列问题。
(1)写出下列各物质的化学式:
X______、Y______、A______、B______、C______。
(2)反应①的离子方程式为____________。
【答案】Cl2SO2HClH2SO4FeCl32Fe3++SO2+2H2O=2Fe2++SO42-+4H+
【解析】
【分析】
A与硝酸酸化的AgNO3溶液反应产生白色沉淀,A中含Cl-;B与盐酸酸化的BaCl2溶液反应产生白色沉淀,B中含SO42-;又根据X、Y均为有刺激性气味的气体,且X能与
反应,则X为Cl2,Y为SO2,A为HCl,B为H2SO4,C为FeCl3。
【详解】
(1)分析可知,X为Cl2,Y为SO2,A为HCl,B为H2SO4,C为FeCl3。
(2)反应①为氯化铁与二氧化硫发生氧化还原反应,离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+。
8.A、B、C、D四种化合物,其中A、C、D焰色反应均为黄色(含钠元素),而B的焰色反应为紫色(含钾元素),A、C和盐酸反应均得到D,将固体C加热可得到A,若在A的溶液中通入一种无色无味气体,又可制得C,若B的溶液滴加到硫酸亚铁溶液会先后出现白色沉淀→灰绿色沉淀→红褐色沉淀E。
试写出各物质的化学式:
A:
__、B:
__、C:
__、D:
__、E:
___。
【答案】Na2CO3KOHNaHCO3NaClFe(OH)3
【解析】
【详解】
A、B、C、D四种化合物,其中A、C、D焰色反应均为黄色,含有钠元素。
而B的焰色反应为紫色,含有钾元素;A、C和盐酸反应均得到D,将固体C加热可得到A,若在A的溶液中通入一种无色无味气体,又可制得C,这说明C是碳酸氢钠,A是碳酸钠,D是氯化钠,通入的无色气体是二氧化碳。
B的溶液滴加到硫酸亚铁溶液先后出现白色沉淀→灰绿色沉淀→红褐色沉淀,说明溶液中发生了反应:
Fe2+→Fe(OH)2(白色沉淀)→Fe(OH)3(红褐色沉淀),E是氢氧化铁,由于B的溶液中阴离子只有一种,所以B是KOH。
答案为:
Na2CO3;KOH;NaHCO3;NaCl;Fe(OH)3
【点睛】
要熟悉常见物质的物理性质和化学性质,特别要熟悉物质之间的转化关系。
如本题中,Na2CO3和NaHCO3之间可以相互转化:
Na2CO3+CO2+H2O=2NaHCO3,2NaHCO3
Na2CO3+CO2↑+H2O;Fe2+的转化:
Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3。
9.已知A是一种常见金属,F是一种红褐色沉淀,试根据图中转化关系,回答下列问题。
(1)写出A、C、F、G的化学式:
A_________,C________,F________,G_________。
(2)检验D中阳离子的方法为________________________
(3)保存C溶液时要加固体A的原因__________________
(4)写出下列转化的离子方程式或化学方程式。
①E→F的化学反应方程式:
_________________________
②C→D的离子反应方程式:
_________________________
【答案】FeFeCl2Fe(OH)3Fe2O3取D溶液少许于试管中,加入几滴KSCN溶液,溶液变红色,证明含Fe3+(答案合理即可)防止Fe2+被O2氧化变质4Fe(OH)2+O2+2H2O=4Fe(OH)32Fe2++Cl2=2Fe3++2Cl-
【解析】
【分析】
A是一种常见金属,F是一种红褐色沉淀,由转化关系可知F为Fe(OH)3,A为Fe,Fe与氧气反应生成B为Fe3O4,四氧化三铁与盐酸反应得到氯化亚铁与氯化铁,故Fe与盐酸反应得到X为氢气、C为FeCl2,可推知E为Fe(OH)2、D为FeCl3,G为Fe2O3。
【详解】
(1)根据分析可知A为Fe,C为FeCl2,F为Fe(OH)3,G为Fe2O3,故答案为:
Fe;FeCl2;Fe(OH)3;Fe2O3;
(2)D为FeCl3,含有阳离子为Fe3+,检验Fe3+离子的方法为:
取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液变红色,证明有Fe3+,故答案为:
取D溶液少许于试管中,加入几滴KSCN溶液,溶液变红色,证明含Fe3+(答案合理即可);
(3)FeCl2易被空气中氧气氧化,保存FeCl2溶液时加固体Fe,防止Fe2+被氧气氧化,故答案为:
防止Fe2+被氧气氧化;
(4)E转化为F是氢氧化亚铁被氧气氧化生成氢氧化铁,现象是:
白色沉淀迅速变成灰绿色,最后变成红褐色;反应化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,C→D反应离子方程式为:
2Fe2++Cl2═2Fe3++2Cl-;故答案为:
4Fe(OH)2+O2+2H2O=4Fe(OH)3;2Fe2++Cl2=2Fe3++2Cl-。
【点睛】
本题涉及Fe元素单质化合物的性质及转化,物质的颜色是推断突破口,再结合转化关系推断各物质,掌握元素化合物的性质是解题的关键。
10.已知A是一种常见金属,部分反应物或生成物已略去。
试根据图中转化关系,回答下列问题。
(1)B的俗名为____。
(2)保存C溶液时需加入少量A的原因是____,A与水蒸气反应的化学方程式为____,该反应类型属于____(填基本反应类型)
(3)E生成F可观察到的现象____,化学方程式为____。
(4)写出B→C化学方程式为____,C→D的离子方程式为____。
【答案】磁性氧化铁防止Fe2+被O2氧化3Fe+4H2O
Fe3O4+4H2置换反应白色沉淀迅速变成灰绿色,最终变成红褐色4Fe(OH)2+2H2O+O2=4Fe(OH)3Fe3O4+8HCl=FeCl2+2FeCl3+4H2O2Fe2++Cl2=2Fe3++2Cl-
【解析】
【分析】
A是一种常见金属,燃烧后生成的氧化物B与盐酸反应能够生成两种氯化物,符合条件的常见金属是铁,所以由图中转化关系得,A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,X为H2,E为Fe(OH)2,F为Fe(OH)3,G为Fe2O3。
【详解】
(1)由分析可知B为Fe3O4,俗名为磁性氧化铁,故答案为:
磁性氧化铁;
(2)因为Fe2+极易被O2氧化,所以保存FeCl2溶液时需加入少量Fe,Fe与水蒸气反应的化学方程式为3Fe+4H2O
Fe3O4+4H2,该反应属于置换反应,故答案为:
防止Fe2+被O2氧化;3Fe+4H2O
Fe3O4+4H2;置换反应;
(3)Fe(OH)2沉淀在空气中被氧化生成Fe(OH)3,可观察到的现象是白色沉淀迅速变成灰绿色,最终变成红褐色,化学方程式为:
4Fe(OH)2+2H2O+O2=4Fe(OH)3;故答案为:
白色沉淀迅速变成灰绿色,最终变成红褐色;4Fe(OH)2+2H2O+O2=4Fe(OH)3;
(4)Fe3O4与盐酸反应得化学方程式为Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,FeCl2与Cl2反应得离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:
Fe3O4+8HCl=FeCl2+2FeCl3+4H2O;2Fe2++Cl2=2Fe3++2Cl-。
11.已知A是一种淡黄色固体,可做供氧剂,C为具有磁性的黑色晶体,E的焰色反应为黄色,F为红褐色固体(部分产物已略去)。
(1)物质A、F的化学式分别是_____________、_____________。
(2)C→D的过程中第②步反应的离子方程式是____________________________________。
(3)如何检验D中的金属阳离子,说明具体的操作和实验现象________________________。
(4)E溶液与地壳中含量最多的金属元素的单质发生反应的化学方程式为______________。
(5)G与D溶液也能发生反应,其反应的类型为___________________(填序号)。
a.化合反应b.置换反应c.复分解反应d.氧化还原反应
【答案】Na2O2Fe(OH)32Fe2++Cl2=2Fe3++2Cl-取少量D溶液于试管中,滴加KSCN溶液,溶液显血红色(其它合理答案也得分2Al+2NaOH+2H2O=2NaAlO2+3H2↑ad
【解析】
【分析】
已知A是一种淡黄色固体,可做供氧剂,应为Na2O2,C为具有磁性的黑色晶体,应为Fe3O4,E的焰色反应为黄色,则由转化关系可知E为NaOH,B为O2,D为FeCl3,F为红褐色固体,应为Fe(OH)3,以此解答该题。
【详解】
(1)由以上分析可知A为Na2O2,F为Fe(OH)3,故答案为:
Na2O2;Fe(OH)3;
(2)C→D的过程中第②步反应的离子方程式是2Fe2++Cl2=2Fe3++2Cl-;
(3)D为FeCl3,阳离子为铁离子,检验铁离子,可取少量D溶液于试管中,滴加KSCN溶液,可观察到溶液显血红色,故答案为:
取少量D溶液于试管中,滴加KSCN溶液,溶液显血红色;
(4)地壳中含量最多的金属为铝,与氢氧化钠反应的方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(5)铁与氯化铁反应生成氯化亚铁,为化合反应和氧化还原反应,故答案为:
ad。
【点睛】
题目涉及浓硫酸、硝酸的性质,物质的颜色、反应现象及特殊反应是推断突破口,注意对基础知识的全面掌握。
12.将单质Fe和FeCl3、FeCl2、CuCl2的混合溶液一起放进烧杯中,搅拌、静置。
根据下述不同情况,填写金属单质或金属离子的符号。
(1)充分反应后,若Fe有剩余,则烧杯中不可能含有的金属离子是_____。
(2)充分反应后,如果烧杯中还有大量的Fe3+,则还会有的金属离子是_____。
(3)如果烧杯中Cu2+的物质的量减少了一半,则烧杯中一定没有的金属离子是____,一定没有的金属单质是______。
【答案】Fe3+、Cu2+Fe2+、Cu2+Fe3+Fe
【解析】
【分析】
在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,单质Fe和FeCl2、FeCl3、CuCl2,氧化性:
FeCl3>CuCl2>FeCl2,还原性Fe>Cu,铁先与氯化铁溶液反应,Fe有剩余,则溶液中不存在Fe3+、Cu2+,以此解答该题。
【详解】
在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,单质Fe和FeCl2、FeCl3、CuCl2,则铁先与氯化铁溶液反应。
氧化性:
FeCl3>CuCl2>FeCl2,还原性Fe>Cu;
①Fe有剩余,则溶液中不存在Fe3+、Cu2+;
②如容器内有大量Fe3+,说明金属Fe完全溶解且铜离子没有反应,所以还会有的金属离子是Fe2+、Cu2+;
③如有一半Cu2+剩余,说明铜离子已部分反应,所以氧化性强的铁离子已完全反应,则容器内一定没有的金属离子是:
Fe3+;则Fe完全溶解,一定没有Fe剩余。
【点睛】
考查Fe3+、Cu2+的氧化能力大小的比较,能正确判断固体的成分是解本题的关键;本题中根据Fe3+、Cu2+的氧化性强弱判断反应先后顺序,从而确定固体的成分、溶液的成分;有固体剩余,若固体只有铜,则反应后的溶液中一定无Fe3+存在,一定存在Fe2+,可能含有Cu2+;若有铁剩余,一定有铜生成,Fe3+和Cu2+无剩余。
13.已知A、B、C均为含铁化合物,请根据以下四种物质的转化过程回答相关问题:
Fe
A
B
C
(1)反应①、③中属于氧化还原反应的是________________(填序号)。
(2)向B的溶液中滴入几滴KSCN溶液后,可观察到的现象是__________。
(3)反应②的离子方程式为_____________。
【答案】①溶液呈血红色2Fe2++Cl2=2Fe3++2Cl-
【解析】
【分析】
根据铁的化学性质及图中的转化过程分析知,A为氯化亚铁,B为氯化铁,C为氢氧化铁,据此分析解答;根据铁离子的检验方法分析实验现象;根据氯气的氧化性书写相关反应的离子方程式。
【详解】
(1)反应①为铁和盐酸反应生成氯化亚铁和氢气,属于置换反应,是氧化还原反应,③是氯化铁与氢氧化钠溶液反应生成氢氧化铁沉淀和氯化钠,属于复分解反应,是非氧化还原反应,故答案为:
①;
(2)B为氯化铁溶液,铁离子遇到KSCN形成血红色溶液,故答案为:
溶液呈血红色;
(3)反应②是氯化亚铁被氯气氧化生成氯化铁,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:
2Fe2++Cl2=2Fe3++2Cl-。
14.已知:
如图中A是金属铁,请根据图中所示的转化关系,回答下列问题:
(1)写出下列物质对应的化学式B_______________、E________________;
(2)写出对应反应的化学方程式:
②________________________;
③_________________________;
⑤________________________;
(3)写出对应在溶液中反应的离子方程式:
④____________________。
【答案】Fe3O4Fe(OH)23Fe+4H2O
Fe3O4+4H2