高考化学试题分类汇编电化学基础.docx
《高考化学试题分类汇编电化学基础.docx》由会员分享,可在线阅读,更多相关《高考化学试题分类汇编电化学基础.docx(15页珍藏版)》请在冰豆网上搜索。
高考化学试题分类汇编电化学基础
2020高考化学试题分类汇编
电化学基础
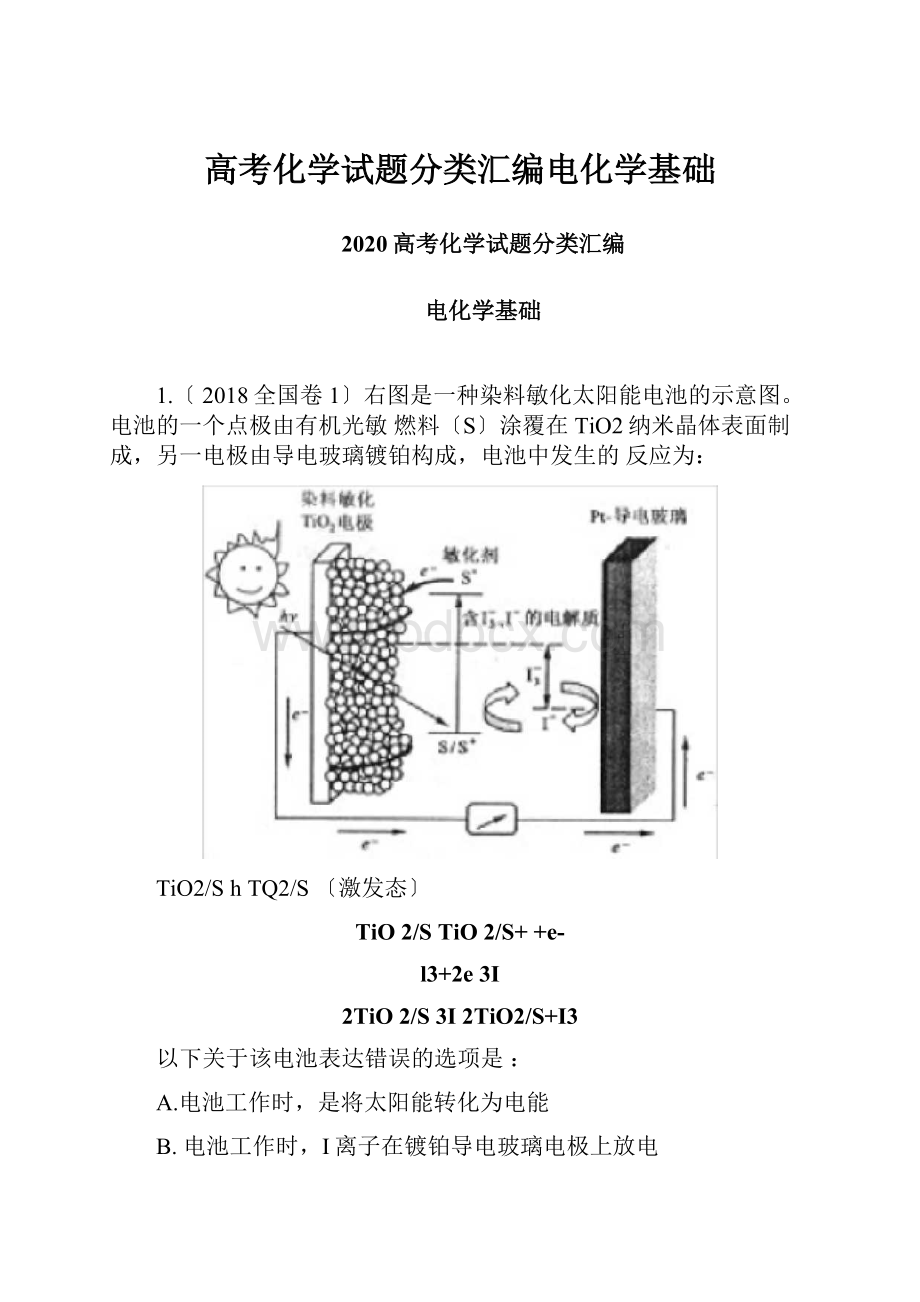
1.〔2018全国卷1〕右图是一种染料敏化太阳能电池的示意图。
电池的一个点极由有机光敏燃料〔S〕涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:
TiO2/ShTQ2/S〔激发态〕
TiO2/STiO2/S++e-
l3+2e3I
2TiO2/S3I2TiO2/S+I3
以下关于该电池表达错误的选项是:
A.电池工作时,是将太阳能转化为电能
B.电池工作时,I离子在镀铂导电玻璃电极上放电
C.电池中镀铂导电玻璃为正极
D.电池的电解质溶液中I-和I3-的浓度可不能减少
【解析】B选项错误,从示意图可看在外电路中电子由负极流向正极,也即镀铂电极做
正极,发生还原反应:
13-+2e-=3I-;A选项正确,这是个太阳能电池,从装置示意图可看出是个原电池,最终是将光能转化为化学能,应为把上面四个反应加起来可知,化学物质并没
有减少;C正确,见B选项的解析;D正确,此太阳能电池中总的反应一部分实质确实是:
还原.
氧化
I「3I-的转化〔还有I2+|一二|「〕,另一部分确实是光敏有机物从激发态与基态的
相互转化而已,所有化学物质最终均不被损耗!
【答案】B
【命题意图】考查新型原电池,原电池的两电极反应式,电子流向与电流流向,太阳能
电池的工作原理,原电池的总反应式等,还考查考生变通能力和心理素养,能否适应生疏的
情境下应用所学知识解决新的咨询题等
【点评】此题立意专门好,然而考查过为单薄,而且取材不是最新的,在3月份江苏省
盐都市高三第二次调研考试化学试题第17题〔3〕咨询,与此题极为相似的模型,这对一些考生显得不公平!
式为:
2Li++FeS+2G=Li2S+Fe有关该电池的以下中,正确的选项是
A.Li-AI在电池中作为负极材料,该材料中Li的化合价为+1价
B.该电池的电池反应式为:
2Li+FeS=Li2S+Fe
C.负极的电极反应式为Al-3e-=AI3+
D.充电时,阴极发生的电极反应式为:
Li2s+Fe-2e2LiFeS
试题解析:
此题涵盖电解池与原电池的主体内容,涉及电极判定与电极反应式书写等咨询题。
依照
给出的正极得电子的反应,原电池的电极材料Li-AI/FeS能够判定放电时〔原电池〕负极的电极反应式为Al-3e-=AI3+。
aLi和Al分不是两极材料。
B、应有AI的参加。
D应当是阳
极失电子反应。
此题答案:
C
教与学提示:
原电池与电解池的教学一定要重视电极反应式书写。
电极反应式书写是原电池和电解池内容或原理的核心。
原电池的教学能够从原电池反应的总反应式:
能够自发进行的氧化还原反应,负极反应〔因负极确实是参加反应的电极〕开始。
电解池的教学要从外加电源的正负极,分析阳极〔活性电极时本身参加反应〕开始,最终获得被进行的氧化还原反应。
简单记住:
沸〔负〕羊〔阳〕羊〔氧化〕。
〔2018广东理综卷〕23.铜锌原电池〔如图9〕工作时,以下表达正确的选项是
A正极反应为:
Zn—2e-=Zn2+
B电池反应为:
Zn+Cif+=Zn2++CU
C在外电路中,电子从负极流向正极
D盐桥中的K+移向ZnSQ溶液
解析:
Zn是负极,故A错;
电池总反应和没有形成原电池的氧化还原反应相同,故B正确;
依照闭合回路的电流方向,在外电路中,电子由负极流向正极,故C正确;
在溶液中,阳离子往正极移动,故D错误。
答案:
BC
〔2018安徽卷〕11.某固体酸燃料电池以CaHSO固体为电解质传递屮,其差不多结构见以
下图,电池总反应可表示为:
2H2+Q=2H2O,以下有关讲法正确的选项是
A.
电子通过外电路从b极流向a极
B.b极上的电极反应式为:
Q+2H2O+4e「=4OH
C.每转移0.1mol电子,消耗1.12L的H2
D.H+由a极通过固体酸电解质传递到b极
答案:
D解析:
第一明确a为负极,如此电子应该是通过外电路由a极流向b,A错;B选项反应应
为Q2+4e-+4H=2H2O;C没有告知标准状况。
〔2018福建卷〕11•铅蓄电池的工作原理为:
PbPbO22H2SO42PbSO42H2O研
读右图,以下判定不正确的选项是
A.K闭合时,d电极反应式:
2
PbSO42H2O2ePbO24HSO4
B.当电路中转移0•2mol电子时,I中消耗的H2SO4为0.2mol
C.K闭合时,II中SO:
向c电极迁移
D.K闭合一段时刻后,II可单独作为原电池,d电极为正极
【解析】答案:
C此题考查电化学〔原电池、电解池〕的相关知识
K闭合时I为电解池,n为电解池,n中发生充电反应,d电极为阳极发生氧化反应,其反
应式为PbSO+2H2O-2e-=PbO2+4H++SO42-因此A正确。
在上述总反应式中,得失电子总数为2e-,当电路中转移0.2mol电子时,能够运算出I中消耗的硫酸的量为0.2mol,因此B对。
K闭合一段时刻,也确实是充电一段时刻后n能够作为原电池,由于c表面生成
Pb,放电时做电源的负极,d表面生成PbO,做电源的正极,因此D也正确。
K闭合时d是
阳极,阴离子向阳极移动,因此C错。
〔2018江苏卷〕&以下讲法不正确的选项是
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.常温下,反应CsCO2g2COg不能自发进行,那么该反应的H>0
C.一定条件下,使用催化剂能加快反应速率并提高反应物的平稳转化率
D.相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱
【答案】AC
【解析】此题要紧考查的是相关的反应原理。
A项,铅蓄电池在放电过程中,负极反应
为其质量在增加;B项,该反应是典型的吸热反应,在常温下不能自
发进行;C项,催化剂能改变反应速率,不一定加快,同时它不能改变转化率;D项,
可知Fe的氧化性大于Cu2,综上分析可知,此题选AC项。
〔2018江苏卷〕11•右图是一种航天器能量储存系统原理示意图。
以下讲法正确的选项
是
A•该系统中只存在3种形式的能量转化
B•装置Y中负极的电极反应式为:
O2+2H2O+4e40H
C.装置X能实现燃料电池的燃料和氧化剂再生
D•装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化
【答案】C
【解析】此题要紧考查的是电化学知识。
A项,在该装置系统中,有四种能量转化的关系,
即太阳能、电能、化学能和机械能之间的相互转化;B叽装置Y为氢氧燃料电池,负极电
极反应为Hz-2e-+20H-=2H2O;C项,相当于用光能电解水,产生Hz和02,实现燃料〔
和氧化剂〔C2〕的再生;D项,在反应过程中,有能力的损耗和热效应的产生,不可能实现化学能和电能的完全转化。
综上分析可知,此题选C项。
〔2018天津卷〕7.〔14分〕X、Y、Z、L、M五种元素的原子序数依次增大。
X、Y、Z、L是
组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答以下咨询题:
⑴L的元素符号为;M在元素周期表中的位置为;五种元素
的原子半径从大到小的顺序是〔用元素符号表示〕。
⑵Z、X两元素按原子数目比I:
3和2:
4构成分子A和B,A的电子式为___,B的结构
式为。
⑶硒〔se〕是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,
那么Se的原子序数为,其最高价氧化物对应的水化物化学式为。
该族2~5
周期元素单质分不与H2反应生成Imol气态氢化物的反应热如下,表示生成1mol硒化氢
反应热的是〔填字母代号〕。
-1-1-1
a.+99.7mol•Lb.+29.7mol•Lc.—20.6mol•Ld.—241.8kJ•mol
-1
⑷用M单质作阳极,石墨作阴极,NaHCO溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。
写出阳极生成R的电极反应式:
;由R生成Q的化
学方程式:
。
解析:
(1)X、Y、Z、L是组成蛋白质的四种元素且原子序数依次增大,故分不为:
HCN
O元素;M是地壳中含量最高的元素,为Al,其在周期表的位置为第3周第川A族;再依照
五种元素在周期表的位置,可知半径由大到小的顺序是:
Al>C>N>O>Ho
(2)N和H1:
3构成的分子为NH,电子式为3;2:
4构成的分子为NbH,其结构式为
HH
〔2018山东卷〕29.〔12分〕对金属制品进行抗腐蚀处理,可延长其使用寿命。
〔1〕以下为铝材表面处理的一种方法:
子方程式表示〕。
为将碱洗槽液中铝以沉淀形式回收,最好向槽液中加入以下试剂中的
a.NH3b.CQc.NaOHd.HNO
②以铝材为阳极,在HaSQ溶液中电解,铝材表面形成氧化膜,阳极电极反应为。
取
少量废电解液,加入NaHCQ溶液后产动气泡和白色沉淀,产生沉淀的缘故是。
〔2〕镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的缘故是
〔3〕利用右图装置,能够模拟铁的电化学防护。
假设X为碳棒,为减缓铁的腐蚀,开关K应置于处。
假设X为锌,开关K置于M处,该电化学防护法称为解析:
(1)①冒气泡的缘故是Al与NaOH反应了,方程式为:
2AI+2QH+4HQ==2AI(QH)4-+3H2;使AI(QH)4-生成沉淀,最好是通入CQ,加HNQ的话,沉淀容易溶解。
②阳极是AI发生氧化反应,要生成氧化膜还必须有H2Q参加,故电极反应式为:
2AI+3H2Q-6e-——AI2Q3+6H;加入NaHCQ溶液后产动气泡和白色沉淀,是由于废电解液中含有AI3+,和
HCQ发生了互促水解。
2+
(2)电镀时,阳极Cu能够发生氧化反应生成Cu。
(3)铁被爱护,能够是做原电池的负极,或者电解池的阴极,故假设X为碳棒,开关K应置
于N处,Fe做阴极受到爱护;假设X为锌,开关K置于M处,铁是做负极,称为牺牲阳极
爱护法。
答案:
〔1〕①2AI+2QH-+4HQ==2AI(QH)4-+3H;c
②2AI+3H2Q-6e-——AI2^+6^[;因为AI3+和HCQ发生了互促水解;
AI3++3HCQ==AI(QH)3J+CQf
⑵阳极Cu能够发生氧化反应生成Cu2+
(3)N牺牲阳极爱护法。
〔2018安徽卷〕27.〔14分〕锂离子电池的广泛应用使回收利用锂货源成为重要课题:
某研
究性学习小组对废旧锂离子电池正极材料〔LiMnzQ、碳粉等涂覆在铝箔上〕进行资源回收研究,设计实验流程如下:
〔1〕第②步反应得到的沉淀X的化学式为。
〔2〕第③步反应的离子方程式是。
〔3〕第④步反应后,过滤Li2CO所需的玻璃仪器有假设过滤时发觉滤液中有少量浑浊,从实验操作的角度给出两种可能的缘故:
〔4丨假设废旧锂离子电池正极材料含LiNBzO的质量为18.1g第③步反应中加入
20.0mL3.0mol•L-1的HbSQ溶液。
定正极材料中的锂经反应③和④完全为Li2CQ,剩至少有
NatCO参加了反应。
答案:
〔1〕Al(QH)3
(2)4LiMn2Q+Q+4lH=4Li++8MnQ+2HQ
(3)漏斗玻璃棒烧杯;滤纸破旧、滤液超过滤纸边缘等
〔4〕5.3
解析:
第一步确实是铝溶解在氢氧化钠溶液中第二步确实是偏铝酸钠与二氧化碳生成氢氧
化铝,第三步是氧化还原反应,注意依照第一步反应LiMn2O不溶于水。
第〔4〕小题运算时要通过运算判定出硫酸过量。
〔2018四川理综卷〕27.(16分)
碘被称为”智力元素",科学合理地补充碘可防止碘缺乏病。
碘酸钾(KIQ3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。
碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。
以碘为原料,通过电解制备碘酸钾的实验装置如右图所示。
请回答以下咨询题:
(1)碘是(填颜色)固体物质,实验室常用
方法来分离提纯含有少量杂质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:
312+6KOH=5KI+KIO+3HO,将该溶液加入阳极区。
另将氢氧化钾溶液加入阴极区,电解槽用水冷却。
电解时,阳极上发生反应的电极反应式为;阴极上观看到的
实验现象是。
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有1—。
请设计一个检验电解液
中是否有厂的实验方案,并按要求填写下表。
要求:
所需药品只能从以下试剂中选择,实验仪器及相关用品自选。
试剂:
淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。
实验方法
实验现象及结论
(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
阳扱
—W
①
—>
0許
亠
1⑧丨►!
sits钾
电解液
蒸发浓綿
LgI
―■品体
步骤②的操作名称是,步骤⑤的操作名称是。
步骤④洗涤晶体的目的是
〔2〕2I2eI2(或I6OH6eIO33H2O)
有气泡产生
实验方法
实验现象及结论
取少量阳极区电解液于试管中,加稀硫酸酸
化后加入几滴淀粉试液,观看是否变蓝。
假如不变蓝,讲明无1。
〔假如
变蓝,讲明有1。
〕
〔4〕冷却结晶干燥洗去吸附在碘酸钾晶体上的氢氧化钾等杂质
解析:
〔1〕考查物质的物理性质,较容易。
〔2〕阳极发生氧化反应失电子
2I2eI2(或I60H6eIO33H2O)。
阴极区加入氢氧化钾溶液,电解氢氧
化钾实质是电解水。
〔3〕考查I-的检验此题借助与碘单质遇淀粉变蓝色这一特性,要设法将
碘离子转化为碘单质。
〔4〕考查实验的差不多操作。
要求考生对整个流程分析透彻。
〔2018重庆卷〕29.〔14分〕钒〔V〕及其化合物广泛应用于工业催化、新材料和新能源等领域.
〔1〕V2O5是接触法制硫酸的催化剂.
1一定条件下,SO2与空气反映tmin后,SO2和SO3物质的量浓度分不为amol/L
和bmol/L,那么SO2起始物质的量浓度为mol/L;生成SO3的化学反应速率为
mol/(L•min).
2工业制硫酸,尾气SO2用吸取.
〔2〕全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转
化的装置,其原理如题29图所示.
1当左槽溶液逐步由黄变蓝,其电极反应式为.
2充电过程中,右槽溶液颜色逐步由色变为色.
3放电过程中氢离子的作用是和;充电时假设转移的电子数为3.011023个,
左槽溶液中n(H+)的变化量为.
29.答案〔14分〕
〔1〕①ab;b/t
②氨水
2
〔2【①V022HeVOH2O
②绿紫
③参与正极反应;通过交换膜定向移动使电流通过溶液;0.5mol
【解析】此题考查以钒为材料的化学原理题,涉及化学反应速率和电化学知识。
(1)由S守恒可得,SO2的起始浓度为〔a+b〕mol/L。
SO2的速率为单位时刻内SO2浓
度的变化,即b/tmol/(L•min)。
SO2能够用碱性的氨水吸取。
(2)①左槽中,黄变蓝即为VO22生成VO2,V的化合价从+5降低为+4,得一个电子,
0原子减少,从图中知,其中H发生了移动,参与反应,由此写成电极反应式。
②作为原电池,左槽得电子,而右槽失电子。
充电作为电解池处理,有槽中那么为得电子,对应化合价降低,即为V3生成V2,颜色由绿生成紫。
③由电极反应式知,
23
H参与了反应。
溶液中离子的定向移动可形成电流。
n=N/NA=3.01X10/6.02X
23
10=0.5mol。
【规律总结】电化学试题的分析一样是从化合价着手,关于原电池,化合价升高的作为负极,化合价降低的作为正极,两极方程式相加即可得总反应。
关于电解池,化合价升高作为阳极,降低的作为阴极。
两者之间的关系是:
正极反应式颠倒即为阳极反应式,负极反应式颠倒即为阴极反应式。